贝采里乌斯
贝采里乌斯
瑞典虽然是北欧的一个小国,但是自18世纪以来,不但钢铁和机械工业处于先进行列,而且她的科学事业也十分发达,在近代化学发展过程中,人才辈出。瑞典出生的著名化学家是很多的,例如氧元素的三位发现人之一舍勒;创立电离学说的阿累尼乌斯;以研究炸药而闻名世界的诺贝尔;著名的分析化学家贝格曼、甘恩和布兰特;元素锂的发现人阿尔费德森;发现镍元素的克朗斯塔特;发现钽元素的爱克析格;发明超离心机,为测定和计算蛋白质分子量创造条件的斯维德贝格等。
但是19世纪前期最杰出的和成就最大的瑞典化学家贝采里乌斯,他对化学的贡献涉及许多重要领域,例如发现了三种化学元素;改革了化学符号;确定了很多化合物的化学式;测定了大约两千种化合物的化合量;发表了三张原子量表;发现异构现象;创立电化学说;提出催化剂概念。因此,贝采里乌斯被誉为化学大师。
1779年8月20日,贝采里乌斯出生于瑞典哥特兰德省东部的韦斐松答村,父母在他很小的时候就去世了,他自幼由祖父和姨母教养成人,在很困难的情况下完成了中学学业。1796年进入乌普萨拉大学学习医学,1802年获该校医学博士学位。毕业后担任斯德哥尔摩大学助教,1807年被提升为教授,此后,他长时期地在该校从事教学和科学研究。
贝采里乌斯最早研究的课题是分析化学和矿物分类。在今天,我们分析化学中使用的定量滤纸就是贝采里乌斯发明的,他制作了不含可溶性物质的滤纸,能准确地通过滤纸灰分的重量来计算沉淀的重量。他还向甘恩学习吹管分析,这种方法把火焰吹到一些金属氧化物上,氧化物便被熔化和还原为金属,然后根据金属颗粒的特性来鉴别这些金属氧化物及其矿物。
在贝采里乌斯之前,一般都是利用物理性质对矿物进行分类,贝采里乌斯则主张以化学性质为依据进行矿物分类,并写成《矿物学体系》一书。通过对矿物的研究还发现了三种新元素。
在斯德哥尔摩的西北,有一座法龙小镇,镇的周围开采黄铁矿。甘恩在这里开了一家硫酸厂。
当时,生产硫酸的方法都是古老的铅室法,贝采里乌斯在铅室底部发现了一种凝结出来的红色粉末,他用吹管分析法鉴定这种物质时,放出了如同腐败的萝卜一样的臭气,这种气味与用同样的方法鉴定碲(当时,碲已被F.J.缪勒发现)时所产生的气味一样,因此贝采里乌斯把这种红色粉末误认为碲。
法龙镇的黄铁矿中居然含有碲这种稀有元素,确实是一件很吸引人的事,贝采里乌斯决定从中提炼碲。最后,他从红色粉末中提炼出一种褐色物质,它能在空气中燃烧,并发出难闻的臭味。为了证实这种物质是碲,他还利用纯的氧化碲和碲化氢为原料制备出纯碲,进行对比实验。当用吹管分析法鉴定纯碲时,竟然闻不到臭味,这一对比实验不但证明了这种褐色物质不是碲,而且还间接地说明了过去用吹管分析法鉴定的碲不是一种纯碲试样,其中含有一种杂质,在吹管火焰加热时,这种杂质能发出难闻的臭味。这样,贝采里乌斯确认自己已经发现了一种新元素,它的性质介于硫和碲之间,他将这种新元素命名为Selenium(中译名为硒),含义是月亮(selene),表示这种元素的性质与碲相似,因为碲的英文名称是Tellurium,含义是地球。这是发生在1818年的事情。
硅作为地壳的基本组成元素,早就为人们所熟悉,因为大家处处可以碰到含硅的土壤、沙子、矿物。但是要制得单质硅却不是一件容易的事。化学家戴维虽然相信硅土(二氧化硅)不是一种元素,但是,即使利用强大的电池也难以将硅土分解,他还将钾蒸气通过红热的硅土,也未获得单质硅。盖·吕萨克和泰纳用金属钾还原四氟化硅,也只得到一种红褐色的很不纯的单质硅。贝采里乌斯重复了他们二人的实验,并用水对不纯的硅进行长时间的洗涤,终于将其中的杂质氟硅酸钾洗掉,得到了纯净的单质硅。接着他又用金属钾与氟硅酸钾的反应制得了单质硅,这是发生在1823年的事情。
在同一年,贝采里乌斯指出:锆可以用相同的方法制取。他将金属钾与氟锆酸钾的混合物放在铁管中,将管口密闭,然后放在坩埚中加热。反应完毕后,放置冷却,最后将管中的黑色粉末倾入蒸馏水中,就得到了金属锆的粉末。
铈是从瑞典柏斯耐斯铁矿山所产的一种比重极高的被称为“柏斯耐斯重石”的矿石中发现的。舍勒曾经分析过这种矿石,但他认为其中不含新金属。1803年贝采里乌斯、M.H.克拉普罗特和希辛格分析了这种矿石,从中发现了氧化亚铈和氧化高铈,他们将这种元素命名为Cerium(中译名为铈),但是他们并未制得金属铈。一直到几十年后希尔德布兰德和诺顿才用电解熔融的氯化亚铈制得了块状的金属铈。
至于钍的发现,贝采里乌斯曾经走过一段弯路,早在1815年他分析法龙镇所产的一种矿物时,曾发现了一种新的化合物,他认为这是一种新金属的氧化物。为了纪念古代北欧的雷神(Thor),他把这种金属命名为Thorium。到了1825年,他又进行了仔细的研究,发现这种新的化合物原来是磷酸钇,从而否定了自己在1815年作出的结论。又过了三年,他把金属钾和氟钍酸钾的混合物放在玻璃管中加热,制得了不纯的钍,才算真正发现了钍。
贝采里乌斯对化学的一大贡献是创造了一套用拉丁文字母表示的元素符号。在他以前,用符号来表示元素和化合物已经有相当长的历史了。古代的人们只知道金、银、铜、铁、锡、铅、汞七种金属和为数不多的元素,如硫、砷、锑、碳。由于古代的化学研究与占星学之间有一定的联系,所以古人就用行星的形象来表示这些金属。用太阳的符号表示金;用新月表示银;用金星表示铜;用火星表示铁;用木星表示锡;用土星表示铅;用水星表示汞。
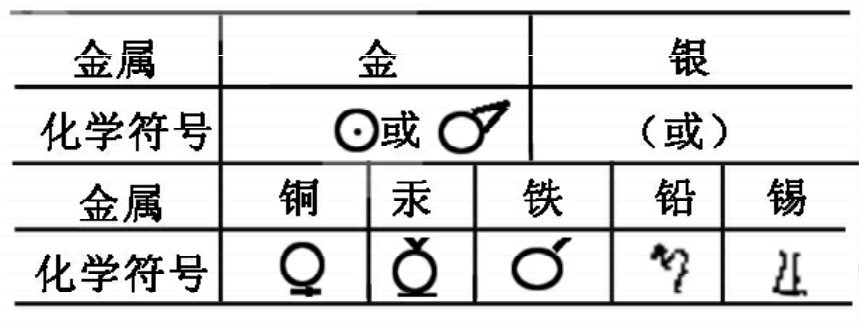

一直到了道尔顿时代,化学符号仍然没有跳出象形文字的圈子,例如道尔顿就采用圆圈或在圆圈内标出拉丁文字母的方法表示元素的符号。
道尔顿把上述基本的元素符号组合起来,就组成了各种化合物的符号:
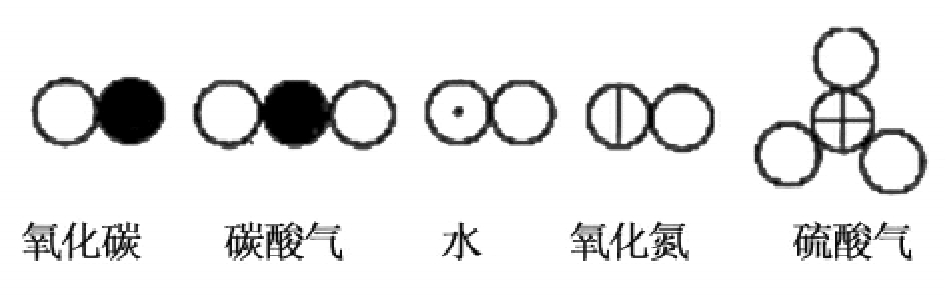
不难看出,道尔顿的化学符号写起来是很不方便的,例如为了表达明矾的分子式,就要用下面这样庞大的形式:
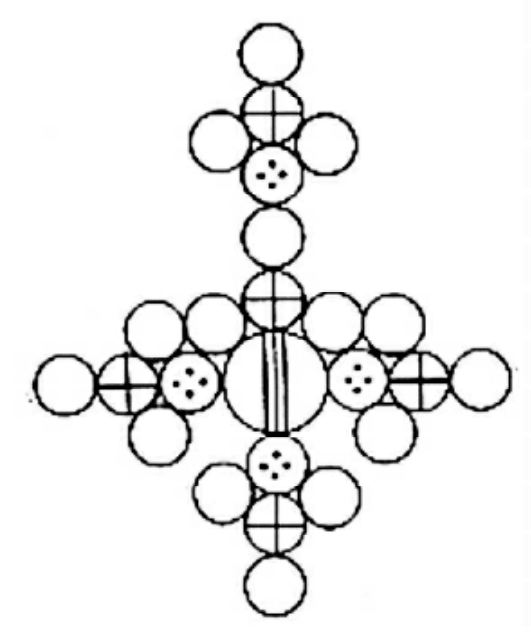
综合上述原因,贝采里乌斯对化学符号进行了改革。他所创造的符号比较简单,不用那么多的几何图形,而是取元素拉丁文名称的起首大写字母作为该元素的符号。如果几种元素的拉丁文名称的起首字母相同,则要加上另外一个小写字母以示区别。他在谈到这种表示方法的目的和特点时说:“这种新的化学符号是为了用作实验室中药品容器的标签而创造的,这是唯一的简明地表示药品的化学组成的方式。如果我们用文字和词汇来表达一个化合物,往往需要写一行字,但是使用化学符号则要简短得多,而且可以达到一目了然的效果。”他还用幂数(指数)的形式来表示化合物中元素的数目,例如SO2、P2O5。他的表示方法与我们现今所采用的方法的差别只在于他将阿拉伯数字放在右上角,而现在通用的符号是把数字放在右下角。但是直到现在,有些法国化学书上仍然把数字放在右上角。
现在看起来,贝采里乌斯对化学符号的改革对于化学的发展的确起过不小的作用。直到现在,每一个学习和研究化学的人都仍然在使用100多年以前创造的化学符号。
在贝采里乌斯的一生中,最费时间和精力的研究莫过于原子量测定。他确定了许多化合物的化学式,并且制备和提纯了试剂,设计了重量分析法,分析了2000种左右的化合物,测定了这些化合物中各种元素的化合量,即化合物中各种元素的重量组成关系,它是贝采里乌斯时代测定原子量的实验依据。
有了化合量,再制订出原子量标准,然后根据化合物的化学式,就可以计算出原子量,这就是原子量测定的全过程。化合量的测定工作虽然要求严格,工作量也很大,但只要有一定的实验技术和仪器,肯定能够得到结果。所以,测定原子量中最难解决的一个问题是如何确定化合物的化学式,即在某一种化合物中,各种元素是以什么比例互相化合的。
道尔顿确定化学式的前提是:“如果两种元素A和B,其化合的次序如下:
1个A原子与1个B原子相结合,形成二元化合物。
1个A原子与2个B原子相结合,形成三元化合物。
2个A原子与1个B原子相结合,形成三元化合物。
……以此类推。
当两种元素只有一种结合时(即只形成一种化合物时),就形成二元化合物;当两种元素有两种结合时(即能形成两种化合物时),就形成一种二元化合物和一种三元化合物;当两种元素有三种结合时,则形成一种二元化合物和两种三元化合物。”
根据当时的化学知识,氢和氧只能形成一种化合物——水,所以道尔顿认为在水这种化合物中,1个氢原子与1个氧原子相结合。根据同样的理由,在氨这种化合物中,也是1个氢原子与1个氮原子相结合。道尔顿把氢定为原子量标准,规定氢的相对重量为1,他按照盖·吕萨克对水的重量组成的分析结果(含12.6%氢,87.4%氧),计算出氧的原子量为7;根据对氨的重量组成的分析结果(含20%氢,80%氮),计算氮的原子量为4。显然,由于道尔顿对于化学式的错误判断,他所计算出来的原子量是不正确的。
贝采里乌斯对道尔顿所用的方法表示怀疑。根据盖·吕萨克气体化合定律:“在同温同压下,同体积的各种气体含有相同的原子数。”贝采里乌斯认为这一定律适用于单质气体,他认为:在化合物AmBn中,A和B两种元素的原子数目m与n之比等于生成这个化合物时A和B两种气体的最简单体积比。因为2体积氢气与1体积氧气化合,生成2体积水,所以根据气体化合定律推断,水是由2个氢原子与1个氧原子组成的,水的化学式是H2O。贝采里乌斯还认为原子量的标准应该采用氧,因为氧几乎能与当时所有的已知元素形成氧化物,所以他以氧=100为基准计算了一大批元素的原子量,比道尔顿的原子量要准确得多。
1814年贝采里乌斯发表的原子量表(部分)
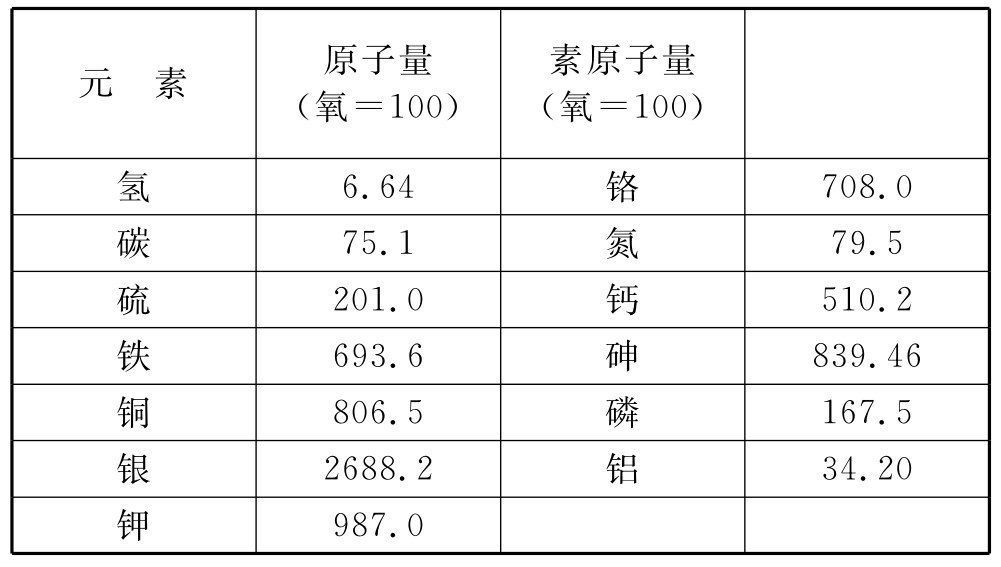
1818年贝采里乌斯发表的原子量表(部分)
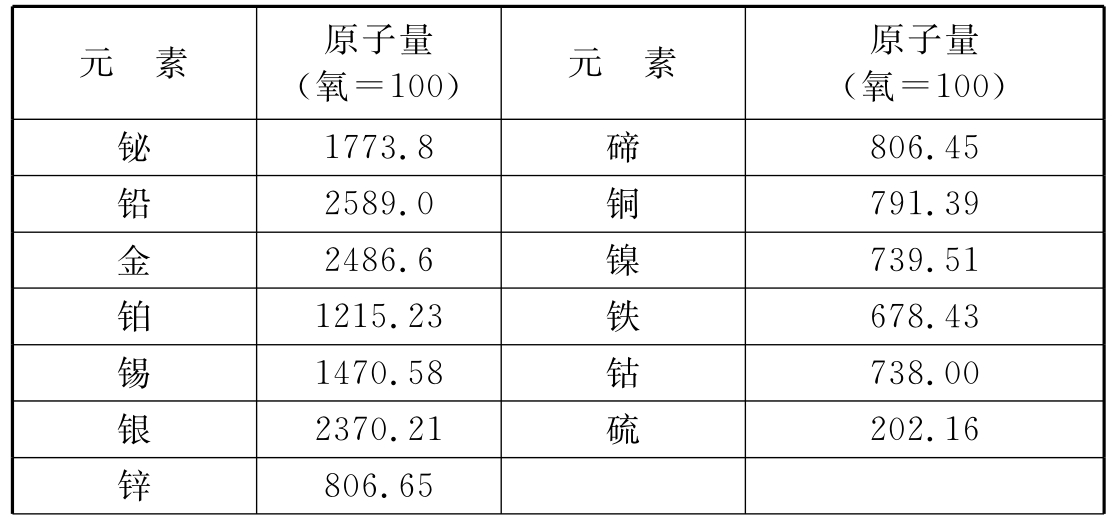
1819年法国化学家杜隆和贝蒂从对各种单质的比热测定中,发现许多固体单质的比热常常与它们的原子量成反比,即元素的比热与其原子量的乘积近似于一个常数,他们称这个常数为原子热容,这一规律被称为原子热容定律。这一定律对于确定一种元素的原子量到底是该元素的化合量的几倍起了重要作用。因此,即使不知道某种化合物的化学式,只要测出该化合物中元素的准确化合量和比热,就可以利用原子热容定律计算出该元素的原子量。
杜隆和贝蒂根据原子热容定律,对贝采里乌斯1818年发表的一些原子量进行了修正,例如将银的原子量修正为原值的1/4;钴的原子量修正为原值的1/3;金、锡、铅、锌、碲的原子量修正为原值的1/2等等。
贝采里乌斯的学生米希尔里希于1818年提出的同晶形定律对原子量测定也起了一定的作用。这个定律指出:“当两种化合物的结晶类型相同时,它们通常具有类似的化学式。”例如磷酸二氢钠与砷酸二氢钠是同晶形的,因此具有类似的化学式NaH2PO4和NaH2AsO4。贝采里乌斯和米希尔里希根据铬酸盐与硫酸盐具有同晶形这一事实,认为铬酸的化学组成应当与硫酸相似。已知硫酸的组成为SO3,铬酸的组成相应确定为CrO3。还知道氧化铬中的氧只是铬酸中氧的一半,因此规定氧化铬的组成为Cr2O3,这就意味着铬的原子量应当是贝采里乌斯发表的原子量的一半。
由于贝采里乌斯吸取了众家之长,使他能够得出比较正确的化学式和准确的原子量,尽管还不是很完善的,但是却是同时代化学家中的佼佼者。
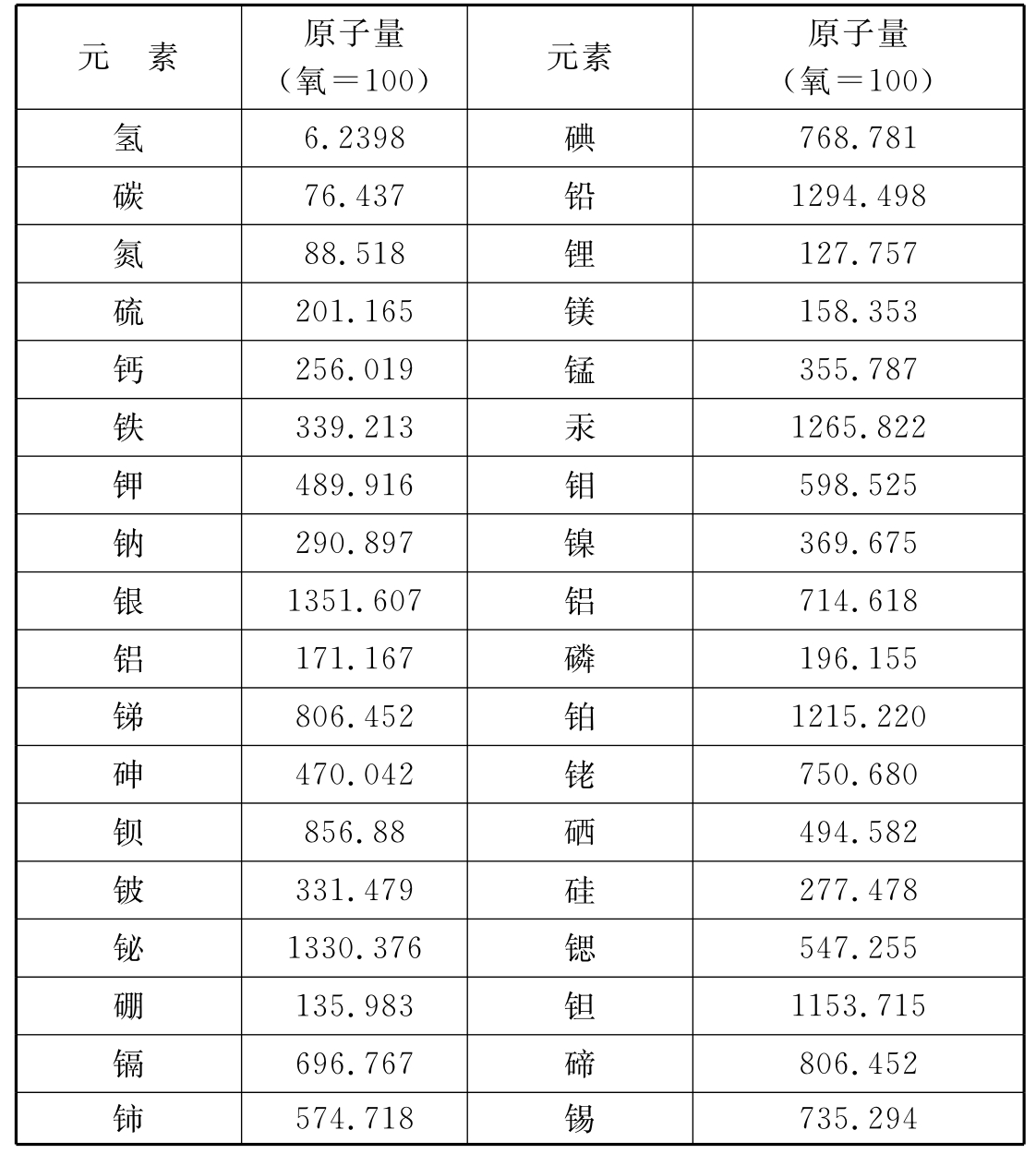
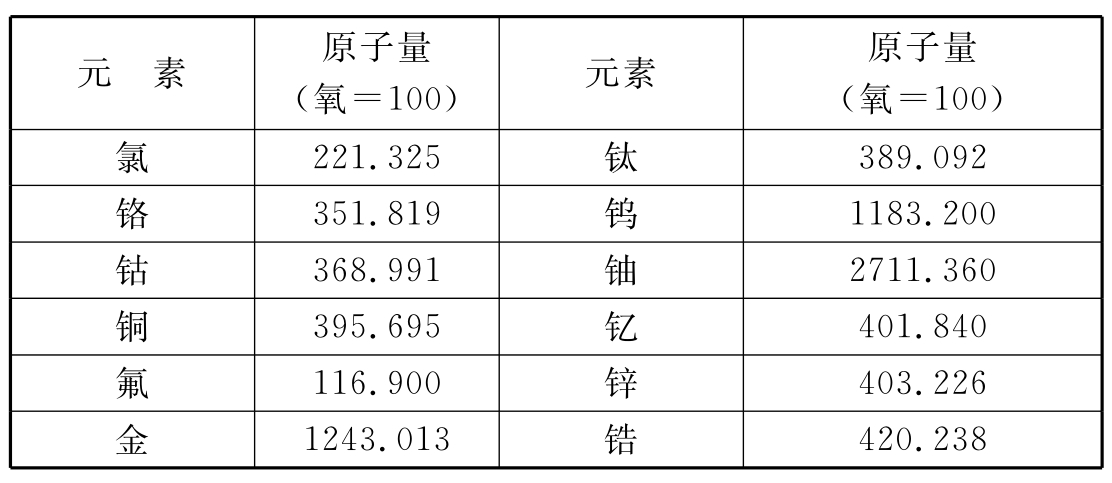
1826年贝采里乌斯发表的原子量表
贝采里乌斯之所以能够取得这么多的成就,主要是由于他重视实验。他把一生大部分的精力都用在实验测定上,在他1809-1819年的住宅内,就设有两间实验室,实验室就在他的寝室隔壁,这样,贝采里乌斯随时可以到实验室中进行研究。这位化学大师是真正认识到化学是一门实验科学这个简朴真理的化学家。
贝采里乌斯还是第一个提出“催化剂”概念的科学家。很久以来,人们早已不自觉地利用了催化作用,例如古代已经利用曲做催化剂来酿酒和制醋。在相当古老的铅室法制造硫酸的过程中,利用一氧化氮作催化剂。19世纪初,研究催化作用的化学家开始多起来了,例如1812年K.S.基尔霍夫发现酸能加快蔗糖的水解作用,硫酸能促进淀粉转变为葡萄糖,但是在反应过程中,酸并没有发生变化;1817年戴维发现了铂对醇被氧化的反应有促进作用;1819年泰纳发现碱和某些金属(铂、锰等)能加快过氧化氢的分解;1820年德贝莱纳发现铂能促使氢和氧化合。
贝采里乌斯在1835年总结了上述现象,指出在上述反应中,不论是简单的或是复杂的化合物,还是不同状态(气态、液态、固态)的化合物,都会对化学反应产生一定的影响。他把这种作用称为催化力,并指出具有催化力的外加物质都是催化剂,从而第一次提出了“催化剂”这个术语,对化学的发展起了一定的作用。
贝采里乌斯是第一位提出同分异构现象的化学家。1823年维勒分析了氰酸盐的组成,1824年李比希分析了雷酸盐的组成,他们都发现氰酸和雷酸的组成是相同的,但是他们都无法解释两种性质不同的化合物可以具有相同的化学组成。贝采里乌斯一开始认为他们两人的分析结果有错误,后来经过认真的思考,认识到组成相同的化合物未必具有相同的性质,氰酸和雷酸就是最好的例子,它们的性质虽然不同,属于两种化合物,但是它们的组成却是相同的。于是,贝采里乌斯把具有相同的化学组成,但性质不同的化合物叫做同分异构体,从而解决了维勒和李比希的疑问。
贝采里乌斯创立的电化学说也是颇为有名的。他认为盐是由酸(实际上是酸酐,当时的化学家把酸酐叫做酸)与碱(实际上是碱性氧化物)组成的化合物。由于他证明了溶液中的盐会被电流分解为酸(分解时向正极移动,说明它带负电荷)和碱(分解时向负极移动,说明它带正电荷),于是他把酸、碱组成盐与盐被电流分解为酸、碱的概念联系起来,提出酸是电负性的化合物;碱是电正性的化合物,电解反应正好是化合反应的逆过程。
当时,贝采里乌斯把氧看作电负性最大的元素,即在所有的氧化物中,氧都是电负性的。他还把钾看作电正性最大的元素。按照元素电正性递增的次序,他将当时已知的元素:O、S、N、F、Cl、Br、I、Se、P、As、Cr、Mo、W、B、C、Sb、Te、Ta、Ti、Si、H、Au、Os、Ir、Pt、Rh、Pd、Hg、Ag、Cu、U、Bi、Sn、Pb、Cd、Co、Ni、Fe、Zn、Mn、Ce、Th、Zr、Al、Y、Be、Mg、Ca、Sr、Ba、Li、Na、K作成一种表。这种排列方式被称为电化序,对于认识元素及其化合物的性质和化学反应的规律有一定的作用。
由于贝采里乌斯在科学上的贡献很大,使他在1808年当选为斯德哥尔摩科学院院士;1818年当选为科学院秘书。他还是英国皇家学会会员和彼得堡科学院名誉院士。
贝采里乌斯结婚很晚,在57岁时感到很孤独而结了婚。在举行结婚典礼之前,收到了瑞典国王查理·约翰的一封信,信的内容之一是:由于贝采里乌斯对瑞典有功,特赐给他男爵的爵位。
