我们在化学课中学到的定比定律是法国化学家Joseph Louis Proust(1754—1826年)根据1798—1804年间的实验总结出的。定比定律指出含有两种或两种以上元素的化合物,其组成元素的质量呈一定的比例关系,或者说每一种化合物的组成是一定的。不久之后,John Dalton(1766—1844年)提出了倍比定律。以上两个定律为原子论的提出及后来的化学式奠定了基础。定比定律、倍比定律和质量守恒定律构成了化学计量的基础。在化学计量基础上的化学式,其下角标都是简单的整数比,如FeO、ZrO2、Mg Al2O4等。
然而,化合物实际上并不符合化学计量,即组成化合物的元素数量会发生变化,晶格上的原子要么多于要么少于化学式中的理论值。这表现在化学式上,就是下角标不是简单且固定的整数比。我们在讨论固溶体时,引入的杂质会使主晶相晶格上的原子数量发生变化。比如例4.3,Mn进入γ-Fe晶格形成固溶体时,晶格上的Fe减少了。铁符合化学计量的化学式为Fe,此例中的化学式变为Fe0.873Mn0.127。例4.4中固溶体晶格上的O也减少了,化学式变为Zr0.85Ca0.15O1.85,这也不符合ZrO2的化学计量。所以,我们已经在前面接触到了不符合化学计量的物质。当实际化合物中有少量的成分偏离化学计量时(即如Zr1-xCaxO2-x和Fe1-xMnx中的x很小一样),主晶相结构并未改变。此时,我们把它们认为是固溶体或化合物都可以。在此情况下,固溶体与化合物的界限就模糊了。故在本段开始处,我们把固溶体当成了化合物来举例介绍非化学计量。
一般地,实际化合物的非化学计量缺陷很少。因此,我们仍把它们看作是符合化学计量的化合物。这也是我们在本节以前讨论点缺陷和固溶体的基础。在那里,我们认为基体材料(或主晶相)和掺杂物符合化学计量。然而,实际化合物总是偏离理论组成的,但这种非化学计量不是我们在这里讨论的范畴。我们在这里讨论的非化学计量化合物(nonstoichiometric compounds)是指在一定温度下,符合理论组成的物质与周围环境有物质交换而产生的化合物或固溶体。它是缺陷化学里的一个重要概念。这类非化学计量化合物常常是无机非金属化合物。
缺陷化学里的非化学计量化合物,其特点主要为:①它的产生及缺陷浓度与气氛、温度等有关;②这类非化学计量化合物都是半导体。产生导电的荷电粒子——载流子为电子e′或电子空穴h·。除了掺杂产生离子导电形成半导体以外,非化学计量化合物为半导体的制备开辟了又一个新途径。
非化学计量化合物的形成有两种主要方式:一是掺杂;二是在同种离子的高、低价之间产生不等价置换,如Fe2+与Fe3+。
1.掺杂非化学计量化合物
这是由外来离子,产生不等价置换形成的非化学计量化合物,也叫杂质非化学计量化合物(extrinsic nonstoichiometry)。
在固溶体和缺陷反应式一节,我们介绍了掺杂会产生带电点缺陷。这些点缺陷的电荷由离子性缺陷如:正负离子空位、正负间隙离子来补偿。但缺陷化学认为这类由离子型缺陷来补偿因掺入异价离子引起的不平衡电荷,而形成的固溶体(含主晶相和杂质)符合化学计量。这正是我们在固溶体、缺陷反应部分介绍的主要内容。
现在,我们来看前面提到的缺陷反应式式(4-44),它是高价置换低价:
![]()
这是符合化学计量的写法。若环境中氧分压较低或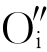 过多,
过多,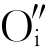 以O2形式从晶体中逸出,则会在晶体中留下两个电子,此时的缺陷反应式为
以O2形式从晶体中逸出,则会在晶体中留下两个电子,此时的缺陷反应式为
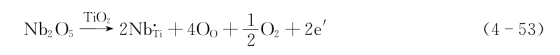
其中的电子e′与其周围的Ti4+作用形成Ti3+。但它并不属于哪个特定离子,而称为准自由电子。在电场作用下,该准自由电子会移动形成电流。由于电流因电子运动产生,故有这种缺陷的材料为n型半导体。
再比如Al2O3掺入TiO2,这是低价置换高价,缺陷反应式为
![]()
当周围环境中氧分压较高时,环境中的氧进入晶体中的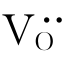 ,使原来氧空位上多了两个单位正电荷,即电子空穴h·。此时的缺陷反应式为
,使原来氧空位上多了两个单位正电荷,即电子空穴h·。此时的缺陷反应式为
![]()
同样,电子空穴h·并不属于哪个特定位置,在电场作用下会移动形成电流。有这种缺陷的材料为p型半导体。
从这两个例子,我们可知掺杂非化学计量化合物的产生与外来不等价离子的引入和环境中的气氛有关,并与外界有物质交换。再来看两个例子。在BaTiO3中添加少量稀土元素可形成半导体。比如添加La2O3在BaTiO3中,并在空气气氛中烧成,这是高价置换低价:
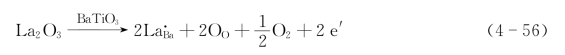
每引入一个La3+,晶体中就多余一个正电荷。为保持电中性,引入的一部分氧离子以O2形式进入环境中而留下两个准自由电子,故这种材料为n型半导体。
在NiO中加入少量Li2O,在空气中烧成。这是低价置换高价:
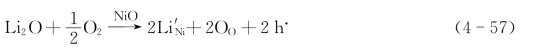
低价Li+占据高价Ni2+的空位,多出一个负电荷。周围环境中的氧进入而从晶格上的Ni2+上获得电子来补偿多出的负电荷,使Ni2+成为Ni3+。该Ni3+相当于正常晶格上的Ni2++h·。这种材料是p型半导体。
杂质非化学计量化合物的基体材料常含有变价元素,如Ti、Ni、Zn等。而且,这些变价元素往往是过渡金属。在掺杂形成半导体时,化合价往往要发生变化(如Ni2+变为Ni3+),故常把它们形成的半导体称作价控半导体。价控半导体可作传感器元件的材料。
2.本征非化学计量化合物
这种化合物的形成不需要掺杂。它的产生是因气氛、温度等原因引起的,故称为本征非化学计量化合物(intrinsic nonstoichiometry)。它相当于在不等价的同种离子间发生置换而产生。因此我们也不妨把它看作是一种固溶体,而且是一种“掺杂”不等价同种离子的特殊固溶体。这类化学计量化合物主要有以下四种类型。
(1)负离子空位型
这类化合物有TiO2、ZrO2、CeO2和Nb2O5等。它们的非化学计量化学式可写作TiO2-x、ZrO2-x、CeO2-x和Nb2O5-x。x的大小与环境中氧分压大小有关。
以TiO2为例。TiO2在缺氧的环境中,晶格上的氧会逸出而进入周围环境。此时,晶体中出现氧离子空位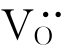 。由于电中性的要求,在
。由于电中性的要求,在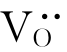 周围会束缚两个电子,如图4.8(a)所示。这种电子与其附近的Ti4+作用而使Ti4+成为Ti3+。该电子并不属于某个固定的Ti4+,而是束缚在
周围会束缚两个电子,如图4.8(a)所示。这种电子与其附近的Ti4+作用而使Ti4+成为Ti3+。该电子并不属于某个固定的Ti4+,而是束缚在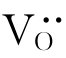 周围的准自由电子。在电场作用下,这种电子可从一个Ti4+迁移到另一个Ti4+而成为自由电子,并产生电子电导。故具有这种缺陷的材料是一种n型半导体。TiO2的这种缺陷可用以下缺陷反应式表示:
周围的准自由电子。在电场作用下,这种电子可从一个Ti4+迁移到另一个Ti4+而成为自由电子,并产生电子电导。故具有这种缺陷的材料是一种n型半导体。TiO2的这种缺陷可用以下缺陷反应式表示:
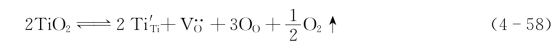
此式左边还可按前述缺陷符号的表达方式写作:
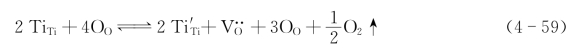
Ti4+与周围的准自由电子作用后形成Ti3+。此Ti3+占据原来的Ti4+空位而成为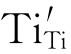 。
。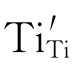 与Ti原子晶格束缚一个电子的效果一样:
与Ti原子晶格束缚一个电子的效果一样:
![]()
综合式(4-58)、式(4-59)和式(4-60)可得

式(4-61)的平衡常数K:
 (https://www.daowen.com)
(https://www.daowen.com)
由式(4-61)我们可知,准自由电子的浓度是氧空位浓度的两倍,即![]() 。将其代入式(4-62)后整理得:
。将其代入式(4-62)后整理得:![]() ,即电子浓度[e′](或氧空位的浓度
,即电子浓度[e′](或氧空位的浓度![]() 与氧分压的1/6次方成反比。可见,氧分压高,电子浓度[e′]低,电导率下降,故我们可通过控制氧分压pO2来控制材料的电导率。
与氧分压的1/6次方成反比。可见,氧分压高,电子浓度[e′]低,电导率下降,故我们可通过控制氧分压pO2来控制材料的电导率。
在氧分压pO2不变的情况下,由![]() 和式(4-62)还可得到[e′]∝K1/3。结合化学反应平衡常数与Gibbs自由能变化的关系ΔG=-RTlnK,有[e′]∝K1/3=exp[-ΔG/(3RT)],R为摩尔气体常数,等于8.314J/(mol·K)。故材料的电导率随温度的升高而呈指数增加。
和式(4-62)还可得到[e′]∝K1/3。结合化学反应平衡常数与Gibbs自由能变化的关系ΔG=-RTlnK,有[e′]∝K1/3=exp[-ΔG/(3RT)],R为摩尔气体常数,等于8.314J/(mol·K)。故材料的电导率随温度的升高而呈指数增加。
TiO2-x除了在电导率上有变化外,其颜色也有变化。这主要是由束缚在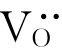 周围的两个准自由电子吸收一定波长的可见光所致。这种由负离子空位与其束缚的电子所组成的缺陷称为F色心,它是一种最常见的色心,也是研究最详细的色心。通常,色心是指俘获电子空穴的阳离子空位或俘获电子的阴离子空位。色心也是一些宝石颜色产生的原因,如白色的黄宝石可以通过辐照和热处理而变成蓝色、褐色或绿色就是因色心所致。目前,对晶体色心的研究也是凝聚态物理和材料科学的一个重要研究领域。
周围的两个准自由电子吸收一定波长的可见光所致。这种由负离子空位与其束缚的电子所组成的缺陷称为F色心,它是一种最常见的色心,也是研究最详细的色心。通常,色心是指俘获电子空穴的阳离子空位或俘获电子的阴离子空位。色心也是一些宝石颜色产生的原因,如白色的黄宝石可以通过辐照和热处理而变成蓝色、褐色或绿色就是因色心所致。目前,对晶体色心的研究也是凝聚态物理和材料科学的一个重要研究领域。
(2)正离子空位型
这类化合物在氧分压较高时的氧化气氛中,环境中的氧进入晶格的正常格点位,即增加了一个氧位置。为保持晶体中正、负离子位置数的比例不变,正离子位置的数量需要增加。为此,部分正离子格点上出现空位。
带负电的正离子空位在其周围捕获带正电的电子空穴h·以保持晶体的电中性。这种电子空穴h·也未固定在特定的正离子周围。在电场作用下,它会迁移而导电。因此,具有这种缺陷的材料为p型半导体。这类化合物主要有Fe1-xO、Cu2-xO、Mn1-xO和Ni1-xO等。以FeO为例,一个氧进入晶格,就少一个Fe2+,出现一个氧空位。其缺陷反应式如下:
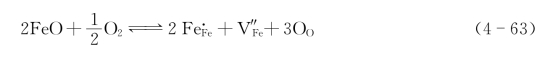
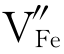 束缚的电子空穴h·与周围的Fe2+作用产生Fe3+,如图4.8(b)所示。因此
束缚的电子空穴h·与周围的Fe2+作用产生Fe3+,如图4.8(b)所示。因此 相当于在FeO中掺入Fe3+形成的缺陷,Fe1-xO可看作是在FeO中掺入Fe2O3形成的固溶体。请读者自己写一下它们的缺陷反应式,看看生成的缺陷是否与式(4-63)相同。
相当于在FeO中掺入Fe3+形成的缺陷,Fe1-xO可看作是在FeO中掺入Fe2O3形成的固溶体。请读者自己写一下它们的缺陷反应式,看看生成的缺陷是否与式(4-63)相同。
与前面TiO2可写作TiTi+2OO一样,FeO也可写作FeFe+OO,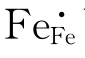 可写为FeFe+h·,则式(4-63)变为
可写为FeFe+h·,则式(4-63)变为
![]()
式(4-64)的平衡常数K为

由于![]() ,将其代入式(4-65)并整理,得
,将其代入式(4-65)并整理,得![]() 。氧分压升高,铁离子的空位浓度
。氧分压升高,铁离子的空位浓度![]() 和电子空穴浓度[h·]也增加,这导致电导率升高。这种正离子空位与电子空穴缔合成的缺陷称为V色心。
和电子空穴浓度[h·]也增加,这导致电导率升高。这种正离子空位与电子空穴缔合成的缺陷称为V色心。
(3)正离子间隙型
氧化物在缺氧或氧分压低的环境中,晶格处的氧向环境中挥发而导致晶格处的氧减少,并增加了氧的位置数,这导致晶格处的正离子过剩。为保持晶格处正、负离子位置数的比例不变,正离子也离开正常格点来增加正离子位置数。而间隙位不算位置数,故正离子进入间隙位。间隙正离子会束缚一定数目的准自由电子以保持电中性。这类电子在电场作用下同样也可运动产生电流,所以这类材料是n型半导体。Zn1+xO、Cd1+xO是这种类型的代表。以ZnO为例,它在Zn蒸气中加热,氧挥发而Zn进入间隙位,如图4.8(c)所示。缺陷反应式为

或
![]()
由于Zn原子第二个电子的电离能较高,需更高温度,所以式(4-66)为主要存在形式。式(4-67)的平衡常数为

方法同前,整理后有![]() 。缺陷浓度随氧分压升高而降低。
。缺陷浓度随氧分压升高而降低。
在Zn蒸气中,设Zn进入间隙位并失去一个电子而离解成Zn+。失去的电子属于准自由电子,在电场作用下可运动产生电流。其缺陷反应也可写作:
![]()
平衡常数

即![]() 。此式表示了缺陷浓度与Zn蒸气压的关系。
。此式表示了缺陷浓度与Zn蒸气压的关系。
(4)负离子间隙型
负离子由于体积通常较大,不易进入间隙位,所以这种类型很少见。目前,只发现萤石型结构的UO2可形成UO2+x非化学计量化合物。
UO2在氧分压较高的气氛中,一部分氧进入晶体间隙位并从正离子处获得电子,而形成过剩负离子。U4+电价升高成U6+。这相当于在U4+晶格上束缚了2个电子空穴,如图4.8(d)所示。此电子空穴也不局限于某个特定U4+。在电场作用下同样也可运动产生电流,故这种材料为p型半导体,缺陷反应式为
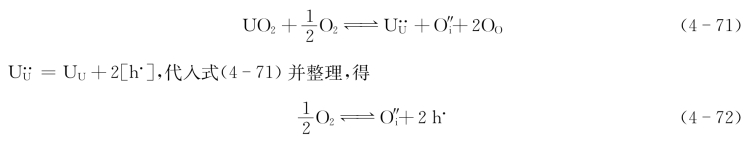
平衡常数为

由式(4-72)可知[h·]=![]() 。同样可得[h·]=
。同样可得[h·]=![]() 。缺陷浓度随氧分压升高而升高。
。缺陷浓度随氧分压升高而升高。
当然,UO2+x也可看成是UO3掺入UO2形成的固溶体。此时的缺陷反应可写作![]()
![]() 。与式(4-71)相比,产生的缺陷是一样的。但实际上,我们并未掺入UO3。
。与式(4-71)相比,产生的缺陷是一样的。但实际上,我们并未掺入UO3。
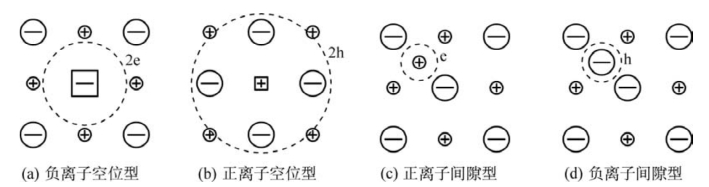
图4.8 非化学计量缺陷结构示意图(图中大、小方框分别代表负、正离子空位。虚线表示这些缺陷周围束缚了电子缺陷)
以上四种本征非化学计量化合物,其缺陷的产生仅仅是由于气氛和温度引起的。气氛和温度的改变会使缺陷的量增加或减少,即它们是可逆的,故在它们的缺陷反应式中,人们采用可逆符号“![]() ”。而掺杂非化学计量化合物的形成和以离子性缺陷来补偿不平衡电荷形成的固溶体缺陷反应是不可逆的,故人们用单箭头“—→”表示。
”。而掺杂非化学计量化合物的形成和以离子性缺陷来补偿不平衡电荷形成的固溶体缺陷反应是不可逆的,故人们用单箭头“—→”表示。
需注意:缺陷的生成可写出符合化学计量的缺陷反应,也可写出非化学计量的反应。比如Nb2O5掺杂TiO2,式(4-43)、式(4-44)为化学计量反应;式(4-53)为非化学计量反应。究竟哪种符合实际呢?只有通过实验来确定。其中,固溶体是经式(4-43)还是式(4-44)获得的,则常由前文的密度对比法确定。而固溶体是式(4-43)、式(4-44)的离子导电型还是式(4-53)的电子导电型,则由霍尔效应或电解效应来确定。
点缺陷,尤其是非化学计量缺陷最初是在离子晶体材料中得到发展和应用。随着人们对点缺陷认识的深入,这些缺陷在金属材料领域也获得了应用,特别是非化学计量缺陷在金属的氧化腐蚀上。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





