铅酸蓄电池把能量以化学能形式存储,需要时化学能以电能释放出来。把电能以化学能形式存储的过程叫充电,需要时化学能以电能释放出来的过程叫放电。如此重复充电和放电,因此也称二次蓄电池。
铅酸蓄电池的整个充电和放电过程都是在电化反应中实现的,我们把铅酸蓄电池作为一个电化反应体系,其电化反应体系是

蓄电池在充、放电过程中进行如下的反应:
1.放电
蓄电池对外做功时开始放电,其内部反应如式(2-1)所示。
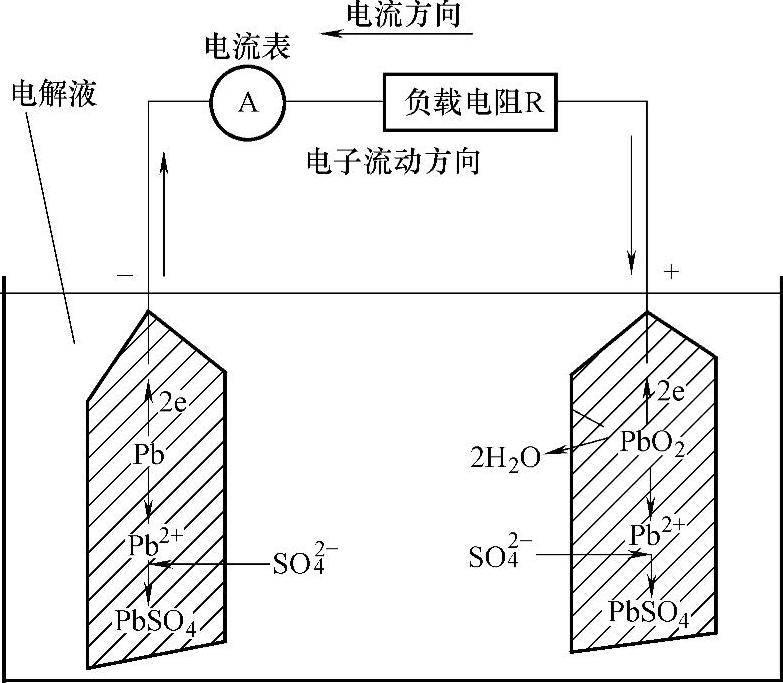
外部电流从正极流出,经负载(R)流向负极,内部流向则是从负极流向正极。在蓄电池内部SO2-4离子迁移到正极,负极上的Pb2+原子放出两个电子,Pb2+与S02-4中和生成PbSO4,其反应式为
Pb+H2SO4-2e-→PbSO4+2H+ (2-1)
由于负极上失去的两个电子经外电路流向正极,正极上的二氧化铅从外电路得到两个电子后,Pb4+离子变成Pb2+离子,它和SO2-4反应生成PbSO4,反应式为
PbO2+H2SO4+2H++2e-→PbSO4+2H2O (2-2)
铅酸蓄电池放电如图2-21所示。
 (https://www.daowen.com)
(https://www.daowen.com)
图2-21 铅酸蓄电池放电示意图
2.充电
充电是蓄电池的再生功能。充电时,整个电源将负极电子流输送到蓄电池的正极,负极PbSO4不断地离解为Pb2+和SO2-4,Pb2+离子取得外电路输送来的两个电子,立即还原成多孔金属Pb。SO2-4离子立即和H+离子还原为硫酸。反应式为
PbSO4+2H++2e-→Pb+H2SO4 (2-3)
在正极上PbSO4不断地离解为Pb2+和SO2-4,Pb2+离子失去两个电子,被氧化成Pb4+离子与水中的O2生成PbO2,反应式为
PbSO4+2H2O-2e-→PbO2+H2SO4+2H+ (2-4)
由于铅酸蓄电池电解液的主要成分是硫酸和水,在充电时,会使水的成分减少,而使硫酸的成分增加,即电解液密度上升,随着充电时间的延长(4~8h),逐渐恢复到原来的浓度。同时,在充电过程中,两极的活性物质逐渐还原,当两极的活性物质还原到原来的状况时,即表示充电已结束。
铅酸蓄电池充电示意图如图2-22所示。
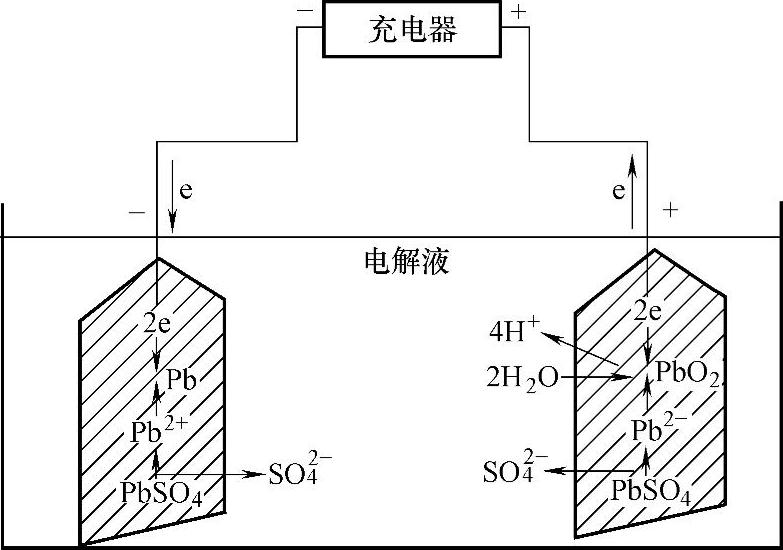
图2-22 铅酸蓄电池充电示意图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







