除了静电力、诱导力和色散力等物理作用之外,有些分子之间还存在弱化学作用,这种作用具有方向性和饱和性,主要分为两大类:氢键和电荷转移,分别简述如下。
1.氢键
对于许多含氢化合物,特别是具有官能团如—OH,—NH,—XH(X为卤原子)和—SH以及与强吸电子基团结合的碳氢键(如CHCl3)时,氢还可以与另一个分子的O,N,F和S以及具有π电子的芳烃结合,形成所谓的氢键,可用通式A—H⋯B表示。其中A,B均为电负性较大但体积又不太大的原子,A—H称为质子供体,B称为质子受体。例如,甲酸在3℃的蒸气中有93%是以二聚体的形式存在的,电子衍射法测得其结构为
已知O—H键的正常键长为0.95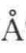 [1],而因氢键形成的二分子缔合时,O—H键伸长为1.04
[1],而因氢键形成的二分子缔合时,O—H键伸长为1.04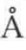 ,H与另一分子中的O又形成键长为1.63
,H与另一分子中的O又形成键长为1.63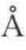 的较弱的氢键。实验测得二聚体的离解热为14.1kcal[2]/mol,故氢键键能为7.05kcal/mol。表1-7列出了常见的氢键键长和键能。
的较弱的氢键。实验测得二聚体的离解热为14.1kcal[2]/mol,故氢键键能为7.05kcal/mol。表1-7列出了常见的氢键键长和键能。
表1-7 常见氢键的键长与键能
氢键的本质无外乎两个方面,一是由于A—H键的偶极矩较大,H的半径又很小(0.3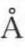 )且无内层电子,便于B原子充分接近它。只要B原子电负性足够大,半径又小,带正电的H就能充分与B原子中的孤对电子产生很强的静电作用。而且以H为媒介,B与A之间还可以发生电荷转移,获得离域能。
)且无内层电子,便于B原子充分接近它。只要B原子电负性足够大,半径又小,带正电的H就能充分与B原子中的孤对电子产生很强的静电作用。而且以H为媒介,B与A之间还可以发生电荷转移,获得离域能。
2.电荷转移(https://www.daowen.com)
如前所述,部分氢键的形成过程中存在电荷转移,而电荷转移也可以促使配合物的形成,这其中并不涉及氢键。电荷转移的更一般的模式是电子供体D将电荷转移至电子受体A,形成D→A键,主要有以下几种类型。
(1)具有非键孤对电子的供体与具有空轨道的受体作用,如R3N·BCl3;
(2)具有成键π轨道的供体与具有反键σ轨道的受体作用,如C6H6·I2;
(3)具有成键π轨道的供体与具有反键π轨道的受体作用,如C6H6·(NC)2=C(CN)2。
[1] 1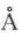 =10﹣10m。
=10﹣10m。
[2] 1cal=4.186 8J,1kca1=4 186.8J。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





