溶菌酶(Lyso)是一个含有129个氨基酸残基的蛋白酶,分子量为14.6KDa它包括3个酪氨酸残基和6个色氨酸残基,其中4个色氨酸残基暴露在溶剂中。Lyso是研究蛋白质氧化损伤的一个非常好的模型,它在可见光范围内几乎没有吸收,结构与组成已经确定,且蛋白质结构稳定[184]。已有许多研究使用Lyso作为模型研究蛋白质的光损伤和氧化损伤[130-134,185,186]。其中一些研究表明,ROS与Lyso的反应是通过与Lyso的Tyr和Trp残基作用进行的[130,131]。
关于RF诱导的Lyso光损伤,已报道的文献表明,在可见光和RF的作用下,Lyso能够经过裂解和聚合过程,形成二聚和多聚产物,Lyso光损伤的程度受光照强度和时间、RF用量,体系O2含量等因素的影响[187,188]。总之RF诱导的Lyso光损伤是一个研究比较成熟的模型。本文正是使用该模型从宏观层面考察H(2)S对RF诱导的Lyso光损伤的保护作用。从图7-9中可以看出,Lyso和H(2)S在大于330nm的波段没有吸收,因此在Lyso,RF和H(2)S构成的三元反应体系中,330~500nm范围内的光源能量主要被RF吸收。我们首先考察了在没有H(2)S保护的情况下,RF诱导的Lyso光损伤的情况。如图7-10A所示的四条电泳条带可以看出,在光和RF存在条件下(泳道4),可以清楚看到Lyso损伤后所生成的二聚体条带(26.0KDa)和更高分子量的聚合条带,没有光照下,RF与Lyso组(泳道3)也会出现微弱的聚合现象,这可能是自然光造成的干扰,而没有RF的情况下(泳道2),所使用光源对Lyso几乎不造成损伤。由此可见,Lyso的光损伤是由RF介导产生的。
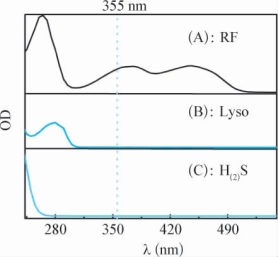
图7-9 在pH=7.2的水溶液中,RF(A),Lyso(B)和H(2)S(C)的紫外可见吸收谱图
接着,我们固定光照条件,Lyso(0.25mM)和RF(0.1mM)的用量,在pH=7.2的条件下,通过加入不同浓度的Na2S来比较H(2)S对RF诱导的Lyso光损伤的影响。如图7-10B所示,无论是Lyso的二聚体条带还是更高聚合度的多聚体条带,其灰度均是随着H(2)S的增加而减弱。二聚体条带(26.0KDa)的灰度值变化也能清楚地表明RF诱导的Lyso聚合程度随着H(2)S浓度的增加逐渐减弱(图7-10C)。(https://www.daowen.com)
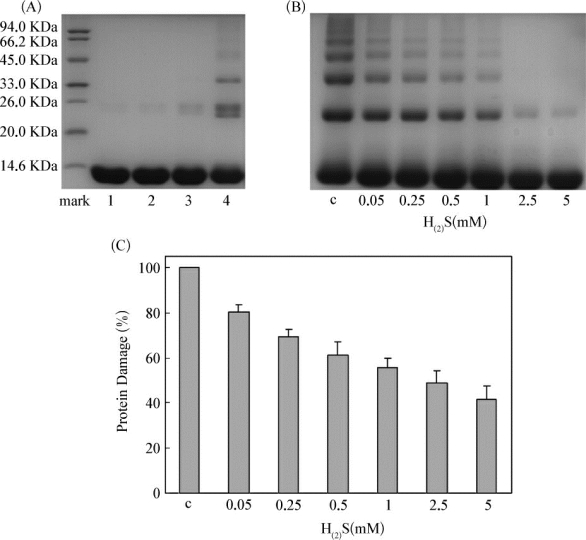
图7-10 (A)不同条件处理的Lyso经SDS-PAGE实验后所得到的凝胶成像图:泳道1:Lyso对照组;泳道2:Lyso+辐照;泳道3:Lyso+RF(0.1mM);泳道4:Lyso+RF(0.1mM)+辐照。(B)在Lyso(0.25mM)和RF(0.1mM)的pH=7.2的体系中,分别加入不同浓度Na2S(0mM,0.05mM,0.25mM,0.5mM,1mM,2.5mM和5mM),经辐照所得到的样品进行SDS-PAGE实验后所得的凝胶成像图。(C)图7-10B中二聚体条带(26.0KDa)的灰度值与对应Na2S浓度的关系:以对照组灰度为100%,其他组的值为相应条带灰度值与对照组的百分比(n=3)
瞬态动力学的结果表明,RF吸收UVA和可见光主要发生光激发反应,生成3 RF*。3 RF*是氧化能力很强的瞬态物质,它一方面能够通过电子转移的途径直接氧化Trp和Tyr生成TyrO·和TrpN·[189]。另一方面,在有氧条件下,3 RF*能够与O2发生能量转移反应生成1 O2,1 O2也是氧化能力很强的物质,能够造成蛋白质的氧化损伤[180]。3 RF*和1 O2对Trp和蛋白质的Trp残基的反应活性比Tyr和蛋白质的Tyr残基更强[132]。一般当一个同时含有Trp和Tyr残基的蛋白质遭受氧化损伤时,Trp残基首先被氧化为TrpN·,然后经过一个分子内的长距离电子转移过程,同一蛋白质分子上的Tyr残基与TrpN·残基发生电子转移,生成TyrO·残基[176]。TyrO·之间能够发生聚合反应,从而造成蛋白质之间的聚合现象[186]。所以,3 RF*和1 O2是造成Lyso损伤聚合的源头。
3 RF*与Lyso和O2之间的反应速率常数分别为9.1×108 M-1s-1和4×108 M-1s-1[180,185]。而本文所计算的3 RF*与H(2)S的反应速率常数在中性条件下为1.5×109 M-1s-1。当有H(2)S存在时,H(2)S与Lyso和O2竞争性地与3 RF*反应,从反应速率常数的比较可以看出,在这一竞争反应过程中,H(2)S存在着一定的优势。因此,H(2)S可以通过猝灭3 RF*来减少3 RF*对Lyso的直接氧化损伤和1 O2的产量,这应该是其保护RF诱导的Lyso光损伤的一条作用途径。此外,上面的实验也表明,H(2)S具有清除TyrO·和TrpN·的能力,因此可以推测,H(2)S对已经生成的TyrO·和TrpN·应该具有修复能力。另外,蛋白质分子内的Tyr残基与TrpN·残基间电子转移反应的速率常数小于105 M-1s-1[176],远小于TrpN·与H(2)S之间的反应速率常数,因此H(2)S也能够抑制这种蛋白质分子内的电子转移过程,减少引起蛋白质聚合的TyrO·的生成。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





