10-1/2 汤普金斯先生在梦中错过的部分讲座
10-1/2 汤普金斯先生在梦中错过的部分讲座
事实上,1808年,英国化学家约翰·道尔顿提出,各种化学元素在形成化合物时的相对比例总能表达为整数之比,按照他的解释,这是因为所有化合物都由不同数量的化学元素基本单元组成。中世纪的炼金术一直没能成功地将一种化学元素转化为另一种,这为基本粒子不可分割的特性提供了证据,没过多久,它们就被赐予了古希腊人发明的头衔:“原子”。这个名字一旦确定就根深蒂固地保留了下来,尽管现在我们已经知道,“道尔顿的原子”并非不可分割之物,事实上,原子由许多更小的粒子组成,但我们还是容忍了它这个不符合哲学概念的错误名字。所以,现代物理学中的“原子”并不是德谟克利特想象的不可分割的物质基本单元,这个名字其实更适合电子和质子之类更小的粒子,“道尔顿的原子”正是由这些粒子组成的。但贸然改名必然引发混乱,反正物理学界也没人在乎原子的名字是不是符合哲学概念!因此,我们保留了道尔顿的“原子”之名,电子和质子之类的粒子则被称为“基本粒子”。
当然,单凭名字你就知道,目前我们相信,这些更小的粒子就是德谟克利特设想的真正不可分割的基本单元;也许你会问,历史会不会重复?随着科学的发展,未来我们可能发现,现代物理学所认为的这些基本粒子其实拥有复杂的内部结构。我的回答是这样的:尽管谁也无法保证这样的事情一定不会发生,但我们有充分的理由相信,这次我们真的没弄错。事实上,原子有92种(对应92种化学元素),每种原子各自拥有相当复杂的独特性质;所以我们很自然地认为,这种情况应该可以进行某种程度的简化。但从另一方面来说,现代物理学确认的基本粒子只有几种:电子(带正电荷和负电荷的轻粒子)、核子(带电或电中性的重粒子,又叫质子和中子),可能还有所谓的中微子,但它的特性我们还没完全弄清。
这些基本粒子的特性非常简单,我们很难再做进一步的简化;此外,你应该能理解,要想构建某种复杂的东西,你总是需要先确定几个基本概念,两三个基本概念并不算多。因此,我个人认为,现代物理学中的基本粒子就是真正的不可分割之物,你大可为这个信念放心地赌上最后一块钱。
现在我们可以讨论下一个问题:这些基本粒子如何构成道尔顿的原子。1911年,杰出的英国物理学家欧内斯特·卢瑟福(Ernest Rutherford,后被封为尼尔森的卢瑟福男爵)首次提出了答案。他利用放射性元素分裂产生的高速粒子——即α粒子——轰击各种原子,借助这种方法来研究原子结构。通过观察入射粒子在穿过一小片物质后的散射情况,卢瑟福得出结论,所有原子必然拥有一个非常致密的带正电的核心(原子核),这个核心周围环绕着相当稀薄的带负电的云团(原子大气)。今天我们知道,原子核由一定数量的质子和中子组成,这两种粒子被统称为“核子”,强核力将质子和中子紧紧凝聚在一起;而原子大气由数量不等的负电子组成,在带正电的原子核的静电引力作用下,这些电子成群结队地绕核运动。组成原子大气的电子数量决定了特定原子所有的物理性质和化学性质,不同的化学元素拥有的电子数量各不相同,从1个(氢原子)到92个(最重的已知元素:铀)不等。
尽管卢瑟福的原子模型看起来相当简洁,但细究之下,这套理论并不简单。事实上,根据经典物理学最不可动摇的定律,绕核旋转的负电子必然通过辐射(释放光)渐渐失去动能,计算结果表明,这个稳定的能量损失过程会让组成原子大气的所有电子在极短的时间内坠向原子核。这个由经典理论推出的结论看似不可动摇,但却和我们观察到的现象完全相悖:事实上,原子大气相当稳定,电子非但不会坠向原子核,恰恰相反,它们一直绕着原子核旋转,这样的局面似乎可以永远维持下去。因此我们看到,经典力学的基本理念与原子世界中这些微粒的实际行为之间存在根本的冲突。这个事实让丹麦著名物理学家尼尔斯·玻尔意识到,尽管几个世纪以来,经典力学在自然科学系统中的地位一直相当稳固,而且它的确能够很好地描述我们生活于其中的这个宏观世界,但这套理论却完全不适用于原子内部更精妙的运动。为了构建一套能够描述原子级微观部件运动特性的更通用的力学理论,玻尔提出,尽管经典理论认为电子的运动轨道无穷无尽,但我们不妨假设,自然界中真正有可能出现的其实只有特定的几种。这些运动轨迹——或者说轨道——根据特定的数学条件计算得出,玻尔理论将这些条件命名为“量子条件”。我不打算在这里深入讨论量子条件,你们只需要知道,如果运动粒子的质量远大于亚原子微粒,那么这些条件提供的所有约束都会变得无足轻重。因此,这套新的微观力学应用于宏观物体时得到的结果和原来的经典理论(对应原则)完全相同,只有在讨论原子级微粒的运动时,两套理论之间的区别才具有显著意义。虽然我们不会深入讨论,但你可能想知道玻尔理论框架下的原子结构到底长什么样,所以我可以让你看看玻尔绘制的原子内部的量子轨道示意图。(请放第一张幻灯片!)当然,你看到的是高倍放大后的图像,这套系统里的圆形和椭圆形轨道代表的只是玻尔量子条件所“允许”的组成原子大气的电子运动轨道。尽管经典力学允许电子以任意半径绕核运动,也不会限制电子运动轨道的离心率(例如它的扁度),但玻尔理论挑选出的轨道形成了一个所有特征维度都拥有明确定义的离散集合。每条轨道附近的数字和字母代表着它在通用分类法里的名字;比如说,你可能注意到了,直径越大的轨道编号数字也越大。
虽然玻尔的原子结构理论成功解释了原子和分子的各种性质,但离散量子轨道的基本概念仍然有些含糊,对于经典理论的这一特殊限制,我们分析得越深入,反而越难把握全局。(https://www.daowen.com)
后来科学家终于发现,玻尔理论的缺陷在于,它并未从根本上改变经典力学理论,而只是添加了一些新颖的条件,从而将电子系统的运动轨迹限制在了一定的范围内。直到13年后,所谓的“波动力学”才为这个问题给出了正确的答案,这套理论以新的量子原理为基础,对整个经典力学的根基做出了彻底的修正。乍看之下,波动力学似乎比玻尔的理论还要疯狂,但实际上,这套新的微观力学代表着当代理论物理学界最具一致性、最广为接受的理念。
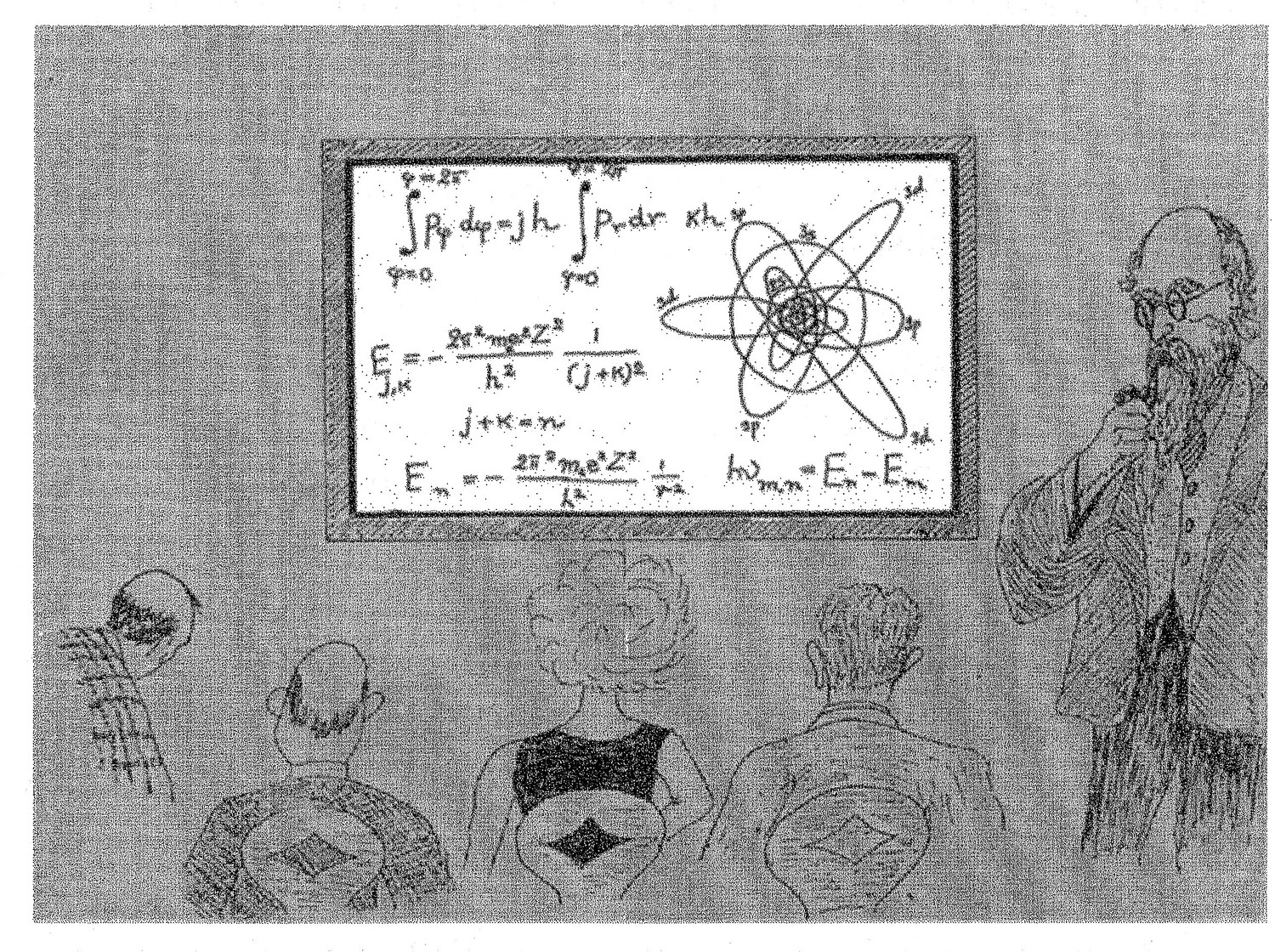
我在之前的讲座中介绍过新力学理论的基本原理,尤其是“不确定性”和“弥散轨道”的概念,有兴趣的话,你不妨重温一下这段记忆(或者笔记),现在,我们还是继续讨论原子结构的问题。你可以在这幅图(请放第二张幻灯片!)中直观地看到波动力学理论框架下核外电子运动的“弥散轨道”。这幅图所代表的运动其实和上一幅示意图中经典力学框架下的运动完全一样(只是出于技术原因,现在我们将这两种运动分别画了出来),但玻尔理论中的清晰轨道已经不复存在,现在我们只能看到弥散的轨道图样,这是由不确定性原理决定的。在这幅新的示意图里,不同运动状态的标记方法和上一幅图一样,比较一下前后两张图片,只要稍微发挥一点想象力,你就会发现,第二幅图中模糊的“云团”轮廓其实和玻尔的轨道十分相似。

从这些图表能清晰地看出,当量子参与其中时,经典理论中的轨道会发生怎样的变化。外行人肯定会觉得这是奇妙的梦境,但是研究原子尺度微观宇宙的科学家们,可以毫不费力地接受这个图景。
刚才我们对原子内部电子可能的运动状态做了一番简单的调查,现在,我们需要思考一个重要的问题:这些运动状态各不相同的电子在原子内部如何分布?这里我们又遇上了一条宏观世界十分陌生的新原理。这条原理是由我年轻的朋友沃尔夫冈·泡利(Wolfgang Pauli)首次提出的,泡利认为,在特定的原子内部,两个电子绝不会同时占据同样的运动态。这个条件在经典力学框架下根本无足轻重,但由于量子定律极大地限制了电子可能的运动态,所以在原子世界里,泡利不相容原理变得非常重要:它确保了电子大致均匀地分布在原子核周围的空间中,而不是挤成一团。
虽然我刚才简单介绍了泡利的新原理,但你可能会说,根据前面那幅示意图,你根本看不出每种弥散的运动量子态只能被一个电子“占据”。事实上,除了绕原子核“公转”以外,电子还会绕轴自旋,所以就算一条轨道上出现了两个电子,但只要这对电子自旋的方向相反,泡利博士就完全不必烦恼。通过研究我们发现,所有电子绕轴自旋的速度始终相同,而且自旋轴的方向必然垂直于轨道平面。这样一来,电子自旋的可能状态就只剩下两种,我们分别称之为“顺时针”和“逆时针”。
因此,描述原子内部量子态的时候,泡利不相容原理可以重新表述为:每个量子运动态只能被两个或两个以下的电子“占据”,而且这两个电子的自旋方向必然相反。这样一来,如果按照元素周期表的自然序列一路向前,随着单个原子拥有的电子数量不断增加,你会发现原子内部不同的运动量子态逐渐被电子一个个填满,原子的直径也随之稳定增长。在这里我必须提到的是,根据它们的结合强度,不同量子态的电子大致可以分为几组(或者说几层),每组电子都紧紧结合在一起。随着原子序数不断增加,每个电子层相继被填满,原子的性质也会随之产生周期性变化,这很好地解释了俄罗斯化学家德米特里·门捷列夫(Dimitrij Mendelleeff)在实践中发现的著名的元素周期律。
