1.实验目的
(1)熟悉复合反应速率常数的计算方法。
(2)了解复合反应的反应机理和特征。
(3)掌握分光光度计的正确使用方法。
2.实验原理
在酸性溶液中,丙酮碘化反应是一个复合反应,其反应式为
式中,H+是催化剂,由于反应本身能生成,所以这是一个自催化反应。一
般认为该反应的反应机理包括下列两个基元反应
这是一个连续反应。反应(3-37)是丙酮的烯醇化反应,是一个进行得很慢的反应。反应(3-38)是烯醇的碘化反应,是一个快速且趋于进行到底的反应。由于反应(3-37)进行得很慢,而反应(3-38)进行得很快,所以中间产物烯醇一旦生成就马上消耗掉了,根据连续反应的特点,该反应的总反应速率由丙酮的烯醇化反应速率决定,在基元反应(3-37)中,丙酮烯醇化反应的速率![]() 分别与丙酮及H+的浓度的一次方有关。另外,实验测定表明,在高酸度条件下,反应速率与碘的浓度无关,即碘的反应级数为零,实验还表明H+与丙酮的反应级数分别为1。故此反应的速率方程可表示为
分别与丙酮及H+的浓度的一次方有关。另外,实验测定表明,在高酸度条件下,反应速率与碘的浓度无关,即碘的反应级数为零,实验还表明H+与丙酮的反应级数分别为1。故此反应的速率方程可表示为
由式(3-36)可知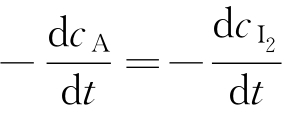 ,所以式(3-39)可写成
,所以式(3-39)可写成
本实验选定反应物的范围是丙酮的浓度为0.1~0.6mol·L-1,H+的浓度为0.05~0.5mol·L-1,碘的浓度为0.001~0.005mol·L-1。由此可知,丙酮的浓度远远大于碘的浓度,且H+作为催化剂的浓度也足够大,故在反应过程中,可视丙酮与H+的浓度不随时间而改变。故将式(3-40)移项进行不定积分
可得
其中,k′=kcAcH+,I为积分常数。
由式(3-41)可知,如果测得反应过程中不同t时刻碘的瞬时浓度,然后用cI2对t作图得一直线,则通过直线斜率就可求出k′。由于碘在可见光区有一个比较宽的吸收带,本实验可采用分光光度法进行。
根据比尔定律
式中,A为吸光度;T为透光率;I、I0分别为某一波长光线通过待测溶液和空白溶液后的光强度;ε为摩尔吸光系数;b为样品池光径长度。
将式(3-42)代入式(3-41)可得
式(3-43)中,A为常数。只要测出不同时刻反应体系的吸光度,根据式(3-43)用A对t作图得一直线,则通过直线斜率可求出表观速率常数k″,另外,根据式(3-42)求得εb,并利用式(3-44)可进一步求出丙酮碘化反应的速率常数k。(https://www.daowen.com)
3.仪器与试剂
分光光度计1套;秒表1块;25mL容量瓶5mL移液管3支;100mL磨口锥形瓶1只。
0.0136mol·mL-1纯丙酮溶液;其中1.0000mol·L-1HCl溶液和0.0100mol·L-1I2溶液均须准确标定。
4.实验步骤
(1)测定εb值
用移液管量取已知浓度的I2溶液3mL,注入25mL容量瓶中,稀释至刻度,用分光光度计测定溶液的透光率。
(2)配置反应体系,测定不同t时刻的透光率
在25mL容量瓶中加入2mL纯丙酮溶液、5mLI2溶液,加入约10mL蒸馏水后,再加入HCl溶液1mL,加蒸馏水稀释至刻度,混合均匀后注入比色皿中,放入分光光度计的暗箱内,然后打开秒表计时,每隔2min测定一次透光率,连续记录30个点,方可停止记录。保持丙酮及碘溶液浓度不变,改变酸的浓度,同上述测定方法进行测定。
5.数据处理
(1)根据丙酮密度,计算反应体系的丙酮浓度。
(2)根据式(3-42)求εb值。
(3)用A对时间t作图,求此直线的斜率。
(4)将k″代入式(3-44)中求出反应速率常数k。
6.思考题
(1)本实验中将反应物混合、摇匀、倒入比色皿测透光率时再开始计时,这对实验结果有无影响?为什么?
(2)能否将5mLI2溶液、2mL纯丙酮溶液、1mLHCl溶液一起加入25mL容量瓶中,再用蒸馏水稀释至刻度?为什么?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





