1.实验目的
测定H2O2分解反应的速率系数和级数,并了解一级反应的特点。
2.实验原理
H2O2在没有催化剂存在时,分解反应进行得很慢,若用KI溶液为催化剂,则能加速其分解。
该反应的机理是:
第一步 H2O2+KI→KIO+H2O(慢)
第二步 ![]()
由于第一步的反应速率比第二步慢得多,所以整个分解反应的速率取决于第一步。如果反应速率用单位时间内H2O2浓度的减少表示,则它与KI~H2O2的浓度成正比:
式中,c表示各物质的物质的量浓度(mol·L-1);t为反应时间(s);![]() 为反应速率系数,它的大小仅决定于温度。
为反应速率系数,它的大小仅决定于温度。
在反应过程中作为催化剂的KI的浓度保持不变,令![]() ,则
,则
式中,kl为表观反应速率系数。此式表明,反应速率与H2O2浓度的一次方成正比,故称为一级反应。积分上式得
在一定温度与催化剂浓度下,k1为定值,所以对一级反应而言![]() 的值仅与t有关,而与反应物初始浓度无关。
的值仅与t有关,而与反应物初始浓度无关。
在H2O2催化分解过程中,t时刻H2O2的浓度ct可通过测量在相应的时间内反应放出的O2的体积求得。因为分解反应中,放出O2的体积与已分解了的H2O2浓度成正比,其比例常数为定值。令V∞表示H2O2全部分解所放出的O2体积,Vt表示H2O2在t时刻放出的O2的体积,则
c0∝V∞,c1∝ (V∞-Vt)
将上面的关系式代入式(3-45),得到
若H2O2催化分解是一级反应,则以ln(V∞-V)对t作图应得一直线。这种利用动力学方程的积分式来确定反应级数的方法称为积分法,从直线的斜率可求出表观反应速率系数k1。
如求反应的表观活化能Ea,则通过测定不同温度下反应速率系数,根据阿伦尼乌斯(Arrhennius)经验方程:
以ln k对![]() 作图得一直线,从其斜率
作图得一直线,从其斜率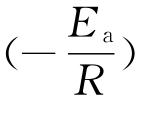 即可求得表观活化能Ea。
即可求得表观活化能Ea。
3.仪器与试剂
超级恒温槽;移液管(5mL);实验装置见图3-35。(https://www.daowen.com)
H2O2溶液(3%);KI溶液(0.2mol·L-1)。
4.实验步骤
(1)调节超级恒温槽的水温为25.0℃±0.1℃或30.0℃±0.1℃。
(2)按图3-35装好仪器。用双连球7通过三通活塞6向量气管鼓气,并压出皂膜润湿量气管内壁,以防止实验过程中皂膜破裂。
(3)在反应管中加入3%H2O2溶液5mL,将循环恒温水通入反应管外水浴夹套。同时在一小试管中移入2mol·L-1KI溶液5mL,放入恒温槽中恒温。
图3-35 H2O2分解测定装置
1-反应管;2-搅拌子;3-水浴夹套;4-温度计;5-磁力搅拌器;6-三通活塞;
7-双连球;8-橡皮滴头(内盛肥皂水);9-量气管
(4)在反应管内加入搅拌子,打开磁力搅拌器,调节搅拌速度,使搅拌子在反应管中转速恒定,并在量气管下部压出皂膜备用。
(5)把小试管中的KI溶液倒入反应管中,约1min后塞上反应管上的橡皮塞,同时旋转活塞6使放出的氧气进入量气管。任选一时刻作为反应起始时间,同时记下量气管中皂膜位置读数Z0,以后每隔1min记录一次读数Zt,共10次。
(6)约等待20min,使分解反应趋于完成,此时反应管中没有气体放出,量气管中皂膜位置不再变化,记下量气管中皂膜位置的读数即为Z∞。
5.数据记录与处理
(1)记录相应条件(反应温室、催化剂受其浓度)并列表记录更多时间t和量气管读数Zt的对应值。
(2)计算Vt和V∞:Vt=Z0-Zt,V∞=Z0-Z∞。
(3)以ln(V∞-Vt):对t作图,从所得直线笔斜率求表观相应速率系数k1。
6.思考题
(1)反应中KI起催化作用,它的浓度与实验测得的表观反应速率系数k1的关系如何?
(2)若实验在开始测定V0时,已经先放掉了一部分氧气,这样做对实验结果有没有影响?为什么?
(3)如果V∞通过反应物H2O2的初始浓度计算得到,则本实验的实验步骤应做哪些相应的改变?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






