Goldschmidt在研究晶体结构时,结合以上几个影响因素提出了Goldschmidt结晶化学定律:一个晶体的结构取决于其组成单位的数量、相对大小和极化性质。在此基础上,2025年,Pauling根据对硅酸盐和含氧酸的研究提出了离子化合物结构的五条规则,即鲍林规则。(Pauling's rule)。
1.配位多面体规则
晶体结构中,每个阳离子周围的阴离子形成一个配位多面体;阴、阳离子之间的距离由它们的半径之和决定;阳离子的配位数由阴、阳离子的半径比决定。该规则表明阳离子的配位数取决于阴、阳离子的半径比,而并非它们本身的半径。图3.6示意了离子半径比与配位数的情况。当阴、阳离子刚好接触时是稳定的。若阳离子过小,阴、阳离子不能接触,阴离子之间的斥力使阳离子配位数下降;若阳离子过大,会撑开阴离子,阳离子配位数增加。由离子的刚性球模型,可以计算出阳离子在一定配位数时的阴、阳离子的半径比的临界值:
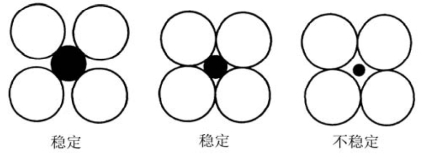
图3.6 稳定与不稳定配位构型(引自Kingery,2010)
r+/r-∈(0,0.155),阳离子配位数CN=2,配位多面体为直线或哑铃型;
r+/r-∈[0.155,0.225),阳离子配位数CN=3,配位多面体为等边三角形;
r+/r-∈[0.225,0.414),阳离子配位数CN=4,配位多面体为四面体;
r+/r-∈[0.414,0.732),阳离子配位数CN=6,配位多面体为八面体;
r+/r-∈[0.732,1),阳离子配位数CN=8,配位多面体为立方体;
r+/r-=1,阳离子配位数CN=12,等径球紧密堆积。
大多数离子晶体的阳离子配位数CN在4~8之间,而且还不是一个定值,如Al离子,有[AlO4],也有[AlO6]。由于晶体结构受多种因素影响,实际晶体结构还会出现不符合这一规则的情况。特别是阴离子不做最紧密堆积时,阳离子配位数CN可以是5、7、9、11等。(https://www.daowen.com)
2.静电价规则
一个稳定的结构,不仅在宏观上是电中性,在原子尺度上也必须是电中性。该规则是计算局部电中性的基础。阳离子价电荷数Z除以其配位数CN得到的值定义为阳离子给予一个配位阴离子的静电键强度S,其中S=Z/CN。萤石CaF2,Ca2+的CN=8,即一个Ca2+周围有八个F-。一个Ca-F键的静电键强度S=+2/8=+1/4,即一个Ca2+分配到一个F-的电荷为+1/4。而F-的电荷为-1,故为保持电中性,一个F-周围需要有4个Ca2+。该规则指出:在稳定结构中,从所有最近邻阳离子到一个阴离子的静电键强度S的总和等于该阴离子电价。该规则对我们理解晶体结构有一定帮助。
如[SiO4],Si4+给每个O2-的S=+4/4=+1,而O呈-2价,所以O2-还可与其他[SiO4]的Si4+或金属离子结合,如2个[SiO4]可共用1个O。在[AlO6]中,Al3+给O2-的S=+3/6=+1/2,故1个[SiO4]可与2个[AlO6]共用1个O,这两个[AlO6]称为二八面体。在[MgO6]中,Mg2+给O2-的S=+2/6=+1/3,故1个[SiO4]可与3个[MgO6]共用1个O,这三个[MgO6]称为三八面体。
3.配位多面体的连接方式
在一个配位结构中,两个阴离子配位多面体以共棱,特别是共面方式存在时,结构的稳定性降低。这种效应对于电价高而配位数小的阳离子(如Si4+)较明显。当阴、阳离子的半径比接近该配位多面体稳定的下限值时,此效应更显著。多面体共棱,特别是共面时,中心阳离子相距较近,斥力大,结构很不稳定。以四面体为例,图3.7(a)表示四个四面体分别共A、B、C、D四个顶点;图3.7(b)表示两个四面体共AB棱;图3.7(c)表示两个四面体共ABC面。在硅酸盐结构中,[SiO4]只能共顶,而[AlO6]可以共棱。刚玉结构中的[AlO6]还可共面。
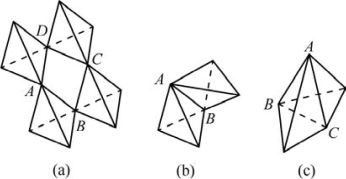
图3.7 四面体共顶、共棱、共面示意图(引自Askeland,2005)
4.不同配位多面体的连接
在一个含有不同阳离子的晶体中,电价高而配位数小的那些阳离子,不趋向于相互共有配位多面体的要素。这条规则是第三条规则的延伸。所谓共有配位多面体的要素,是指共顶、共棱和共面。如果在一种晶体结构中,有多种阳离子存在,则高电价、低配位数阳离子的配位多面体趋向于尽可能互不相连,至多也只能以共顶方式相连,如橄榄石结构有[SiO4]和[MgO6]。Si4+电价高、配位数低,因此[SiO4]彼此之间无连接,它们由[MgO6]隔开。
5.节约规则
在一个晶体中,本质不同的结构组元,其种类趋向于为数最少,此规则称为节约规则。例如在硅酸盐晶体结构中,不会同时出现[SiO4]四面体和[Si2O7]双四面体结构基元,尽管它们符合鲍林其他四条规则。第五条规则是由晶体结构的周期性和对称性决定的。如果组成晶体结构的基元较多,每一种基元都要形成自己的周期性、对称性,则它们之间会相互干扰。这不利于晶体结构的形成。
鲍林规则是由离子晶体结构归纳出来的。它符合大多数离子晶体的结构情况。但它不完全适用于过渡元素的离子晶体,更不适合非离子晶格的晶体。过渡元素的离子晶体和非离子晶格的晶体需要用晶体场、配位场理论来说明。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。








