实验十九 水生动物的扩增片段长度多态性(AFLP)分析
实验十九 水生动物的扩增片段长度多态性(AFLP)分析
一、实验目的
(1)掌握AFLP的基本原理以及酶切、连接步骤和方法。
(2)学习水产动物遗传多样性检测的AFLP方法,加深对生物多样性的理解。
二、实验原理
AFLP(Amplified Fragment Length Polymorphism)即扩增片段长度多态性,是利用PCR技术检测DNA多态性的一种方法。它的基本原理是对基因组DNA的限制性酶切片段进行选择性扩增从而获得的片段长度多态性。基因组DNA经限制性内切酶酶切产生大小不等的带有黏性末端的随机片段,然后将双链人工接头与这些酶切片段相连接形成扩增反应的模板。已知的接头序列及内切酶识别的几个碱基序列即作为引物的结合位点。经PCR扩增反应和聚丙烯酰胺凝胶电泳,最终通过对其扩增结果的电泳图谱分析,得到水产生物样品的遗传多样性信息。
AFLP检测可以采用的限制性内切酶有许多种,包括EcoRⅠ、HindⅢ、ApaⅠ、TaqⅠ、MspⅠ、HpaⅡ、MseⅠ、PstⅠ等;可以采用单酶切,也可以采用双酶切或三酶切,一般采用双酶切,其组合一般由一个高频内切酶如MseⅠ(T/TAA)和一个低频内切酶如EcoRⅠ(G/AATTC)组成。所以,AFLP技术主要包括:①模板的制备;②引物的组装;③酶切片段的扩增;④聚丙烯酰胺变性胶电泳等。以AFLP常用的限制性内切酶EcoRⅠ及MseⅠ为例(如示意图19.1),实验过程包括限制性酶切——连接接头——引物结合——PCR扩增。
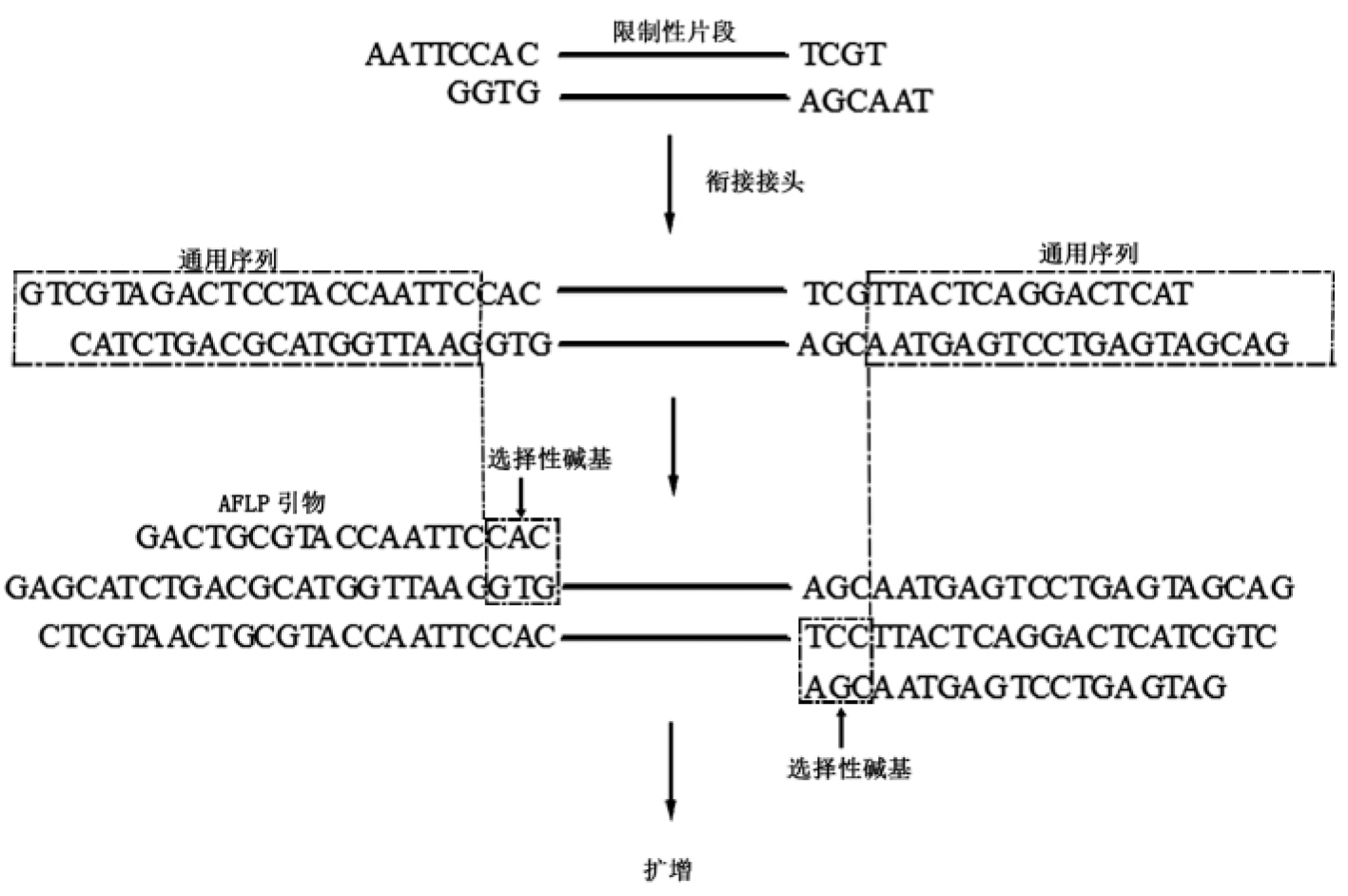
图19.1 AFLP技术示意图
AFLP接头序列包括核心序列和内切酶特异识别序列,核心序列为遵循引物设计的基本原则设计的一段随机的寡核苷酸序列,所有的内切酶核心序列不变。
EcoRⅠ接头结构如下:
5—CTCGTAGACTGCGTACC
CATCTGACGCATGGTTAA—5
MseⅠ接头结构如下:
5—GACGATGAGTCCTGAG
TACTCAGGACTCAT—5
AFLP引物由三部分组成:①核心碱基序列(core sequence,CORE),该序列与人工接头互补;②限制性内切酶识别序列(enzyme-specificsequence,ENZ);③引物3′端的选择碱基(selectiveextension,EXT)。结构如下:
CORE ENZ EXT
EcoRⅠ 5—GACTGCGTACC AATTC NNN—3
MseⅠ 5—GATGAGTCCTGAG TAA NNN—3
三、实验材料
贝类、刺参、鱼类等模板DNA。
四、实验用具和试剂
1.仪器用具
PCR扩增仪,电泳装置,离心机,移液器,0.5mL Eppendorf管,凝胶成像系统等。
2.药品试剂
CTAB裂解液(CTAB 2g,NaCl 1.4mol·L-1,Tris-HCl 100mmol·L-1,EDTA·Na220mmol·L-1,巯基乙醇0.2%),蛋白酶K,AFLP引物和接头,EcoRIⅠ内切酶,MseⅠ内切酶,T4DNA连接酶,矿物油,MgCl2,电泳所需试剂等。
五、实验步骤
1.基因组DNA的提取(同实验十七)
提取高质量DNA,调整浓度为0.1μg·μL-1。
2.限制性内切酶消化
采用EcoRⅠ/MseⅠ双酶切组合反应体系,反应体系为10μL,试剂组成如下:(https://www.daowen.com)

轻柔搅拌,轻微离心,置于PCR仪上37℃温浴3h后,65℃下3h。
3.接头制备及连接
用STE Buffer(10mM Tris-HCl,50μM NaCl,1mM EDTA)溶解DNA,将两条链等摩尔混合,94℃保温5min后,徐徐冷却至室温。酶切片段与接头连接如下:

轻微离心3~5s,16℃过夜,加入180μL TE,放于-20℃保存。
4.预扩增
连接产物用预扩增引物进行PCR反应,反应体系如下:

PCR反应程序为:72℃2min,接着20个循环,每个循环包括94℃20s、56℃30s、72℃2min,最后是60℃30min。注意:不能预热,不能热启动。
预扩增引物5μL置于新离心管中,并加入95μL TE稀释,-20℃下保存。剩下的5μL采用1.5%琼脂糖电泳检测,确认100~1 500bp间smear状产物。
5.选择性扩增
选取不同的EcoRⅠ和MseⅠ选择性扩增引物组合进行PCR反应,反应体系为:

PCR反应程序为:94℃变性2min,紧接着10个退火温度依次降低1℃的循环,这10个循环的第一个循环为94℃30s,66℃30s,72℃1min,之后20个循环,每个循环包括94℃30s,56℃30s,72℃1min,最后是60℃30min。4℃保存。
6.聚丙烯酰胺凝胶电泳
(1)PAGE凝胶的配制(6%,变性胶):尿素25.2g,丙烯酰胺3.42g,甲叉双丙烯酰胺(Bis)0.18g,10×TBE 6mL,灭菌ddH2O 20mL,过硫酸铵(Aps)24mg,四甲基乙二胺(TEMED)24μL,最后定容至60mL。
(2)玻璃板的准备:洗刷干净的玻璃板用100%酒精擦拭2~3遍,晾干。玻璃的硅化:长玻璃用亲和硅烷硅化,耳玻璃用剥离硅烷硅化,晾干。
将玻璃板叠放,倒胶,边缘用保鲜膜包好,并用夹子固定,水平静置4~5h。
(3)预电泳:电泳槽下槽加入1×TBE 500mL,上板,上槽加入1×TBE 500mL。预电泳20min,1 700V。夹紧防止漏液。
(4)PCR产物及Marker的变性:产物中加入等体积的变性剂(10μL),放入PCR仪中95℃变性3~5min,立即取出放冰上。Marker用PCR仪变性(72℃)处理5min。
(5)上样:插入梳子,上样量3~5μL,加10bp DNA Ladder Marker 1μL。电泳2.5h左右,溴酚蓝至玻璃板最下处即可。
(6)银染:2L10%冰醋酸脱色20min,ddH2O冲洗3遍,每次2~5min,染色液2L(2g AgNO3溶解入3mL 37%甲醛)染色30min,ddH2O迅速冲洗(不超过5s)后转入2L冷却显影液(60g Na2CO3,37%甲醛10mg·mL-1 Na2S2O3400μL)中显影,至出现清晰条带。迅速转入固定液(脱色用冰醋酸)中定形3~5min,ddH2O冲洗2遍,每次2min,放入烘箱中干燥过夜。
六、实验结果分析
待凝胶干燥后读板记录数据,并记录有无多态性。按照相同迁移位置上有扩增条带记为1,无带记为0的方法记录电泳谱带。只记录清晰、可重复的AFLP扩增带。统计扩增出的位点数,计算AFLP标记的多态性水平,并用多态位点数/总位点数计算多态位点比例,以及利用公式计算遗传多样性指数、Hardy-Weinberg遗传偏离指数和个体及群体间的遗传相似度和遗传距离等数据。
七、实验作业
(1)总结AFLP标记的优缺点。
(2)简述AFLP标记在水产生物遗传学研究中的应用。
八、AFLP扩增参考图谱
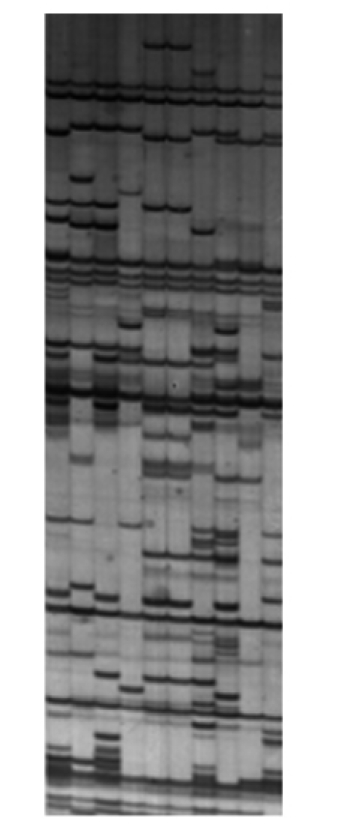
图19.2 青蛤AFLP扩增图例
