3.3.1 SOS系统的发现
当DNA受到损伤或DNA合成受到抑制时,无论是原核生物还是真核生物都会做出一系列复杂的病理生理反应。在研究得比较清楚的大肠杆菌中,这些反应包括DNA损伤修复系统的激活、细胞分裂受到抑制而不能完成、呼吸受阻、整合于细菌基因组的原噬菌体被激活而进入复制周期等。这一系列反应受到遗传调控系统操纵而高度协调,它们形成了一个综合的反应网络。罗德曼(M.Rodman)把这个可以为受损的DNA所诱导的反应网络称为SOS系统。
最早发现可诱导的修复系统的是韦格。他用经过紫外线处理的噬菌体λ感染野生型细菌,随后接种敏感菌平板,结果出现的噬菌斑很少。原因是寄主细胞来不及修复噬菌体DNA上由紫外线造成的损伤,致使λDNA不能正常地复制和增殖。可是,只要在感染前,先用紫外线处理一下细菌,则λDNA上的损伤会被寄主细胞很快修复,在敏感菌平板上可形成多得多的噬菌斑,这种现象称为韦格复活效应。
那么,诱导和激活寄主细胞修复系统的直接诱导因子是紫外线本身,还是紫外线产生的受损DNA?证实的方法是让受紫外线处理后的Hfr菌和Fˉ菌做接合杂交,随后用受体细胞做紫外线处理过的λ噬菌体的复活实验。结果表明在接合开始后第30 min,受体细胞中的诱导性修复酶活力达到极大值。因为杂交中的受体细胞并未受紫外线照射,只是在接合过程中获取了经紫外线处理过的Hfr菌的DNA分子,所以实验清楚地表明诱导性修复系统的直接诱导因子是受损的DNA,而不是紫外线。
SOS系统的修复效率非常高,在表达SOS修复功能的细胞中,DNA多聚酶可越过受损部位而复制DNA。然而,这样做会降低复制的可靠性和精确程度,导致碱基的错误参入而增加突变发生的概率,所以这个系统是一个易误修复系统(error-prone repair system)。也就是说,由受损DNA诱导的SOS功能使细胞在DNA结构受损较为严重的情况下,继续复制DNA和维持细胞存活,但要付出增加基因突变这样“昂贵”的代价(图3-10)。(https://www.daowen.com)
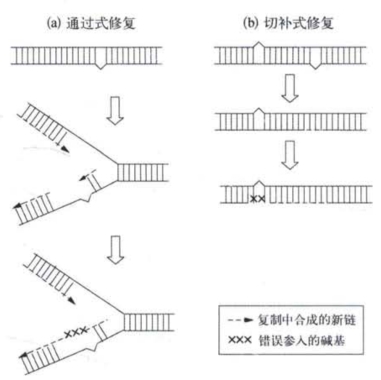
图3-10 易误修复的两个模型(改自R.E.Glass)
(a)在SOS功能表达的细胞中DNA多聚酶能越过嘧 啶双聚体而继续合成DNA,但造成错配碱基X的参入;(b)通过受损样板的SOS切补修复,这是修复双重损伤段DNA的重要方式
