7.3.4 逆病毒及其长末端重复序列
1910年美国洛克菲勒医学研究所的劳斯用鸡肉瘤组织的无细胞滤液诱发鸡肉瘤成功,并据此提出了病毒致癌假说。差不多经过半个世纪的争论和实验研究,1966年劳斯以85岁高龄获得诺贝尔生理学或医学奖。
现在已知劳斯肉瘤病毒是一种RNA肿瘤病毒,它的遗传信息载体是RNA。劳斯病毒感染寄主细胞后,由病毒RNA编码的反转录酶(又称逆转录酶)把RNA分子所载的遗传信息反向转录成单链DNA,进而又在同一种酶的作用下,以反转录产物为样板,复制其互补链,形成双链DNA分子。这个双链DNA分子随即整合于寄主细胞的基因组,以后就在寄主细胞有关酶系的催化下转录出mRNA,翻译出病毒的特异性蛋白质。因为逆向转录是RNA肿瘤病毒感染和复制中的关键性步骤,又是它和其他病毒的主要区别,所以现在多数文献上正式称它为逆病毒或者反转病毒。
逆病毒的基因组除了编码逆转录酶的基因pol外,还有编码病毒外壳蛋白的基因env和编码族特异性蛋白的基因gag。此外,往往还有一个在生物演化的进程中源自寄主细胞的癌基因(oncogene),这个细胞原癌基因的内含子已不复存在(图7-16)。在这里我们要进一步讨论的是逆病毒的某些与转移因子十分相似的生物学特性。
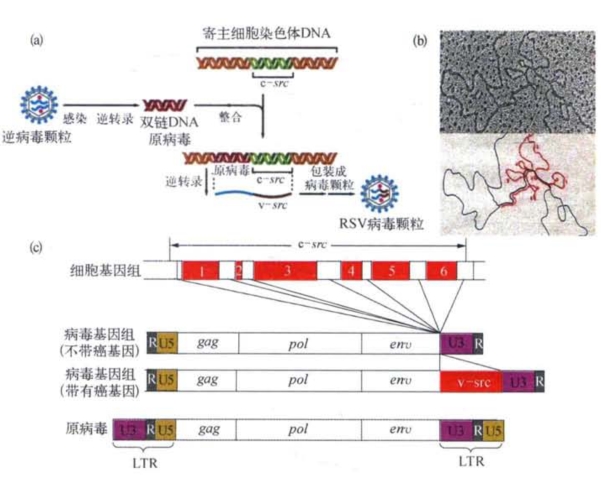
图7-16 (a)逆病毒整合v-src并通过逆转录去除内含子序列可能的演化过程;(b)c-src和v-src结构比较的电镜照片及其诠释图,注意两种分子之间不能杂合的内含子形成突出的单链环;(c)RSV基因组结构变化示意(改自J.M.Bishop等)
当逆病毒的双链DNA分子以原病毒的形式整合于寄主细胞基因组时,它的两端带有一对很长的重复序列,称为长末端重复序列(long terminal repeat,LTR)。这对LTR使原病毒DNA具有类似转座子的能动性。LTR由三部分组成(图7-17),U3是病毒RNA分子3′端的特异序列,U5是5′端的特异序列,中间是一段重复序列R。核苷酸序列分析表明,U3和U5各有一段长度为15 bp的反向重复序列,R段内部也有自身的重复序列。最引人注意的是U3段包含了一套促进和启动真核生物基因表达的功能序列,即Hogness框序TATA这个真核基因转录的起始信号,它位于R段的5′端上游。靠近R段的部分还有多聚腺苷酸出现的信号序列AATAAA。原病毒的两端都有LTR,表明它既能调节病毒DNA的转录,又能调节寄主细胞DNA的转录(图7-18)。如果逆病毒的DNA整合于寄主细胞的癌基因的转录上游,则会明显地促进寄主细胞癌基因的表达。这是关于癌基因表达异常的所谓“激活调控”学说的实验基础之一。另一种学说是癌基因结构改变导致表达的蛋白产物变异和细胞恶性转化。我们将在第8章专门讨论突变致癌学说的分子遗传学问题。(https://www.daowen.com)

图7-17 LTR对病毒以及寄主基因转录调控作用示意(改自H.E.Varmus等)
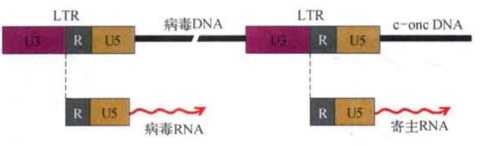
图7-18 LTR对病毒以及寄主基因转录调控作用示意(引自H.E.Varmus)
