达比加群酯
【中文名】达比加群酯
【商品名称】泰毕全Pradaxa
【外文名】dabigatran etexilate
【分子式】C34H41N7O5
【分子量】627.74

【药理作用】达比加群酯作为小分子前体药物,未显示有任何药理学活性。口服给药后,达比加群酯可被迅速吸收,并在血浆和肝脏经由酯酶催化水解转化为达比加群。达比加群是强效、竞争性、可逆性、直接凝血酶抑制剂,也是血浆中的主要活性成分。
在凝血级联反应中,凝血酶(丝氨酸蛋白酶)使纤维蛋白原转化为纤维蛋白,抑制凝血酶可预防血栓形成。达比加群还可抑制游离凝血酶、与纤维蛋白结合的凝血酶和凝血酶诱导的血小板聚集。
基于动物的体内、体外试验显示:不同血栓形成动物模型中已经证实了达比加群静脉给药和达比加群酯口服给药后的抗血栓形成疗效和抗凝活性。
根据Ⅱ期研究结果,达比加群血浆浓度和抗凝效果密切相关。达比加群可延长凝血酶时间(TT)、ECT和aPTT。
校准稀释TT(dTT)检测提供了达比加群血浆浓度的估测,因此可与预期的达比加群血浆浓度进行对比。
ECT可提供直接凝血酶抑制剂活性的直接测量。
aPTT检查已获广泛应用,并且能够提供达比加群治疗所产生的抗凝强度的近似指示信息。但是,aPTT检查的敏感度有限,而且不适用于抗凝效果的精确定量,尤其是在达比加群酯血药浓度较高时。高aPTT值解释时应谨慎。
总之,推测抗凝活性的这些检测方法能够反映达比加群水平,并且能够为出血风险的评估提供指导,如超过90th分位的达比加群谷浓度或谷值时测得的抗凝指标如aPTT,考虑与出血风险增高相关。
每日2次150mg达比加群酯给药后约2h测量的稳态几何平均达比加群峰血药浓度为175ng/mL,范围为117~275ng/mL(第25~75th百分位数范围)。给药间隔结束时(即150mg达比加群晚上剂量给药后12h)在早晨测量的达比加群几何平均谷浓度为91.0ng/mL,范围为61.0~143ng/mL(第25~75th百分位数范围)。
对于使用150mg达比加群酯每日两次预防卒中和SEE的非瓣膜性房颤患者:
●90th分位的谷值时(前次剂量10~16h后)测定的达比加群血浆浓度约为200ng/mL。
●谷值时(前次剂量10~16h后)的ECT,大约3倍于正常上限,该升高相当于观察到的90th分位的ECT延长,其值为103s。
●谷值时(前次剂量10~16h后)aPTT比值>2倍正常上限,相当于观察到的90th分位aPTT延长,其值大约为80s。
【毒理作用】根据安全性药理学、重复剂量毒性和遗传毒性的常规研究,非临床数据表明本品对人体无特殊危害。
重复剂量毒性研究中观察到的效果是由于达比加群放大的药效学作用所致。
对雌性动物生育力的影响表现为70mg/kg(相当于患者血浆暴露水平的5倍)时着床数下降和着床前损失增加。在对母体产生毒性的剂量下(相当于患者血浆暴露水平的5~10倍),观察到大鼠和家兔的胎仔体重和胚胎胎仔存活能力下降,而且胎仔变异性增加。在出生前和出生后的研究中,在对母体产生毒性的剂量水平下(高于患者中观察到的血浆暴露水平的4倍),观察到胎仔死亡率增加。
在大鼠和小鼠中开展的终生毒理学研究中,在达比加群最大剂量达到200mg/kg时,也未发现潜在致癌性证据。
【药代动力学】给药后,达比加群酯迅速且完全转化为达比加群,后者是本品在血浆中的活性成分。前体药物达比加群酯通过酯酶催化水解形成有效成分达比加群是主要代谢反应。本品口服给药后达比加群的绝对生物利用度约为6.5%。健康志愿者口服本品后,达比加群在血浆中的药代动力学特点表现为血药浓度迅速增高,给药后0.5至2.0h达到峰浓度(Cmax)。
1.吸收:有研究评估了达比加群酯的术后吸收情况,结果显示,与健康志愿者相比,手术后1至3h的吸收速度相对较慢,血浆浓度-时间曲线平缓,且无明显的血浆浓度峰值出现。在手术后阶段,由于与口服药物制剂无关的麻醉、胃肠道麻痹和外科手术效应等影响因素,导致服药后6h达到血浆峰浓度。进一步研究的结果显示,吸收减缓和延迟通常仅出现在手术当天。在此之后,达比加群吸收迅速,在给药后2h血浆浓度达到峰值水平。
进食不会影响达比加群酯的生物利用度,但会使血药浓度达峰时间延后2h。
与参比胶囊剂型相比,在去除羟丙基甲基纤维素(HPMC)胶囊外壳直接服用其中的颗粒时的口服生物利用度可能会出现最高达75%的增加。因此,在临床使用过程中应始终注意保持HPMC胶囊的完整性以避免无意导致达比加群酯生物利用度的增高。所以,应告知患者不可打开胶囊而单独服用其中的颗粒(如分散在食物或置于饮料中服用)。
2.分布:曾观察到达比加群非浓度依赖性的较低的(34%~35%)人血浆蛋白结合率。达比加群的分布容积为60~70L,后者超过了人体体液总量,提示达比加群具有中度的组织分布特性。
Cmax和血药浓度时间曲线下面积呈剂量依赖性。达比加群血浆浓度呈双幂下降,平均终末半衰期在健康老年人中约为llh。在多次给药后观察到的终末半衰期为12~14h。半衰期不依赖给药剂量。
3.生物转化、排泄:在健康男性的试验中评估了单剂静脉给予放射性标记达比加群后其代谢和排泄情况。静脉给药后,达比加群相关的放射性主要经由尿液排泄(85%)。粪便排泄占给药剂量的6%。总体放射性回收量在给药后168h达到给药剂量的88%~94%。达比加群可经由共轭反应形成具有药理学活性的乙酰葡萄糖醛酸苷共轭产物。共有1-0、2-0、3-0和4-0-乙酰葡萄糖醛酸苷这四种位置异构体,血浆中每种成分占达比加群总量的比例低于10%。仅可通过高敏分析方法测得存在微量的其他代谢产物。达比加群主要以原形经由尿液清除,清除率与肾小球滤过率相一致,约为100mL/min。
【临床实用】预防存在以下一个或多个危险因素的成人非瓣膜性房颤患者的卒中和全身性栓塞(SEE):
●先前曾有卒中、短暂性脑缺血发作或全身性栓塞。
●左心室射血分数<40%。
●伴有症状的心力衰竭,纽约心脏病协会(NYHA)心功能分级≥2级。
●年龄≥75岁。
●年龄≥65岁,且伴有以下任一疾病:糖尿病、冠心病或高血压。
应用时注意:用水送服,餐时或餐后服用均可。请勿打开胶囊。
成人的推荐剂量为每日口服300mg,即每次1粒150mg的胶囊,每日2次。应维持终身治疗。
【临床运用禁忌】
1.已知对活性成分或本品任一辅料过敏者。
2.重度肾功能受损(CrCl<30mL/min)患者。
3.临床上显著的活动性出血。
4.有大出血显著风险的病变或状况,如当前或近期消化道溃疡,高出血风险的恶性赘生物,近期脑或脊髓损伤,近期脑、脊髓或眼部手术,近期颅内出血,已知或可疑的食道静脉曲张,动静脉畸形,血管动脉瘤或主要脊柱内或脑内血管异常。
5.联合应用任何其他抗凝药物,如普通肝素(UFH)、低分子肝素(依诺肝素、达肝素等)、肝素衍生物(磺达肝癸钠等)、口服抗凝药(华法林、利伐沙班、阿哌沙班等),除非在由该种治疗转换至本品或反之,以及UFH用于维持中心静脉或动脉置管通畅的必要剂量的情况下。
6.有预期会影响存活时间的肝功能受损或肝病。
7.联合使用环孢菌素、全身性酮康唑、伊曲康唑、他克莫司和决奈达隆。
8.机械人工瓣膜。(https://www.daowen.com)
【不良反应】在考察达比加群酯在房颤患者中预防卒中和SEE的效果的关键研究中,共计12042例患者接受达比加群酯治疗。其中6059例患者接受达比加群酯每次150mg、每日2次的治疗,5983例患者接受每次110mg、每日2次的治疗。
共有22%接受卒中或SEE预防的房颤患者(最长治疗时间达3年)出现不良反应。
最常报告的不良反应是出血,大约16.5%接受卒中和SEE预防治疗的房颤患者发生不同程度的出血。
虽然临床试验中发生频率很低,但大出血或严重出血仍有可能发生,任何位置的出血有可能会导致残疾、危及生命或致命性结果。
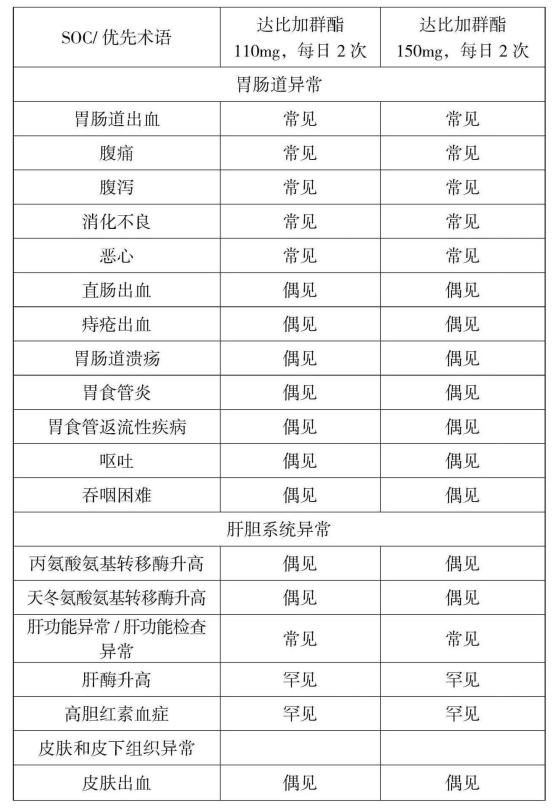
表1为预防房颤患者血栓栓塞性卒中和SEE研究中所观察到的不良反应,依据系统器官分类(SOC)列出并使用以下惯用发生频率定义进行分类:十分常见(≥1/10);
常见(≥1/100,<1/10)。
偶见(≥1/1000,<1/100)。
罕见(≥1/10000,<1/1000)。
十分罕见(<1/10000)。
不明确(从现有数据无法估计)。
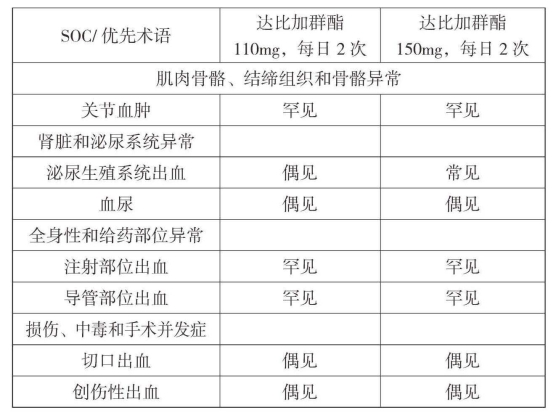
表1 RE-LY试验中观察到的不良反应

续表1
续表1
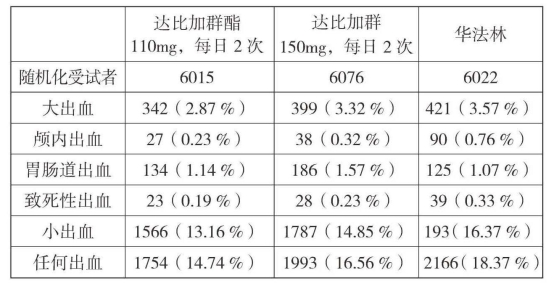
1.出血:表2列出了房颤患者血栓栓塞性卒中和SEE预防的关键研究中分类为大出血和任何出血的出血事件。
表2 RE-LY试验中的出血事件数量及年化事件率(%)
满足以下一项或以上标准可称为大出血:
出血伴有血红蛋白水平至少下降20g/L,或导致需输血或血细胞至少达2个单位的出血。
在关键部位或器官发生症状性出血:眼内、颅内、椎管内或伴有骨筋膜室综合征的肌肉内出血、腹膜后出血、关节内出血或心包出血。
满足以下一项或以上标准的大出血被称为危及生命的出血:
致死性出血、症状性颅内出血;伴有血红蛋白至少下降50g/L的出血;需要输血或血细胞至少达4个单位的出血,伴有低血压而需静脉使用升压药的出血;必须外科手术治疗的出血。
与接受华法林治疗者相比,随机接受达比加群酯每次110mg、每日2次和每次150mg、每日2次的患者,总体出血、危及生命的出血和颅内出血风险呈显著下降(P<0.05)。与华法林相比,随机接受达比加群酯每次110mg、每日两次的受试者的大出血风险显著降低[危险比0.80,(P=0.0026)]。与华法林相比,随机接受达比加群酯每次150mg、每日2次的受试者的胃肠道大出血风险显著增加[危险比1.47,(P=0.0008)],这种情况主要出现在≥75岁的患者中。
各亚组(如肾功能损害、年龄、抗血小板药物或P-gp抑制剂等联合用药)均表现出达比加群与华法林相比在预防卒中和SEE方面的益处,以及颅内出血(ICH)风险的下降。在使用抗凝血药治疗时大出血风险增加的特定患者亚组中,达比加群的过高出血风险是由胃肠道出血导致,一般出现在达比加群酯治疗开始后的前3~6个月。
2.心肌梗死:在RE-LY研究中,达比加群酯的心肌梗死年化事件率为0.82%(达比加群酯110mg、每日2次)和0.81%(达比加群酯150mg、每日2次),华法林为0.64%。
【特殊人群】
1.老年患者用药:80岁及以上年龄的患者治疗剂量为每日220mg,即每次1粒110mg的胶囊,每日2次。
参见“用法用量”项下的特殊人群。
2.儿童用药:在本品下述适应证中没有儿童人群相关应用:非瓣膜性房颤患者的卒中和SEE预防。
由于缺乏18岁以下患者使用本品的安全性和有效性数据,所以不推荐本品用于18岁以下患者。
3.孕妇及哺乳期妇女用药:
(1)妊娠:尚无关于妊娠女性暴露于本品的充分数据。
动物研究表明有生殖毒性,对人类的潜在风险未知。
在接受达比加群酯治疗的育龄女性应避免妊娠,除非必需,否则妊娠女性不应接受本品治疗。
(2)哺乳:尚无达比加群对哺乳期婴儿影响的临床数据。使用本品治疗期间应停止哺乳。
(3)生育:尚无人体试验数据。
4.肾功能不全:在一项Ⅰ期临床研究中,与不伴有肾功能受损的志愿者相比,中度肾功能受损(CrCL:30~50mL/min)的志愿者口服本品后的达比加群暴露量(AUC)大约可增高2.7倍。
与不伴有肾功能受损者相比,少数伴有重度肾功能受损(CrCL10~30mL/min)的志愿者,达比加群暴露量(AUC)可增高约6倍,半衰期大约延长2倍。
达比加群的透析清除已在7例终末期肾病(ESRD)且无房颤的患者中进行了研究。透析速度为700mL/min,时间为4h,血流速度为200mL/min或350~390mL/min。结果是达比加群浓度的50%~60%被清除。当血流速度升高至300mL/min时,透析清除的药物量与血流速度呈等比例。达比加群的抗凝活性随着血浆浓度的下降而下降,而PK/PD关系未受操作影响。
RE-LY研究中的中位CrCL为68.4mL/min。近一半(45.8%)RE-LY患者的CrCL在50~80mL/min之间。与无肾功能受损的患者(CrCL≥80mL/min)相比,中度肾功能受损的患者(CrCL在30~50mL/min之间)在给药前和给药后达比加群血药浓度分别平均高2.29倍和1.81倍。
5.肝功能不全:与12例对照者相比,12名伴有中度肝功能受损(Child Pugh B)患者的达比加群暴露量无改变。
6.体重:与体重介于50~100kg者相比,体重>100kg的患者的达比加群血药浓度谷值降低约20%。大多数(80.8%)受试者体重介于50~100kg范围内,并未发现明显差异。体重轻于50kg的患者的相关数据有限。
7.性别:在房颤患者中,女性的谷浓度和给药后浓度平均高出30%,不需要进行剂量调整。
8.种族:白种人和黄种人之间在达比加群药代动力学和药效学方面未观察到临床上相关的种族差异。
【临床用药评价】泰毕全已经开发了20多年,除了具有优异的疗效和安全性之外,还必须能够带来节约医疗开支的价值。大多数药监当局得出以下结论:泰毕全(Pradaxa)治疗对于医疗资源的利用而言,具有较高的性价比。该药的治疗效果值得肯定,不良反应也应重视。其使用性价比在国内医护人员中也受到认可。
