高效快速制氧法研究
高效快速制氧法研究
氧气的制取和性质实验是初中化学的一个重要组成部分。但教材中有关做演示实验和学生实验的方法效果均不太理想。为此,河南平顶山师专化学系赵元芳老师对这一实验进行研究改进,现总结出来和同行共商。
1反应原理
(1)高锰酸钾在较低温度下分解生成二氧化锰、锰酸钾和氧气。新生成的二氧化锰可作在较高温度下才分解的氯酸钾的催化剂。氯酸钾和高锰酸钾完全分解以后,新生成的一部分锰酸钾和二氧化锰又在较高的温度下分解放出氧气。其反应如下:
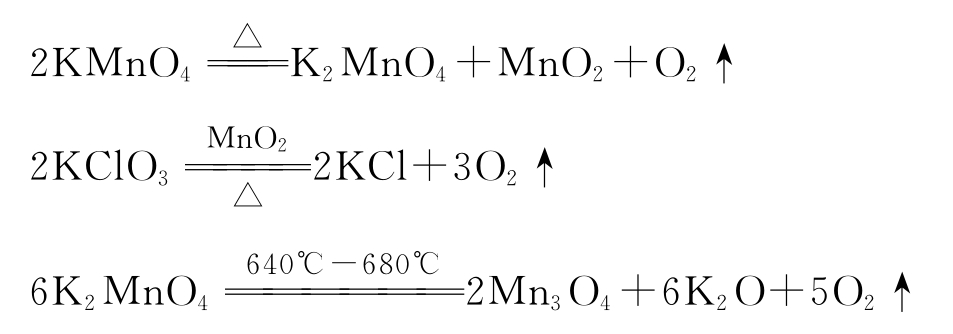
(2)试管为一圆柱体,其底部为球面形,恰似一凹镜。处于试管底部的高锰酸钾是紫黑色固体,又最易吸收热能。用普通酒精灯外焰包围试管底部加热,在管内轴线附近有一热辐射高温线,在管底有一热辐射点,这是管内温度的最高点。这个地方的温度足以达到二氧化锰和锰酸钾的分解温度。

图9 制取氧气
2实验过程
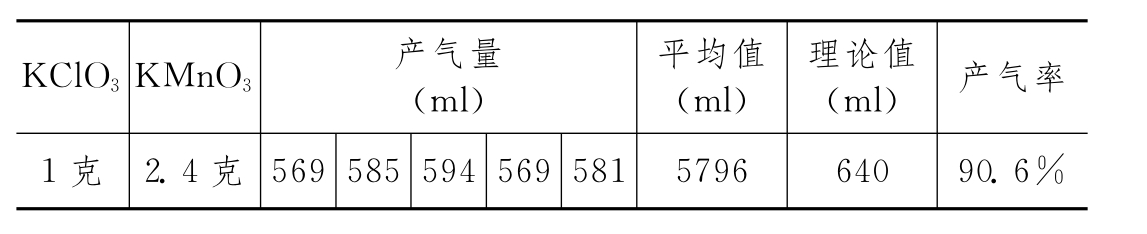
用台秤称取1克氯酸钾和2.4克高锰酸钾,混合均匀,用纸条送入大试管底部,试管直立,轻轻在书本上敲几下,使药品压实,再在反应物上加约0.3—0.5cm厚细砂,如图9固定在铁架台上。酒精灯内加足酒精,调整灯芯,外露约1cm,分成伞型,外罩5—6cm高的铁丝网罩。点燃,火焰约3寸高,外焰包围试管底部。铁夹固定在试管口部,防止烧坏铁夹上的橡皮垫。用排水取气法收集氧气。约2分钟快速反应停止,转为慢速,约5分钟反应基本停止。可收集到579.6ml氧气,远远超出氯酸钾和高锰酸钾完全分解放出的气体量。
3实验现象
加热片刻,反应即发生,反应物熔化、沸腾,只有在靠近试管壁处才有极少量反应物蒸气逸出。逸出后因试管内温度高,还会再分解,但未见火花。试管底部反应物呈红黑色熔融状,冷却后呈黑灰色固熔物。加水溶解得黑绿色溶液。这说明新生成的锰酸钾没有分解完。
4实验研究
实验得知氯酸钾和二氧化锰以质量比3∶2比较合适。经理论计算1.5克氯酸钾需1克二氧化锰,1克二氧化锰又需3.6克高锰酸钾分解提供。
3.6克高锰酸钾和1.5克氯酸钾完全分解共放出255+411=666mlO2,实验情况如下:

实验说明,除高锰酸钾和氯酸钾完全分解外,新生成的二氧化锰和锰酸钾也可能分解了。
经理论计算:1克MnO2分解生成85.8ml O2,2.2克新生成的K2MnO4在640℃~680℃可分解生成208.5ml O2,产生O2的总理论值为666+85.8+208.5=960ml,产气率为(775/960)×100%=80%
实验中发现细粉反应物飞扬厉害,损失太大。又发现反应物在高温时都已熔化,故反应物改用颗粒状(原状),先加高锰酸钾,后加氯酸钾,使氯酸钾盖在高锰酸钾表面。为提高温度,又在酒精灯上罩上铁丝网罩,试管口部加棉球。
反应现象:在收集约400ml氧气以前试管内几乎没有高锰酸钾蒸气,到高锰酸钾全部熔化、沸腾、淹没氯酸钾以后,试管内开始有蒸气,反应物上方有火星,反应物炸裂的小颗粒又落回底部,试管底部可见红黑色熔融物,棉球上有不少黑色粉末。
实验情况如下:(为了便于在一个集气瓶中收集O2,试剂用量减少。)

为防止反应物损失,在反应混合物上方加0.3—0.5cm厚的干细砂,反应时试管上方有极少量高锰酸钾细粉,看不到火星,管口棉球上有极少黑色粉末。
实验情况如下:
5说明
(1)试管竖直固定,酒精灯外焰包围试管底部,反应物受热面大,试管底部温度特别高;反应物炸裂小颗粒又落回底部继续反应;反应物不因熔化流动而损失;湿存水在高温下汽化,不易在试管口部冷疑,试管不会因冷热不均而炸裂。
(2)该实验简单,反应快,产气量大,药品利用率高,约2分钟急速反应即结束,即适于演示实验,又适于学生实验。尤其是生成的锰酸钾溶于水,呈明显黑绿色,现象直观。
(3)为减少气体损失,一加热就开始收集气体。收集到的气体包括反应器中的空气。不过反应结束,反应器中还存在等体积氧气。从理论上看收集气体的总量不变。
