测定硝酸钾在水里的溶解度的误差
测定硝酸钾在水里的溶解度的误差
“测定硝酸钾在水里的溶解度”是中学阶段第一个较复杂的定量实验。要求测出较准确的数据,难度要大一些。在“测定硝酸钾在水里的溶解度”实验中,按教材所述实验步骤进行操作,结果误差较大,湖南铁四局六处汨罗铁中邰旭燕、谭明锡老师分析主要存在两方面问题:
一是温度较低时(10℃),测得溶解度比理论值小。原因可能有三个:主要原因是硝酸钾溶液未饱和。教材上说硝酸钾固体五分钟不再溶解就证明溶液饱和了。事实上,硝酸钾在温度较低的情况下,溶解速度慢,不容易看出是否还在溶解;第二个原因是:蒸发硝酸钾饱和溶液时,局部过热,部分晶体分解:
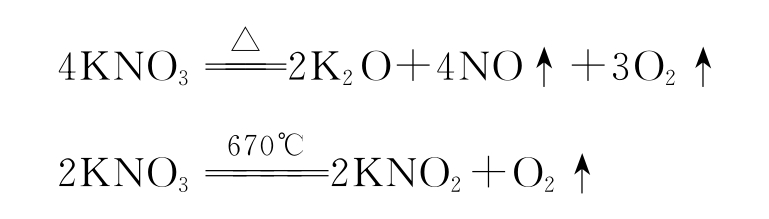
这个误差虽小,但也不容易忽视;第三个原因是蒸发饱和溶液时,硝酸钾固体爆溅。
二是温度高时(30℃以上)测得溶解度偏大,而且温度愈高,误差愈大。原因可有:
①饱和溶液转移时,把未溶解的硝酸钾晶体倒入了蒸发皿。这是主要原因。溶解硝酸钾的过程中,试管壁上不可避免地要附上硝酸钾固体,倾倒饱和溶液时就会进入蒸发皿。另外,倾倒饱和溶液时为了防止试管底部未溶解的固体倒出,往往用玻璃棒挡在试管口,玻璃棒是前面用来搅拌硝酸钾溶液的,从溶液中取出时,玻璃棒上就有晶体析出,倾倒时便被引入蒸发皿,造成误差。测定温度愈高,与室温差愈大,玻璃棒上析出的晶体愈多,误差也愈大。
②蒸发饱和溶液时水分未蒸发完。
③操作过程中渗入了杂质。
要使实验准确,应注意以下几点:
①在一大试管中先加入足量硝酸钾晶体,再加水,以免硝酸钾晶体附在管壁上。
②水不宜过多,10毫升就可以了。太多浪费药品;再者,水浴中的水不能把整个溶液淹没,溶液温度不均匀。
③温度计应插在溶液的中部,使所示温度具有代表性。
④搅拌溶液换用滴管(用挤压橡皮球方式搅拌)。滴管,温度计不要拿出溶液,以免硝酸钾结晶。
⑤硝酸钾固体溶解时,浓溶液和稀溶液间可见明显的散水纹。故搅拌时可通过观察水纹来判断硝酸钾是否继续溶解。如果没有水纹了,表明硝酸钾晶体不再溶解了。溶液已饱和。
⑥溶液温度要控制好,不要超过测定温度太大。防止在冷却过程中形成细小颗粒来不及沉降,以至于将细小颗粒连同饱和溶液取出,造成误差。
⑦用滴管(前面用来搅拌的)在温度计水银球附近取饱和溶液,使所取溶液具有代表性,这样也可避免未溶解的硝酸钾固体被取出。取溶液时要快,防止硝酸钾析出。
⑧蒸发饱和溶液要防止硝酸钾固体飞溅。加热后期要移动酒精灯,将水分除尽。硝酸钾熔化时应停一会儿再加热,以免硝酸钾分解。加热除水应重复几次,称至恒重。
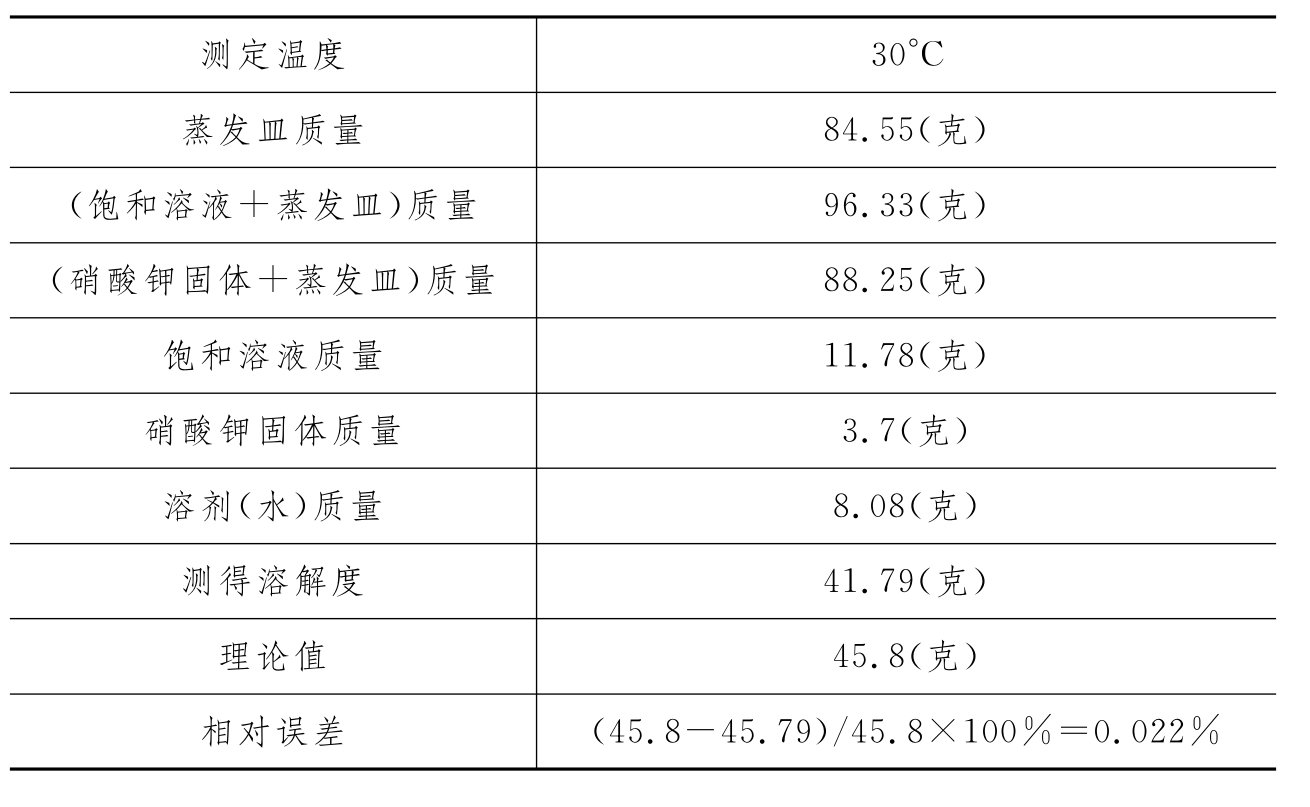
注意以上几点,测得的溶解度较准确。现将实验记录摘录如下: