中和热测定实验装置的改进
中和热测定实验装置的改进
用保温杯代替双层玻璃烧杯反应器,实验效果良好。刘博静、段绥虎、范玉琬老师的设计是:
1装置剖面图(如图3)
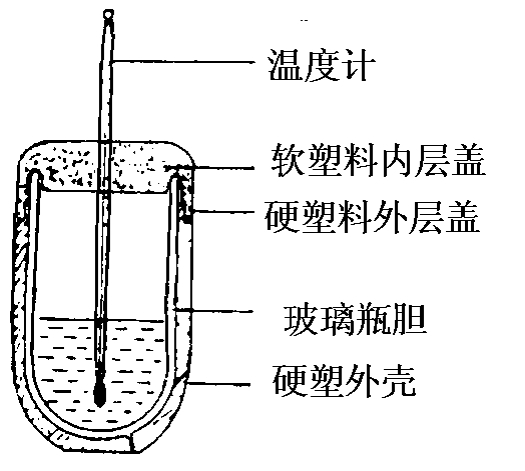
图3
2装置制作
(1)保温杯的选购:应选用200—250ml大小容积的瓶胆为宜。(也有陶瓷胆的,但不如瓶胆光滑易洗和耐酸性能好)。
(2)杯盖的钻孔:一般杯盖为双层,外层为硬塑料,里层为软塑料。用手工打孔器分层钻孔,孔分别打好后,再将原拆开的两层装在一起。要求孔一定要在两层盖的圆心位置,且上下孔对齐。
(3)温度计的选用:最好选用100℃以内的红水温度计,且刻度为每小格1℃分度以下的温度计,这样易观察准确。
(4)将温度计插入杯盖中,其下端正好在内装100ml液体的中间位置(即距杯底2—3厘米处)。温度计被软硬两层的两孔固定,既不会滑下,也不会左右摇摆,且可以上下自由调节。
3装置优点
(1)结构简单外形美观。
(2)绝热保温性能高。
(3)使用方便、结实耐用。
(4)较玻璃烧杯反应器经济实惠。
(5)可作专用仪器放置。
4实验要点
(1)首先要准确配制1M盐酸和1.1M氢氧化钠溶液。选用二级试剂,含量较准确可以不标定,若用较低级试剂,需标定含量后再使用。配制盐酸时,最好用滴定管来取浓盐酸,这样较量筒准确又可减少HCl挥发。氢氧化钠可用灵敏度较好的托盘天平称量。
(2)溶液须是新配制的,且要充分冷却到室温后方可使用。
(3)杯子使用时,需先打开杯盖,使杯内温度等于室温后再使用。重复实验时要将杯内洗净,水洗后的保温杯内温度较低(自来水温通常低于室温),待恢复室温后再进行实验。
(4)量好的盐酸溶液需先倒入保温杯,可尽量倒完(因其为定量),后倒入氢氧化钠溶液(因其为足量),操作要快,倒后立即将杯盖盖好拧紧,然后用手轻轻摇匀杯中的混合溶液,使其充分反应(不要用玻璃棒或温度计搅拌,以防碰坏杯底,也容易使热量散失)。及时观察温度上升情况,准确读取最高温度,记为终止温度,读数精确到0.1℃—0.2℃。
①室温下Zn与CuSO4稀溶液反应置换出来的铜呈黑色粉末状。
②室温下Zn与饱和CuSO4溶液反应置换出来的铜呈紫红色颗粒状。
③室温下Zn与少量H2SO4酸化CuSO4稀溶液反应置换出的铜呈暗红色颗粒状。
④室温下Zn与少量HCl酸化的CuSO4稀溶液反应置换出的铜呈紫红色颗粒状。
⑤Zn与热的饱和CuSO4溶液反应,置换出的铜呈紫红色颗粒状。
⑥Zn与HCl酸化的热(不必煮沸)饱和CuSO4溶液反应十分激烈,置换出的铜量多,颗粒粗大,色泽酷似纯铜,呈紫红色,实验效果最佳。
⑦Zn与加有少量NaCl与KCl的热饱和CuSO4溶液反应也十分激烈,效果与上述步骤6相同,置换出的铜呈紫红色颗粒状。
以上实验结果说明:增大CuSO4溶液的浓度、加热、加入少量稀酸、加入Cl-,都能使Zn与CuSO4溶液反应置换出的铜呈紫红色。这是因为:
(1)增大CuSO4溶液的浓度,化学反应速度加快。
(2)加热也能加快化学反应速度。
(3)加入稀酸能抑制CuSO4水解,增强Cu2+的氧化能力。
(4)加入Cl-(NaCl、KCl、HCl),由于Cl-能破坏金属Zn表面的氧化膜,促使Zn与Cu2+接触,从而加快化学反应速度。
1Zn与CuSO4稀溶液反应析出的黑色粉末状物质是纯铜吗?
(1)黑色粉末状物质是纯铜。
Zn与CuSO4稀溶液反应置换出的铜呈黑色粉末状,把这些黑色粉末状物质收集起来,用蒸馏水洗涤、过滤,重复操作多次,至到滤液中检验不出 (用BaCl2检验)为止,说明黑色粉末状沉淀物中不含
(用BaCl2检验)为止,说明黑色粉末状沉淀物中不含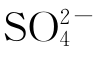 、Zn2+、Cu2+。然后把黑色粉末状物质用稀酸(HCl或H2SO4)浸泡,黑色粉末状物质立即变成紫红色晶体,且上层清液无色。取上层清液进行检验,除溶液显强酸性外无Cu2+和Zn2+,说明黑色粉末状物质是纯铜。
、Zn2+、Cu2+。然后把黑色粉末状物质用稀酸(HCl或H2SO4)浸泡,黑色粉末状物质立即变成紫红色晶体,且上层清液无色。取上层清液进行检验,除溶液显强酸性外无Cu2+和Zn2+,说明黑色粉末状物质是纯铜。
(2)Zn与CuSO4稀溶液反应析出的铜为什么呈黑色?
Zn与CuSO4稀溶液反应,由于CuSO4浓度小和CuSO4的水解,Cu2+的氧化能力减小,再加上金属Zn表面氧化膜的存在,使Zn与CuSO4稀溶液反应的速度减慢,生成的铜不能在良好的反应环境中析出,析出的铜呈黑色粉末状晶体。这些黑色粉末状晶体是多晶体,多晶体是由许多取向不同的单晶体颗粒拼结而成的,不能为同一点阵所贯穿的晶体。粉末状晶体由于晶格排列得不规律,把可见光吸收后辐射不出去,所以呈黑色。
当把黑色粉末状晶体置于稀酸中,铜在良好的环境中重新结晶,由黑色粉末状晶体立即变成紫红色颗粒状。
