复分解法制取纯碱的课外实验
复分解法制取纯碱的课外实验
纯碱是基本化工产品之一,用途十分广泛。李潭生老师将此法复分解法生产纯碱的要点介绍如下,同学们可做课外活动实验。
1反应原理
以碳酸氢铵和食盐为主要原料,发生复分解反应:
NH4HCO3+NaCl=NaHCO3↓+NH4Cl
由于生成的NaHCO3在水中的溶解度较小,从溶液中结晶燃烧,经煅烧即得纯碱。
![]()
反应中生成的氯化铵,可根据其溶解度随温度变化比较灵敏(与食盐的溶解度相比),把反应后的母液降温,即可有氯化铵结晶析出。从而使氯化铵得以分离。因此可得纯碱和氯化铵两种产品原料得到较为充分的利用。
2实验用品
(1)仪器:2000ml大水槽(可用面盆代替)、搅拌棒、布氏漏斗吸滤装置(可用竹篦子铺以白布或尼龙布代替)、加热用电炉、小锅、酸式滴定管、量筒(100ml)、液量管(1ml)、锥形瓶(100ml)。
(2)药品:农用碳酸氢铵、粉碎好的食盐(过100目筛,如无法得到,则研得越细越好)、酒精、硫酸铵(农用型)、1%BaCl2溶液、36%醋酸、茜素红溶液。
3操作方法
(1)在水槽中加入1升水,投入粉碎好的食盐,搅拌溶解。制成饱和溶液(如水温20℃食盐需用量为360克),水浴加热使水温至35℃—40℃。
(2)边搅拌边向食盐溶液中投入农用碳酸氢铵,就可见溶液中有白色晶体析出。随着碳酸氢铵加入量的增加,沉淀越来越多,直至把480克全部加入。
(3)将析出的晶体用吸滤法过滤,过滤后,用清水洗涤两次(注意控制洗涤用水处理),即得到NaHCO3。过滤后的液体与洗涤水合并,称为一号母液。
(4)把所得的NaHCO3,用小铁锅加热,使其分解,就制得纯碱。
(5)往一号母液中加入一定量的硫酸铵,使溶液中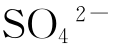 浓度在15—20滴度(1升中含
浓度在15—20滴度(1升中含 48克等于20滴度),然后边搅拌边加入细食盐280克并降温至10℃—15℃(用冰盐水降温为好),此时即有大量氯化铵析出。
48克等于20滴度),然后边搅拌边加入细食盐280克并降温至10℃—15℃(用冰盐水降温为好),此时即有大量氯化铵析出。
(6)把析出的氯化铵用布氏漏斗过滤,即得可供农用的氯化铵,滤液称为二号母液。
(7)再往二号母液中加入450克NH4HCO3,同时升温至35℃—40℃,按上面的过程重复操作即可有NaHCO3和NH4Cl不断析出。
4说明
(1)往一号母液中加入一定量的(NH4)2SO4(也可用H2SO4或NH4NO3),是为了使溶液中除Cl-和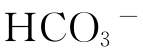 外还有第三种酸根离子,这有利于NH4Cl的生成。由于有第三种酸根离子的参与反应,因此此法又称为中间盐法。
外还有第三种酸根离子,这有利于NH4Cl的生成。由于有第三种酸根离子的参与反应,因此此法又称为中间盐法。
(2)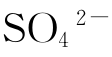 浓度的化验,可按下法进行:用液量管吸取待测母液1ml,加水25ml,稀释(在锥形瓶内操作),滴加茜素红指示剂8滴,再加36%醋酸溶液3ml,混匀后加入酒精20ml(95%),然后用BaCl2溶液快速滴定至肉红色为反应终点。根据BaCl2溶液的用量,即可计算出SO42-的滴度(分析化验中,溶液的浓度多采用当量浓度N,在初中这里改用百分比浓度)。
浓度的化验,可按下法进行:用液量管吸取待测母液1ml,加水25ml,稀释(在锥形瓶内操作),滴加茜素红指示剂8滴,再加36%醋酸溶液3ml,混匀后加入酒精20ml(95%),然后用BaCl2溶液快速滴定至肉红色为反应终点。根据BaCl2溶液的用量,即可计算出SO42-的滴度(分析化验中,溶液的浓度多采用当量浓度N,在初中这里改用百分比浓度)。
(3)此法可直接应用于家庭实验。
