3 标本制作
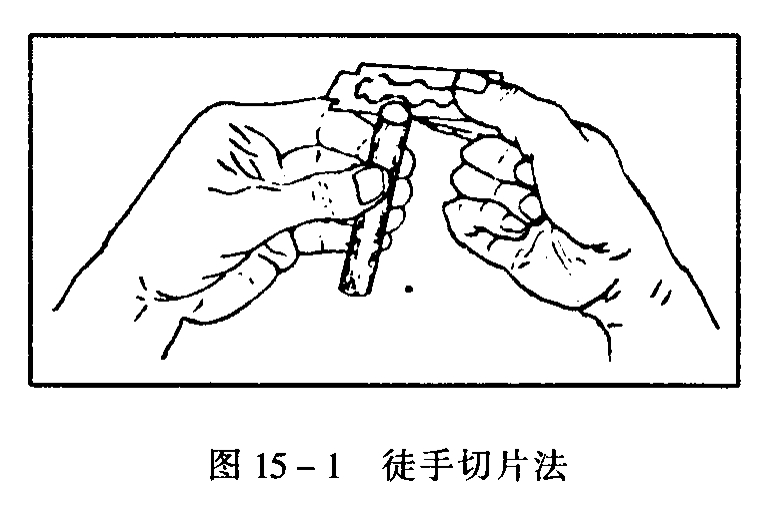
(1)徒手切片。
就是将实验材料采集来后用水洗干净。在切片时,用左手的拇指、食指和中指夹住材料。在夹材料时切勿太紧,也不要太松。右手用拇指与食指钳夹双面刀或单面刀(或其他刀)(如图15-1)。切片时刀片与材料切口基本上保持平行,刀片从左前方向右后方切。切片时刀口应用水湿润一下,以免切片干燥变形,同时也利于切片。每切一材料,要连续切几片,切片尽量切得薄一些,做组织化学用的切片厚度也不要超过40微米。切好的材料放在装有清水的培养皿中,观察时,从切片中选取最薄的片子。有些植物或植物的某些部分(如叶片、子房等)无法按上所述方法进行切片,可用马铃薯、甘薯或萝卜等切成长条小块,然后将小块切成两半作支持物,将材料放入切口后,将两半合起来再切。切好的片子剔除支持物后放在装水的培养皿中。切片用的刀一定要锋利,因此,要经常磨,用完后最好把刀片擦干,以防生锈,长久不用时要涂上凡士林防锈。
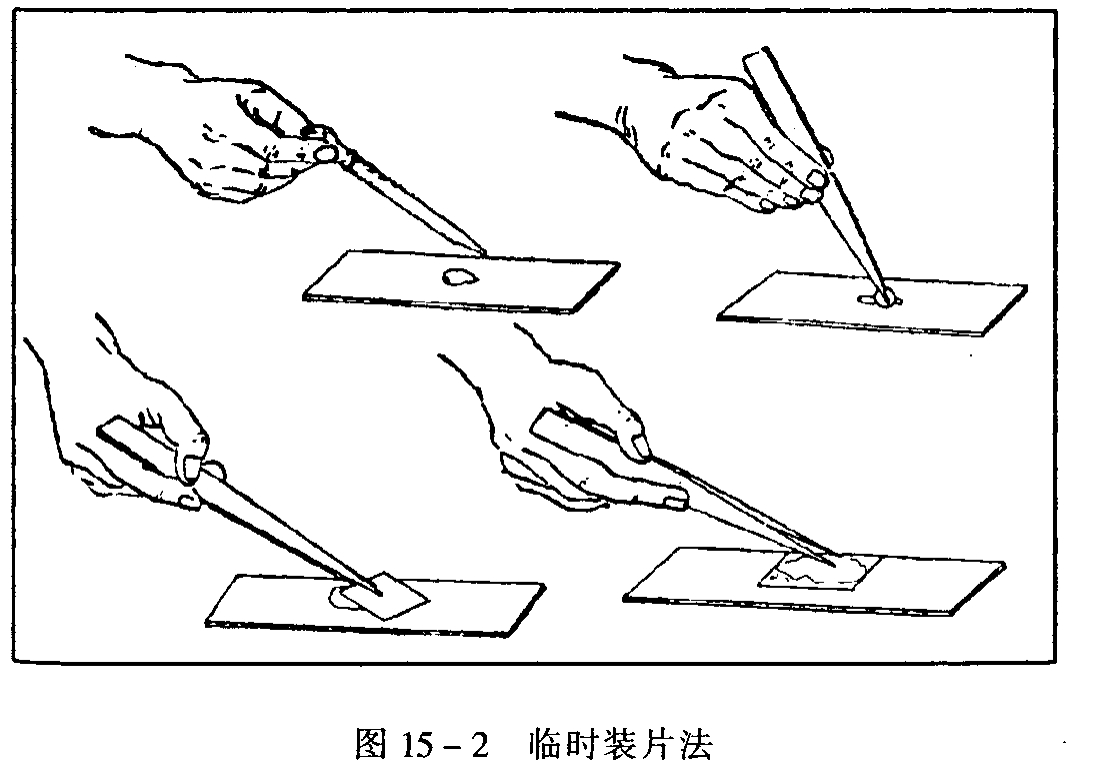
(2)临时装片。
装片前应将盖玻片、载玻片用纱布擦干净。盖玻片很薄易破,要特别小心,擦时左手用拇指和食指夹住盖玻片的两边或两角,右手用干净的纱布放在盖玻片的上下两个面,并用右手拇指与食指放在盖玻片的上下两个面,钳住纱布,用力均匀地擦。装片时,先在近载玻片的中央滴上一滴清水,将观察材料(如徒手切片等),用镊子钳住放在水滴上,然后用镊子钳住盖玻片的一侧或用拇指和食指拿着盖玻片的两角,沿水滴的边缘将盖玻片一边先放下,然后整个盖玻片轻轻地向下放(如图15-2),切忌要一下放下去,尽量减少气泡的产生,以免影响观察。水应充满整个盖玻片下面的面积,假如水太少,可用吸管在盖玻片的一侧将水加进去,另一侧用吸水纸,将水吸过去,使盖玻片下部有水。假如水分太多,材料易浮动,影响观察可用吸水纸在盖玻片的一侧吸去多余的水分。使盖玻片下的材料全浸没在水中又紧贴于盖玻片之下,而不被水所浮动。做好临时装片后,片子上仍然要保持干净。因为盖玻片下的水分容易蒸发,所以长时间的观察必须从盖玻片一侧不断地用吸管加水,特别是气温高、天气干燥的季节尤其要注意加水,或用熔化后的石蜡涂在盖玻片与载玻片接触的四周,防止水分蒸发。片子装好后贴上标签,注明材料名称、制作时间等,便可在显微镜下观察。
(3)几种显示细胞构造及内含物的染色方法。(https://www.daowen.com)
淀粉粒:细胞中淀粉粒呈颗粒状存在于细胞质,把马铃薯块茎切成薄片,或用刀片在马铃薯块茎的切面上轻轻地刮几下,放在载玻片寸上滴上一滴碘化钾—碘液。此液不宜过浓,最好再冲淡了几倍至10倍。几分钟后,就可观察到有单粒和半复粒淀粉,复粒淀粉甚少。淀粉被染成淡蓝色,并能清楚地看到淀粉中心与昼夜沉积的轮纹。
蛋白质:将材料作徒手切片后,放在载玻片上,滴上一滴浓硝酸,含有酪氨酸的复合蛋白质变成鲜黄色,吸去部分硝酸而加入氨水,颜色由黄色急剧转变为棕黄色。或将切片放在碘—碘化钾的溶液中,含有蛋白质的细胞立即呈现黄色。用黄豆种子徒手切片,切好片子放在水中以除去液泡中所含的其他物质,然后滴上一滴碘——碘化钾溶液,蛋白质与淀粉同时染上色,但蛋白质部分被染成黄色,淀粉则被染成蓝色。
脂肪与油:用蓖麻和核桃等种子的种仁切成薄片,将切片放在苏丹Ⅲ—酒精—甘油液中浸24小时,取出用50%酒精洗涤,再放在甘油中用显微镜观察。染色慢时可微微加热,油脂类可染成淡黄或红色,假如油滴从细胞中游离出来,则看到一个个被染成淡黄或红色的圆形小滴。假如有硬脂酸或脂肪结晶时,染色将会十分缓慢,在这种情况下,只要稍稍加热,便可染上。苏丹Ⅲ溶液:0.2克苏丹Ⅲ溶于100毫升纯酒精中。加热,便成饱和溶液。
木质素:组成植物细胞壁的成分之一是木质素,常在木质化加厚的细胞壁中存在,如导管、管胞及纤维细胞。将小枝条作徒手切片,取最薄的切片放在载玻片上,先滴上一滴盐酸,再滴上一滴间苯三酚酒精溶液(间苯三酚在酸性条件下才能与木质素起作用)。木质化的细胞壁呈现樱红或紫红色(树胶也有同样的颜色反应)。
间苯三酚液:用0.1克间苯三酚溶于10毫升的95%酒精中。
果胶质:将徒手切片或洋葱鳞茎内表皮放在载玻片上,用0.02%的钌红水溶液染色半小时左右。或将材料放在上述钌红水溶液中染色半小时左右。取出后放在载玻片上,盖上盖玻片,用显微镜观察,可以看到细胞壁被染成淡红色的部分。但细胞中含氮物质,染色体、细胞核均能被钌红所染色。钌红水溶液要放在暗处,瓶子要洗涤得很干净,否则,钌红很快被还原沉淀。
纤维素:纤维素是植物细胞壁的主要成分。用幼嫩的枝条作徒手切片,或用洋葱鳞茎内表皮装片,将切片(或鳞茎内表皮)放在载玻片上,滴上一滴1%碘液,然后加上一滴66.5%硫酸(7份浓硫酸加3份蒸馏水)。稍等片刻,纤维素的细胞壁便呈现蓝色。
1%碘液:将1.5克碘化钾溶于100毫升的蒸馏水,待全溶解后,加入1克碘搅拌溶解。
