经皮腔内球囊血管成形术
第二节 经皮腔内球囊血管成形术
经皮腔内球囊血管成形术(percutaneous transluminal angioplasty,PTA) 1964年Dotter和Judkins首先采用同轴导管系统治疗动脉粥样硬化所致的下肢动脉狭窄,使阻塞的血管再通,开创了介入放射学新领域。1974年,Gruntzig研发了一种由聚氯乙烯(PVC)构成的双腔球囊导管。经皮腔内球囊成形术(balloon angioplasty)当时被认为在血管领域治疗动脉闭塞疾病最有价值的微创方法。但由于PVC球囊扩张易于超过设计大小和在超过6个大气压(atm)时发生破裂,它很快被抵抗力更强超过17个大气压的聚乙烯球囊取代。Gruntzig聚乙烯球囊导管的出现使PTA技术得到了飞跃发展,介入技术治疗血管病变病例大幅度增加。
PTA术最初主要应用于下肢动脉和肾动脉,后来这种技术应用范围得到了扩大,包括肠系膜动脉、腹腔动脉干、腹主动脉、头臂动脉和静脉系统。近年随着技术发展,PTA已经应用于血管供应的心脑重要功能器官。目前冠状动脉PTA已经成为常规治疗方法,颈动脉、椎基底动脉和颅内动脉PTA的应用也呈逐年增加趋势。另外,PTA也用于某些动脉移植血管吻合狭窄,通常PTA前应用链激酶或尿激酶再通移植血管。PTA也可与人工血管移植术结合治疗周围血管疾病(PVD)患者,如PTA治疗一侧或双侧髂动脉狭窄和闭塞,代替经腹主动脉-髂动脉或腹主动脉—股动脉血管移植术。这样可在硬膜外麻醉下同时进行股腘动脉血管移植术,避免更广泛的外科手术损伤。对于严重肢体缺血需要截肢的患者,PTA通过股腘动脉再通可能挽救肢体。即使患者必须行截肢手术,也应考虑进行PTA治疗,因为一些不能挽救肢体的患者,通过PTA治疗后可能减少患者截肢范围。
Fontaine将下肢动脉狭窄分为四期,Ⅰ期:患者无任何症状和体征或症状不典型,皮肤血液灌注正常。Ⅱ期:间歇性跛行。静息时肌肉血流正常,运动时减低。Ⅲ期:静息痛,特别是脚趾部,需应用强镇痛剂。夜间疼痛更明显。Ⅳ期:坏疽期。损伤或伴感染形成溃疡样病变,疼痛加重,甚至在静息时无脉。根据上述分期下肢动脉狭窄Ⅰ期患者通常不需要手术或PTA治疗。然而一些重要动脉狭窄或特殊部位如股腘区动脉,这些区的血管更易发生闭塞和形成血栓,易发展为动脉完全闭塞,对这部分患者积极进行PTA治疗可阻止疾病进一步发展。Ⅱ期患者局限狭窄或小于10cm节段性闭塞,PTA治疗可获得较好的效果。对于髂动脉狭窄或闭塞,PTA应作为首选,特别是老年或手术危险性高的患者。Ⅲ期和Ⅳ期采取任何成功再通方法均可不同程度改善病情,但是不完全的或短暂的。当考虑选择手术或PTA两种治疗方法时,PTA应优先选择。这个时期患者通常PTA和溶栓治疗结合应用,目的是溶解近期血栓和扩张血栓引起的动脉狭窄。
PTA治疗动脉狭窄和闭塞可延长患者进行外科手术时间和降低治疗费用。临床应用一个主要限制是长段动脉闭塞(>10~20cm),导丝和导管常常不能穿过病变段和进行适当的扩张;另一种情况是没有血管残根,使操作时找不到动脉开口,例如肾动脉开口闭塞、股浅动脉起始段闭塞和主动脉分叉部髂总动脉起始段闭塞时,常规导丝常常不能插入到闭塞血管内。
一、适应证和禁忌证
1.PTA适应证
(1)动脉粥样硬化及大动脉炎引起的有血流动力学意义的血管狭窄或闭塞。
(2)血管搭桥术后所致的吻合口狭窄及移植血管狭窄。
(3)血管肌纤维不良所致的局限性狭窄。
(4)其他原因所致的有血流动力学意义的肢体动脉局限性狭窄或闭塞。
(5)血管移植术前病变血管扩张的辅助措施,或因缺血造成截肢术前试行挽救肢体或降低截肢水平。
2.PTA禁忌证
(1)碘过敏(目前可用CO2行血管造影)。
(2)严重心、肝、肾功能不全,或凝血机制异常。
(3)有动脉瘤形成。
(4)狭窄段有溃疡或钙化者(须配合支架植入)。
(5)大动脉炎活动期。
二、PTA术前准备
1.病人准备 PTA术前病人应完善各项术前检查,尤其应重视凝血机制的检查。应向患者介绍PTA操作过程、拟解决的问题、可能的风险等,以取得患者的理解和合作。并签署手术同意知情书。患者术前可口服必要的降压药(高血压病人)、阿司匹林等。做好局麻药和碘过敏试验。术前4小时病人应开始禁食。同时患者充分水化对介入治疗更有利,可加快对比剂经肾排泄和降低肾毒性。为了防止动脉痉挛,可给钙通道拮抗剂(口服尼丹平10mg)。术前半小时,肌注阿托品0.5mg,鲁米那钠100mg。建立静脉输液通路。
2.对比剂准备 目前,应用于临床的非离子低渗透压对比剂,对于X线血管造影检查和介入治疗是安全和可靠的。但少数病例由于对比剂过敏或肾功能不全,碘对比剂使用禁忌证而不能进行X线血管造影检查或介入治疗。一些学者应用二氧化碳气体或磁共振对比剂(Gd-DTPA)进行血管造影和介入操作。二氧化碳血管对比剂是利用手推注射器或特殊二氧化碳注射器,经导管注入20ml二氧化碳气体,依赖动脉血流显示双髂动脉和下肢动脉。根据临床应用经验Gd-DTPA比碘对比剂更安全,碘对比剂比Gd-DTPA过敏反应和肾毒性发生率高出10~30倍。对于少数碘对比剂使用禁忌证患者,应用二氧化碳或Gd-DTPA可满意显示动脉系统血管影像和进行介入治疗。
3.器械准备 根据病人的手术所需,准备好穿刺针、血管鞘、导丝、导管和球囊导管等器械。导管鞘主要引导诊断性造影导管、球囊导管顺利进入血管,便于操作和多次交换不同型号导管及球囊,避免穿刺部位的血管损伤和渗血。导管鞘须与拟选择的球囊导管型号相适应,常用7~9F导管鞘。当遇到血管坚固的狭窄和闭塞时,需用长锥形导管进行预扩张,如Staple van Andel扩张导管。单一双腔球囊导管适用于大部分病变血管的扩张,直径多在2~20mm之间,粗细为4~9F。诊断性造影导管和常用球囊导管多配以0.035英寸或0.038英寸导丝,微球囊导管则用0.014~0.028英寸细导丝。对扭曲不规则的血管狭窄段,可用0.014英寸或0.018英寸铂尖易控导丝或顺滑M形导丝,以保护动脉免受损伤。
三、PTA操作
PTA的基本操作过程是利用Seldinger技术穿刺插管,导丝穿过狭窄或闭塞动脉段,球囊导管放置在狭窄或闭塞动脉段,用球囊扩张病变血管,最后将球囊导管撤出。具体如下:
(1)动脉穿刺插管途径 股动脉是最常用的动脉入径途径。可逆行或顺行穿刺插管。如腹主动脉、髂动脉、肾动脉、肠系膜上动脉和头臂动脉PTA,应采用逆行股动脉穿刺插管,而股浅动脉或腘动脉PTA则采用顺行穿刺插管。对侧股动脉穿刺插管,通常应用于髂总动脉和股总动脉闭塞或高位股浅动脉病变,可以使PTA操作更方便。双侧髂股动脉和腹主动脉远段严重狭窄或闭塞时,股动脉途径入径常常较困难或失败,这时可考虑其他动脉穿刺途径,包括腋动脉、肱动脉和腘动脉途径等,其主要缺点是由于导管路径长,导管或导丝通过病变动脉段的线性力减低,常常使球囊导管通过病变动脉段较困难或失败,特别是严重主动脉硬化或扩张时。另外,也增加了这些动脉途径发生动脉痉挛、动脉血栓和局部血肿等并发症的可能。(https://www.daowen.com)
为了避免和减少穿刺部位血管损伤,首先应用Seldinger技术插入导管鞘,选择的导管鞘应大于球囊导管。可利用导管鞘侧孔在术中持续滴注肝素盐水。同时也可以在不退出球囊导管的情况下,随时注入对比剂进行必要的观察。
(2)导丝穿过动脉病变段 导丝穿过狭窄或闭塞动脉是PTA成功的关键。局部动脉狭窄时,导丝穿过狭窄动脉段通常较容易,但遇偏心性动脉严重狭窄和动脉闭塞时,导丝穿过狭窄的动脉段常常较困难,甚至导丝误插入到动脉斑块内,由于方向错误进一步推送导丝,可造成内膜夹层或动脉硬化斑块移动的危险。因此,在导丝遇到阻力时,不应盲目用力推送导丝,应反复边旋转边推送导丝,寻找狭窄开口,使其顺利穿过。也可应用可控导丝控制导丝尖端方向,使导丝操作更容易穿过动脉狭窄段。应用150°弯曲的导管可帮助导丝通过偏心性动脉狭窄段,操作方法是边旋转导管边注射对比剂,当发现狭窄开口时,立即将导丝插入并穿过狭窄段,这种方法比用直导丝盲插对血管损伤小,但压力过大注射对比剂可引起内膜夹层。遇动脉完全闭塞时,首先将直导管送到闭塞段近端,有时轻柔推送就可将导丝送到闭塞段远端。如遇阻力,可将导管头楔入到闭塞段内进行腔内造影,在路标图导引下反复交替推送导丝和导管,使其穿过闭塞段和到达闭塞段远端。试推对比剂证实导丝在病变的管腔内,推送导引导管使其通过闭塞段和进行预扩张。当导引导管或球囊导管通过困难时,可用6~9F尖端逐渐变细导管,如Staple van Andel扩张导管进行预扩张。导引导管到达闭塞段远端后,将导丝撤出,并经导管团注5 000U肝素,再将较长的加强导丝送入到闭塞段远端血管内,准备下一步操作。如果导丝和导管反复试验导丝仍不能通过动脉闭塞段时,可采用Reekers等提出的经皮意向性腔外再通(percutaneous intention extraluminal recanalinaction,PIER)技术。PIER技术是用特制的弯型导管插入到闭塞近端的动脉内膜下,注射少量对比剂证实导管尖端在内膜下腔,推送直导丝使其沿闭塞段动脉壁内膜下腔前进,让导管头端成角并指向血管腔,导丝配合下使导管经内膜下腔再进入闭塞远端血管腔。注射对比剂证实导管位于闭塞远端血管腔内,再扩张内膜下腔形成新的腔,应用PIER技术时一定要密切注意导丝和导管头端位置,避免穿破血管,造成动脉穿孔、破裂等严重并发症。
(3)球囊扩张 目前最常用的球囊导管为新一代高压球囊,优点是扩张时球囊壁压力分布均匀,当球囊扩张到它的正常管径时,进一步增加压力,球囊管径不再增加。由于X线血管造影测量血管管径常常存在放大(15%~25%)可能造成一定的误差,应注意通过导管管径、不透X线标尺和球囊金属标记间接测量和校对血管管径。球囊扩张后动脉壁常有弹性回缩,原则上选择大于狭窄邻近正常血管管径10%~20%球囊。根据病变血管范围选择球囊长度。长段血管病变可用10cm长球囊扩张,导丝穿过病变后,透视监视下沿导丝把球囊导管放置到需要治疗的病变血管段,并根据球囊两端不透X线标记精确调整球囊位置(图11-1、2)。
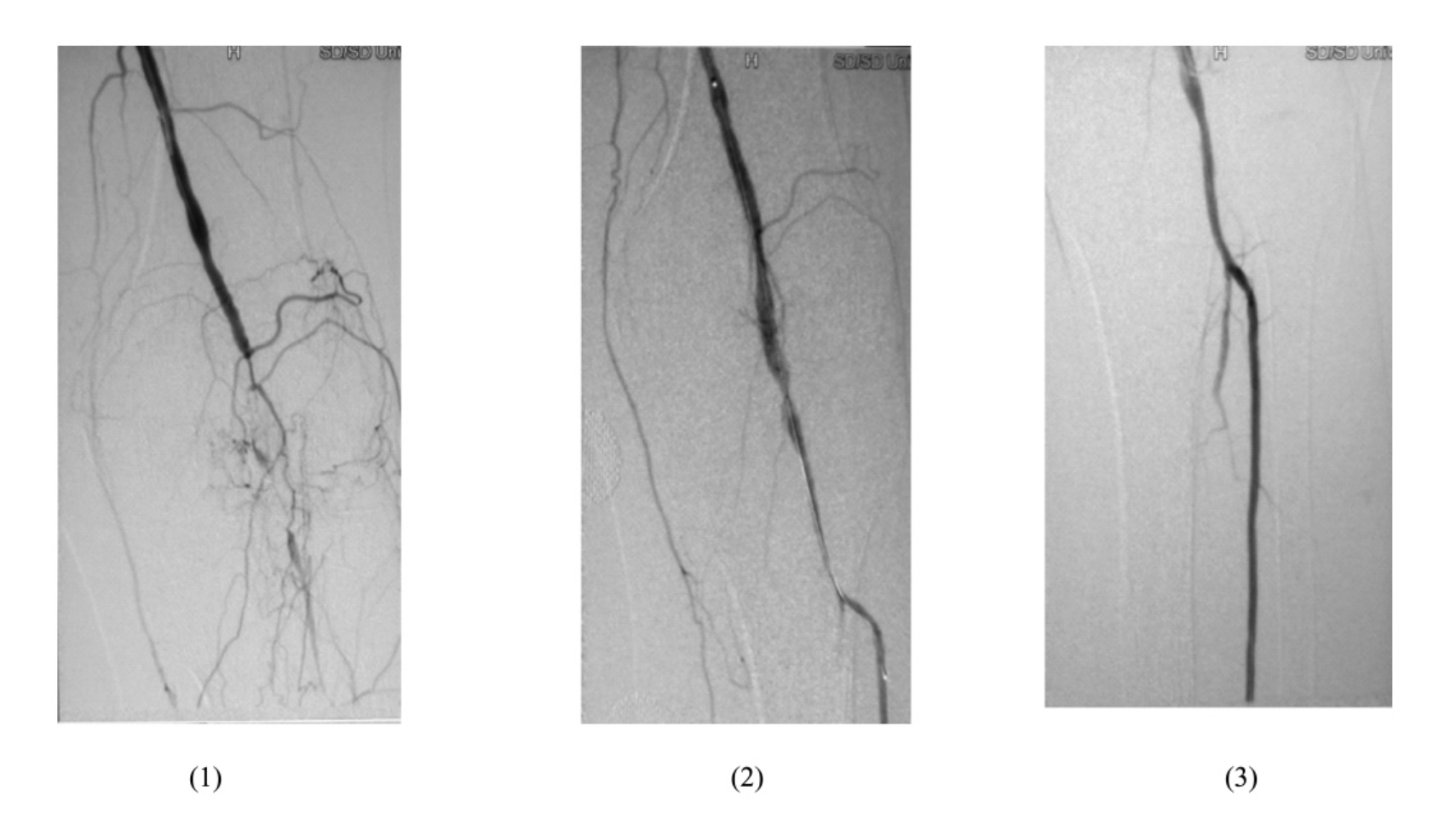
图11-1 球囊扩张术(一)
(1)DSA造影示左腘动脉完全闭塞,局部少量侧支形成 (2)导丝轻柔缓慢打开并通过闭塞段 (3)局部球囊成形术后,造影显示腘动脉及胫前动脉开通,血流通过顺利
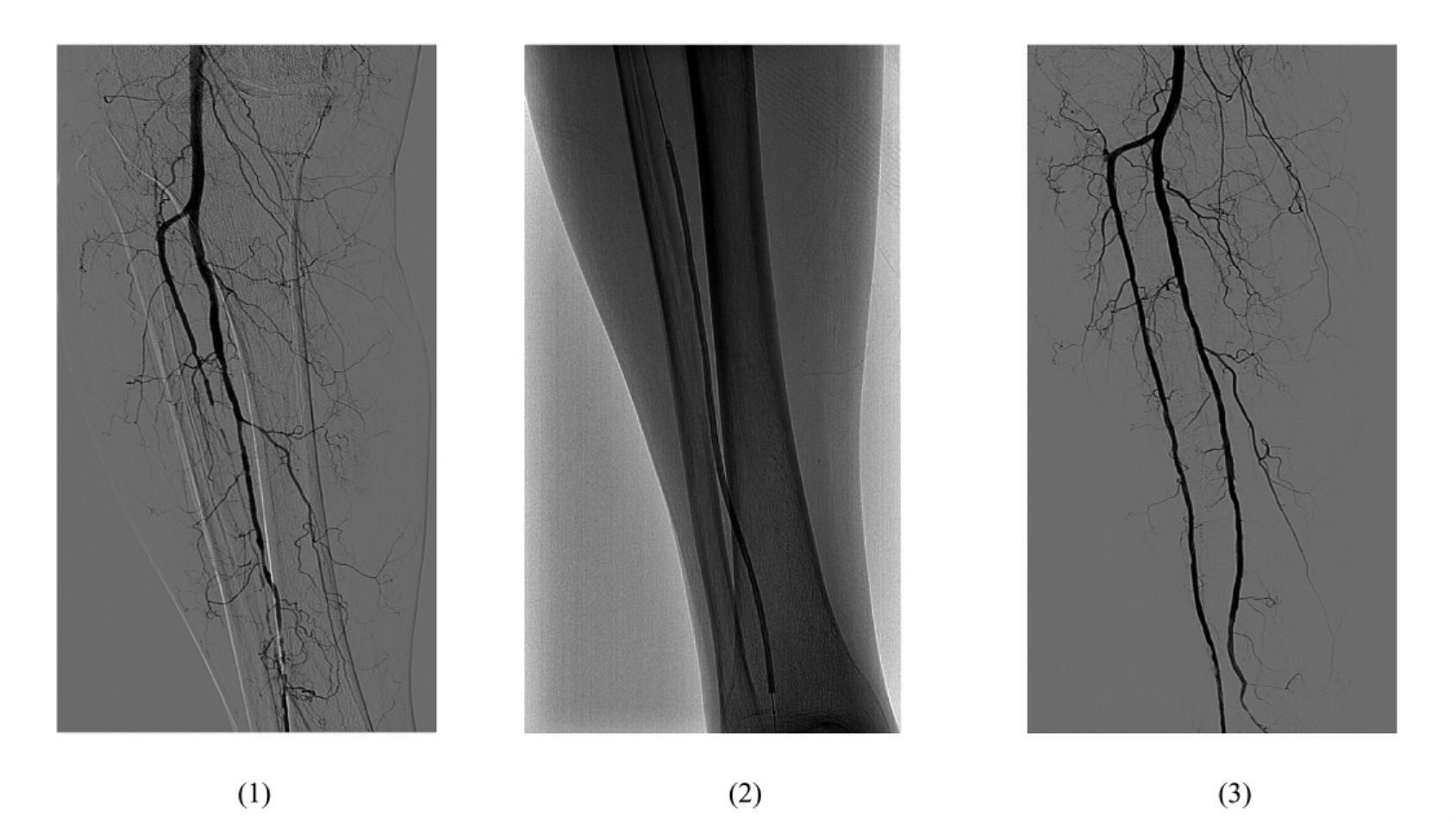
图11-2 球囊扩张术(二)
(1)DSA造影示右胫腓动脉远段闭塞,局部少量侧支形成 (2)导丝轻柔缓慢通过闭塞段,局部球囊成形 (3)局部球囊成形术后,造影显示胫腓动脉远段开通,血流通过顺利
球囊扩张和抽吸可用一次性手推注射器或机械性压力枪。一般建议用10ml注射器。注射器越小产生的压力越大,3~5ml注射器可产生21个以上的大气压,有造成球囊破裂的危险。用1∶1对比剂和生理盐水混合液,透视监视下扩充球囊,持续30秒以上,一般1~3分钟。球囊扩张病变血管时,病人通常能感觉到疼痛并能够耐受。根据临床经验,长球囊引起的疼痛比短球囊更重,因此对于短的残余狭窄最好采用短球囊。对于短段病变,球囊放置在病变中心扩张2~3次,基本能达到治疗目的。如果球囊扩张不充分,局限狭窄持续存在,可换高压球囊再一次扩张。长段血管闭塞或狭窄,可用8cm或10cm长球囊从穿刺部位以远病变血管开始扩张,并逐渐移行至整个病变血管段。对于比较坚硬的动脉狭窄,如透析动脉瘘管狭窄、PTA后再狭窄,需用特制的可以承受20个大气压以上的高压球囊,并用特制压力注射器或螺旋注射器扩张,球囊扩张需持续5分钟或更长时间。因为透析瘘管的病人PTA时疼痛严重,病人常难以耐受,可在皮下动脉周围进行局麻以减轻疼痛。球囊扩张时应在透视下监视球囊形状,当球囊扩张变形或呈现椭圆形时,提示球囊有发生破裂的危险,应立即减压和停止操作。
PTA后应复查血管造影观察病变血管再通情况,或有无残余狭窄和血栓存在。用注射器负压抽吸球囊,将球囊导管经导管鞘退出。PTA后导管鞘可保留6~12小时。因为PTA穿刺部位血管壁的损伤相对大和病人应用抗凝剂,穿刺点压迫时间比通常血管造影时间长。
四、PTA治疗机制
PTA技术使血管再通的治疗机制仍有许多争议。早期研究认为球囊挤压粥样硬化斑块使血管腔增大。动物实验和尸检研究证明球囊血管成形术可造成血管内皮脱落和粥样硬化斑块碎裂。病理研究也证明球囊血管成形术可引起血管内膜撕裂、粥样硬化斑块纵向和横向碎裂,并引起中层拉长或断裂及整个血管壁拉长,包括最外层的外膜,使血管管径增大。球囊血管成形术后在一定范围内可引起粥样硬化斑块再分布,显微镜下可以找不到粥样硬化斑块受挤压的证据。这些可能由于斑块受挤压后部分脱水,并将其液体成分释放到循环血液。切线位X线血管造影可以证实球囊扩张后碎裂粥样硬化斑块充满对比剂或充满对比剂的斑块与血管分离。PTA术后由于血管内膜受损,血管壁内结缔组织暴露于循环血液,结果引起血小板聚积和纤维蛋白附着血栓形成。因此,PTA后再通血管可形成急性血栓。血管损伤处的血小板聚集和血栓形成,与该区的血流速度成反比。因此为了防止急性血栓形成,PTA后应采取非闭塞性方法压迫穿刺点和给患者血管扩张药。术后3~6个月内每天口服150~300mg阿司匹林,同时每天服用75mg潘生丁抗血小板聚集效果更明显。PTA数周后血管造影可显示不规则血管壁变光滑。病理研究证明球囊血管成形术后血管内膜上皮增生,并由病变边缘向中心逐渐覆盖受损血管和碎裂斑块,数周后使受损的血管壁治愈和变光滑。
五、PTA并发症及其防治
1.穿刺部位出血和血肿 由于PTA术中肝素化和反复导管操作,可造成穿刺部位出血和血肿。根据病变血管管径尽可能选择较细的导管鞘和球囊导管。操作时尽量轻柔,避免暴力,减少局部血管损伤或出血。通常主张PTA后6~12小时再撤出导管鞘,穿刺点压迫时间比常规血管造影时间延长,如出现局部血肿可采用加强压迫,超声导向下压迫或超声导向下抽吸等,必要时外科手术干预。陈旧性血肿采用物理疗法,如热敷等促进血肿吸收。
2.动脉痉挛 由于导管或球囊刺激可引起局部动脉痉挛,这时应该停止操作,并经导管局部注入血管扩张药或麻醉剂解除血管痉挛,如普鲁卡因、罂粟碱等,也可静脉点滴或舌下含硝酸甘油。
3.血栓形成 PTA术中、术后可形成急性动脉或静脉血栓,主要原因是局部血管损伤、肝素化不完全和卧床或原发病变因素等。PTA患者术中和术后肝素化非常重要。当导管到达病变血管后,首先经导管团注5 000U肝素,再经静脉以1 000~2 000U/h缓慢滴注肝素盐水,完全肝素化的标准是患者部分凝血酶原时间超过正常值2~3倍。术后2~3天内继续以500~1 000U/h静脉滴注肝素盐水。患者可在术前开始口服150~300mg阿司匹林,一般服用至少3~6个月。
4.末端动脉栓塞 血管造影或PTA术中,粥样硬化斑块或血栓脱落可引起远端动脉栓塞。下肢动脉PTA致粥样硬化斑块或血栓脱落可以加重肢体远端缺血。对于急性血栓和末端动脉栓塞,可采用经导管血栓和栓子抽吸术或局部溶栓术。抽吸术应该用内径较大的导管或长导管鞘或特制的抽吸导管,首先将导管头插入到血栓或血栓栓子近端内,用20m l注射器抽吸,使注射器保持真空负压状态下,缓慢退导管,把血栓栓子物质抽吸到导管鞘内,再经导管鞘侧管抽吸和用导丝清除血栓栓子。局部溶栓术一般用溶栓导管(也称灌注导管或微导管)。首先将5~7F导管头插入到血栓栓子内,经动脉灌注泵灌注尿激酶。通常溶栓和栓子抽吸两种方法结合用疗效更佳。
5.动脉夹层、穿孔球囊扩张时间过长可引起内膜夹层,并形成动脉残余狭窄。轻度内膜夹层和狭窄不需要处理,通常不会造成患者的不良后果。但对于髂动脉夹层,残余狭窄超过30%和股动脉残余狭窄超过40%~50%,则需要内支架置入治疗。操作粗暴,用力不当,可造成动脉穿孔甚至破裂,为严重并发症,需要外科治疗。
