肺癌的CT诊断
第三节 肺癌的CT诊断
肺癌的CT表现主要根据肺癌的部位和大小而异。不同组织类型的肺癌其生物学行为各异,导致其影像学表现也有所不同。在大体病理形态上肺癌主要分为中央型肺癌和周围型肺癌。中央型肺癌发生在主支气管及叶、段支气管,占肺癌的60%~70%,多数为鳞状细胞癌、小细胞癌及典型类癌,部分腺癌(几乎均为低分化腺癌)也可为中央型,CT检查可表现为肺门肿块或支气管阻塞性改变等。周围型肺癌发生在肺段以下支气管,占肺癌的30%~40%,可见于各种类型的肺癌,但以腺癌最常见,CT扫描可清晰的显示原发肿瘤的形态、轮廓及边缘。此外,少数肺癌还可以为弥漫性,表现为肺内多发结节及斑片,在病理上主要为细支气管肺泡癌。
一、中央型肺癌的CT表现
(一)早期中心型肺癌
CT表现为:(1)支气管轻度狭窄。②气管壁增厚或腔内小结节。也可以出现支气管阻塞性改变,CT上表现为阻塞性肺炎或肺气肿。若有上述征象之一,应高度怀疑中央型肺癌,并行超薄扫描、靶扫描、增强扫描或其他影像学方法检查。山东省肿癌防治研究院于2009年采用薄层的动态靶扫,曾检出1例支气管腔内的原位癌,故采取合理的扫描方案,是检出早期中心型肺癌的关键。(图2-12-1)
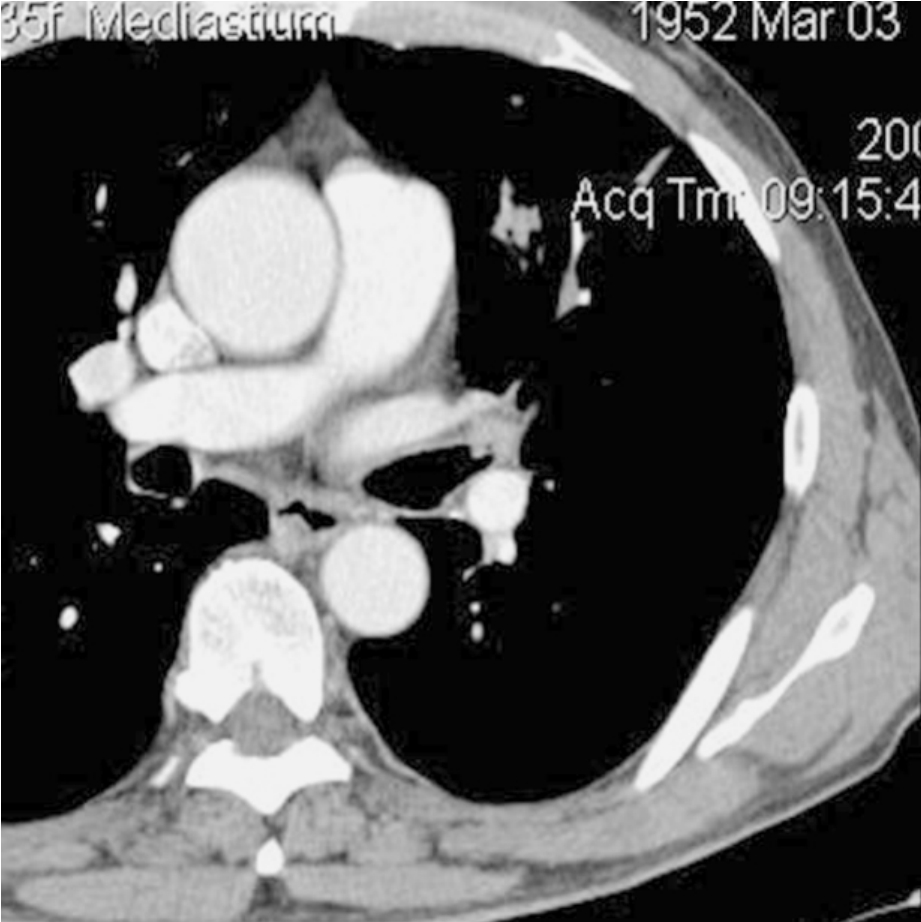
图2-12-1 左肺上叶中心型早期肺鳞癌。左肺上叶支气管腔内可见中等强化的软组织结节影,未突破支气管壁,其远端可见阻塞的斑片状影。手术证实为早期肺鳞癌
(二)中晚期中心型肺癌
1.直接征象支气管壁增厚,管腔狭窄或截断,以及肺门部软组织肿块。正常支气管管壁厚度均匀,1~3 mm,当肿瘤浸润时,在周围肺组织的衬托下可清楚显示壁的增厚,多不规则。根据肿瘤生长方式不同,向腔内生长者,表现为支气管腔内息肉样软组织肿块;沿支气管壁浸润者,引起支气管壁增厚、管腔狭窄或阻塞;肿瘤穿破支气管外膜向肺内生长者,则形成支气管周围肿块。一般进展期的肺癌可有上述两种或所有改变,表现为不规则的肺门部肿块,边缘大多毛糙、有时有分叶表现,肿块可为癌肿与转移性肺门或纵隔淋巴结融合而成。当引起肺不张时,肿块包埋于不张的肺组织内,表现为楔形不张的肺组织至肺门部突然增大,平扫CT上常难以分辨癌肿的确切边界。增强扫描时,一般肿块的增强程度较不张的肺组织低,从而显示出肿瘤范围(图2-12-2)。从支气管MPR图像上观察,狭窄或梗阻的支气管长度较局限,末端呈椎状、杯口状或鼠尾状。
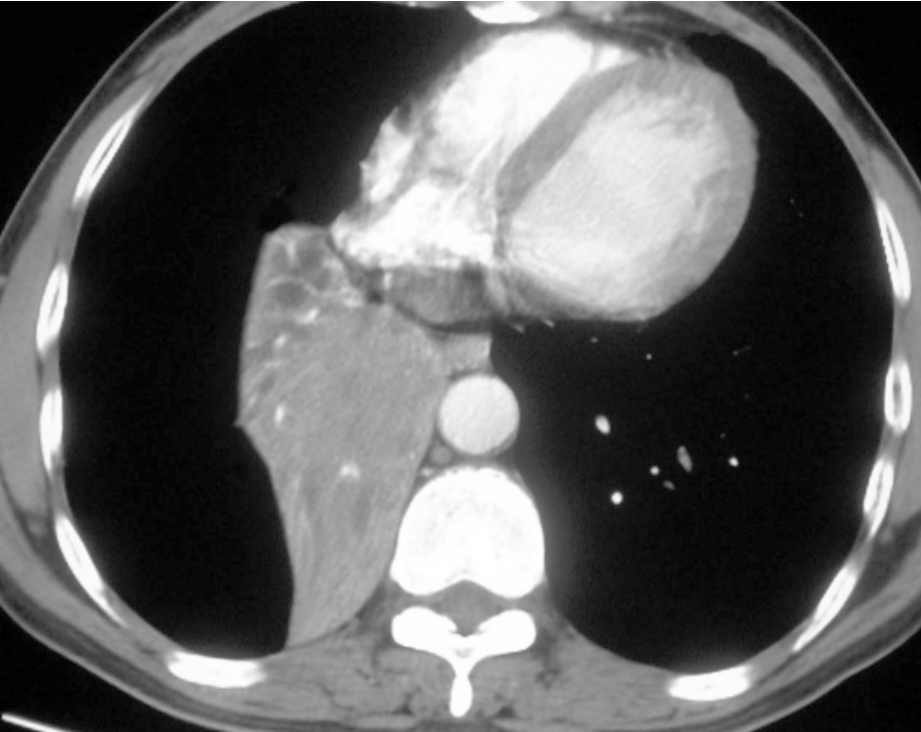
图2-12-2 右肺下叶中心型肺癌。增强后可清晰的分出肺门区肿块和远端不张的肺组织,在不张的肺组织内可见强化的血管影及低密度的黏液栓塞
2.间接征象支气管狭窄或梗阻后,由于不完全性活瓣梗阻,首先可出现肺气肿,表现为所属肺叶或肺段的过度通气,肺野透亮度增加,因持续时间较短,实际工作中并不常见。多数患者因支气管狭窄引流不畅而发生阻塞性肺炎,表现为相应部位按支气管走行分布的多发斑片状实变影及腺泡结节影。肿瘤进一步生长,使管腔完全梗阻,则引起所支配肺叶或肺段的阻塞性肺不张或肺实变,邻近肺叶代偿性膨胀,并可能引起纵隔向患侧移位。支气管梗阻后还可引起梗阻部位以下支气管黏液栓形成,同时伴有管腔柱状扩张,在增强CT上表现为实变或不张的肺组织内沿支气管走行的囊性低密度影,无强化,与伴随的明显增强的肺动脉形成“印戒征”。
二、周围型肺癌
周围型肺癌一直是临床和影像工作中的难点和重点。由于表现为肺内结节或肿块的病变种类繁多,影像学表现又有一定的重叠,所以常易发生误诊。其CT特点分述如下。
(一)病灶的大小
通常将肺内直径≤3 cm的局限性病灶界定为结节,而>3 cm者定义为肿块。病灶的大小对诊断有一定的参考价值,因为大多数肺癌就诊时已>3 cm,再加上病灶的轮廓和边缘特征,诊断相对比较容易。而良性病灶的直径一般<2 cm。病灶越大,其恶性可能就越大。Mayo Clinic的一项筛查研究发现了2 832个结节,其中89%的结节直径<7 mm。这些小结节只有1%是恶性的。另一项研究发现,没有1例直径<5 mm的结节是恶性的。所以,在肺癌的筛查中,直径<5 mm的结节一般按良性结节处理。国外某学者的322例直径>2 cm的孤立性病灶中,85%是恶性病变,尤其是年轻患者,直径<3 cm的更为少见。山东肿瘤防治研究院在1994~2008年手术的周围型肺癌患者中,年龄<30岁者,无1例直径>3 cm。所以,病灶越大,提示恶性的可能越大。
(二)肿瘤边缘征象
1.分叶征是周围型肺癌最常见的基本征象。301医院的100例直径<3 cm的小肺癌分叶征的发生率为84%。绝大多数小肺癌的深分叶,深分叶在周围型肺癌的诊断中具有较高的特异性。其病理基础主要是肿瘤边缘各部位肿瘤细胞的分化程度不一,生长速度因此不同,导致分叶;肺内固有的结构如血管和支气管对肿瘤生长的阻挡作用,也是引起分叶征的原因之一。在某些肺内良性病变中,有时也可见分叶,如错构瘤和结核球,但其分叶一般较浅,只有极少数可见深分叶,故分叶征是周围型肺癌的一个重要CT征象。边缘光整一般是良性病变的特点,如结核球等,但也可以见于某些恶性病变,如转移瘤、小细胞肺癌、典型类癌和肺肉瘤。所以,该征象必须结合其他征象综合分析(图2-12-3)。

图2-12-3 分叶征。右肺上叶后段分叶状软组织密度肿块,边缘显著分叶,外侧缘与胸膜之间可见线状影。同层的气管前间隙可见增大淋巴结,手术证实为转移。术后病理:中分化鳞癌
2.边缘毛刺厚度<2 mm者称为细毛刺,>2 mm者称为粗毛刺。典型肺癌的毛刺为短细毛刺,如毛刷状或日光放射样,细长毛刺也较为常见。肺癌毛刺的特点是接近结节端往往较远端略粗。形成毛刺的基础是肿瘤侵犯临近小叶间隔、瘤周肺实质纤维变或伴有炎细胞浸润所致。在一项研究表明,接近100%的小肺癌具有细小毛刺。良性病变也可有毛刺,但远较肺癌少见;炎性病变也可见毛刺,但其毛刺多表现为粗长毛刺(图2-12-4)。
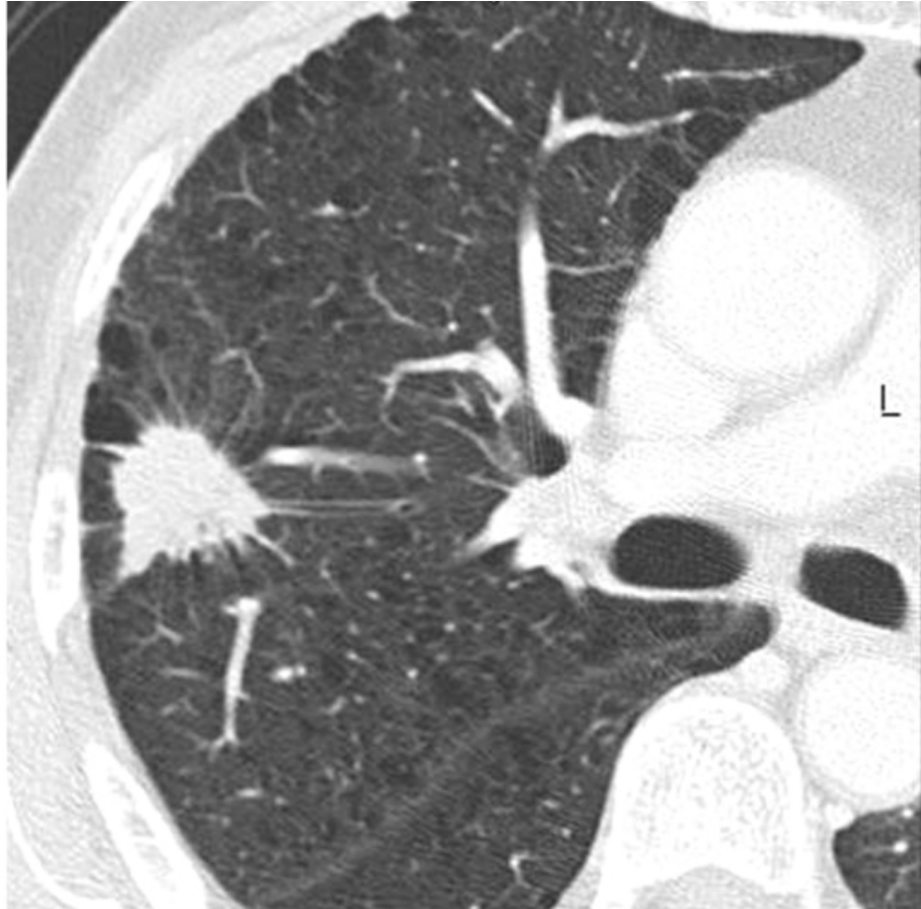
图2-12-4 毛刺征。右肺上叶中分化腺癌,边缘可见放射状短细毛刺
(三)肿瘤内部结构
1.空泡征指结节内小灶性透亮区,其直径<5 mm,>5 mm者称为空洞。可单发或多发,如多个小泡征聚集在一起呈蜂窝状则称为蜂窝征。其病理基础一是未被肿瘤组织侵犯的含气肺组织,二是未闭合或扩张的小支气管,三是乳头状癌结构间的含气腔隙,四是沿肺泡壁生长的癌组织未封闭肺泡腔或被破坏与扩大的肺泡腔。此征多见于肺泡癌与腺癌,也可见于鳞癌。有时结核球坏死后形成直径<5 mm的空洞也可有类似的影像学表现,在读片时应结合其他征象加以鉴别。
2.支气管充气征呈细条状,直径约1 mm的空气密度影,或呈小泡状的空气密度影,见于连续数个相邻层面,在病理上为扩张的小支气管。在肺癌中,主要见于肺泡癌和腺癌。该征象也可见于肺淋巴瘤和肺炎性病变,但以肺癌最为常见。薄层CT显示较好,常与空泡征同时存在(图2-12-5)。
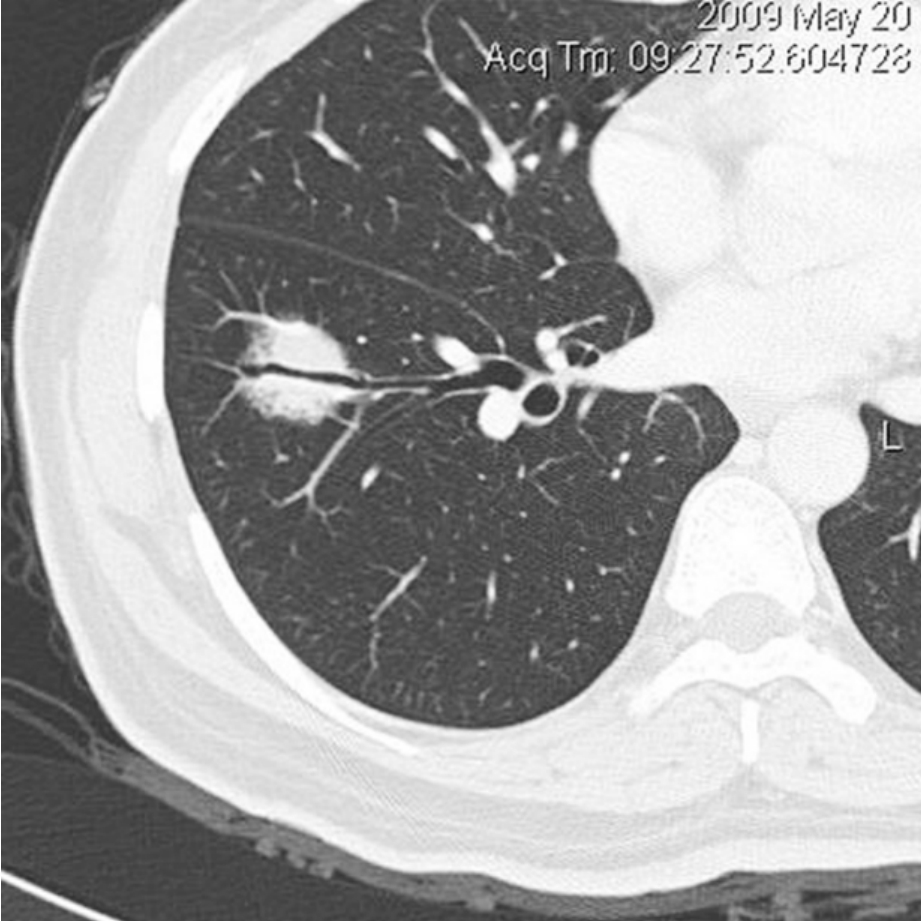
图2-12-5 支气管充气征。右肺下叶前基底段混合性磨玻璃密度影,其内可见含气的亚段支气管影。手术病理为高分化腺癌,含细支气管肺泡癌成分
3.蜂窝征由多个小泡聚集呈蜂窝状,其大小比较一致。此征象仅见于肺泡癌或含有肺泡癌成分的混合性腺癌。病理上为癌细胞沿肺泡壁生长,未封闭肺泡腔,腔内可遗留黏液致其扩张。
4.磨玻璃密度是指在CT上肺局部密度模糊地增加,在病变区内仍可见血管及支气管影的称为磨玻璃影,病灶的边界一般较为清晰。在CT上可分为纯磨玻璃影和部分伴有实性结节的混合性磨玻璃影。其病理基础是肿瘤细胞沿肺泡壁生长,肺泡壁增厚,但肺泡腔未封闭,内可有少量黏液或脱落的肿瘤组织,此征象多见于肺泡癌或含有肺泡癌成分的混合性腺癌。此征也可见于炎症性病变、局灶性肺纤维化和不典型腺瘤样增生。见到磨玻璃影应高度警惕为肺癌,抗感染治疗后不消退者半数以上为肺癌。当磨玻璃密度影中伴有实性结节时(常在病灶的中央),肺癌的可能性进一步增大,从病理上绝大多数为含肺泡癌成分的混合性腺癌。在含有磨玻璃密度影的肺癌中,实性成分组成部分与磨玻璃成分相比越多,其恶性程度越高,肿瘤侵袭性生长的可能性就越大,预后也就越差。Suzuki的资料显示,CT上为纯磨玻璃密度或实性成分直径<5 mm的肿瘤,在手术中均未发现淋巴结转移和血行转移,在其中位随访时间35个月时均存活,生存率为100%。Takashima等通过单因素分析发现,病灶直径<15 mm,磨玻璃密度影面积>50%的肺癌是好的预后因素,多因素分析则表明磨玻璃影是独立预后因素。Aoki的研究也发现,在CT表现磨玻璃影面积<50%者与>50%者相比,发生淋巴结转移和血管侵犯的机会明显增高,生存期明显缩短,完全为实性成分者预后更差。因此,磨玻璃影占肿瘤的比例,可用来判断肿瘤的恶性程度及预后(图2-12-6)。
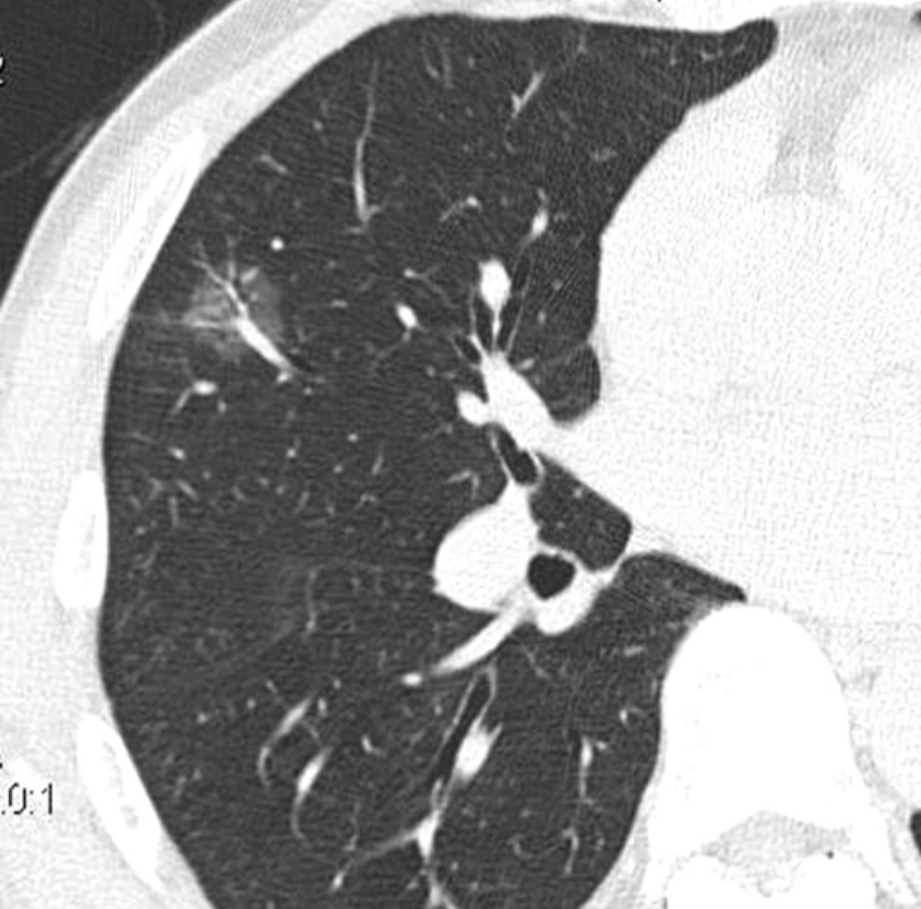
图2-12-6 磨玻璃密度影。右肺中叶见磨玻璃密度结节,边缘较清晰,不掩盖血管纹理。手术病理为细支气管肺泡癌
5.空洞为局限性病灶内直径>5 mm的类圆形含气低密度影。结核球较肺癌更易形成空洞。肺癌空洞形成的病理基础为肿瘤组织坏死液化后经支气管排除所致。在肺癌中,鳞癌是最易形成空洞的病理类型,其次为腺癌,少数大细胞癌也可形成空洞,但小细胞癌形成空洞者罕见。在我院近10年的手术病例中,未见到1例小细胞癌形成空洞。空洞的大小和形态等对肿瘤的良恶性有一定参考价值,其鉴别要点如下:①癌性空洞常见于较大的病灶,因为较小的肺癌坏死较为少见,故形成空洞的机会较小;炎性和结核性空洞常见于小病灶,但部分肺脓肿形成的空洞可较大,但根据其模糊的边缘二者并不难鉴别。②癌性空洞的内壁厚薄不均,内壁凹凸不平,壁结节较为常见;良性空洞的内壁一般较为光整。若见到肿块或结节的内壁非常光整,基本可除外癌性空洞,但少数结核性空洞的也可不光整,需要借助其他征象鉴别。③厚壁空洞常见于肺癌,薄壁空洞大多为良性。Woodring认为,测量空洞壁最厚的部分是鉴别良恶性空洞的可靠指征,壁厚为1 mm时,100%为良性;壁厚<4 mm时,92%~95%为良性;5~15 mm时,良恶性的可能性各半;而>15 mm时,84%~95%为恶性。④癌性空洞为中心性或偏心性,结核性空洞常位于近支气管侧。⑤癌性空洞一般见不到引流的支气管,即与支气管不相同。我们的56例空洞性肺癌中,无1例与引流的支气管相通。而结核或炎性肿块有时可见到引流的支气管影,由于其炎症的特点,常伴有引流支气管壁的增厚,这是炎性或结核性空洞一个较为特异的征象。故肺内空洞性病变,如果与支气管相通,基本可排除肺癌的诊断。⑥除了观察空洞的大小与形态外,空洞性病灶的形态对鉴别亦具有较大价值,空洞性肺癌的边缘常表现为分叶和毛刺等(图2-12-7)。
6.钙化文献报告HRCT上肺癌钙化的检出率可达15.8%。恶性钙化表现为细沙砾状、小结节状、分布弥漫或偏于一侧。中心性钙化、爆米花样钙化、同心圆形钙化常见于良性病灶,主要是结核性病变和错构瘤;肺癌钙化主要见于鳞癌和腺癌。其病理基础为:①营养不良性钙化,以鳞癌较常见。②肿瘤包裹以前就有的钙化,该类型的钙化几乎均为偏心性。③肿瘤分泌钙质,主要见于黏液腺癌。
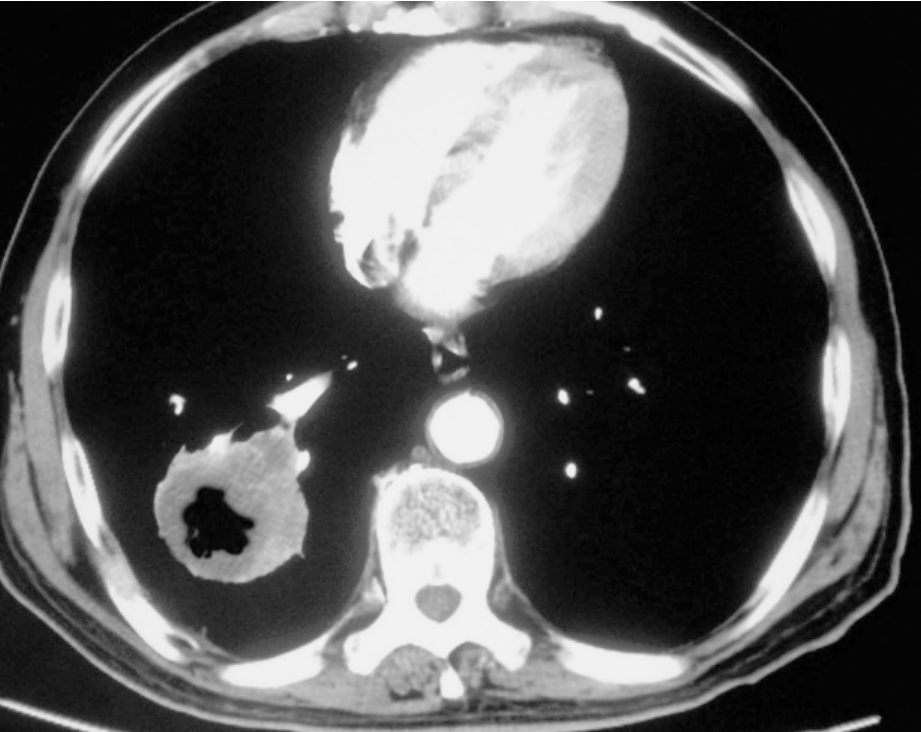
图2-12-7 癌性空洞。右肺下叶见一空洞性肿块影,洞壁较厚,且内壁凹凸不平。手术病理为鳞癌
(四)肿瘤周围的征象
1.血管集束征一般指周围的血管向病灶聚集。在CT上表现为血管在肿瘤边缘中断或贯穿肿瘤,动静脉均可累及。部分学者报道,肺静脉的受累对于良恶性的鉴别有重要意义。此征象在肺癌鉴别中的意义尚有争论,部分学者认为,肺内良性病变也可出现血管集束征。但笔者的经验认为关键在于对血管集束征的界定。我们认为,如果同时有3条或以上的血管达病灶处截断或与肿瘤相连的血管较为平直,呈牵拉样改变,则诊断肺癌极少错误;若将与病灶相连的任何血管均定义为血管集束征,只会降低其特异性。
2.胸膜凹陷征周围型肺癌尤其是周围型小肺癌的胸膜凹陷征的检出率较高,有学者报告小肺癌的胸膜凹陷征的检出率可达93%。该征象主要见于腺癌和细支气管肺泡癌。其病理基础一般认为系病灶内纤维瘢痕组织收缩所致,并通过瘤体临近纤维网架传递到脏层胸膜,将胸膜拉向瘤灶。既往的文献认为,凹入处与脏层胸膜间构成空隙,内为生理性液体填充。但我们在多层螺旋CT的薄层扫描中发现,若肿瘤的恶性程度较低且生长时间较长,凹入的间隙内常为脂肪密度,考虑为胸膜外脂肪沉积所致。该征象的出现,提示肿瘤的分化程度较高并已生长较长时间(图2-12-8)。
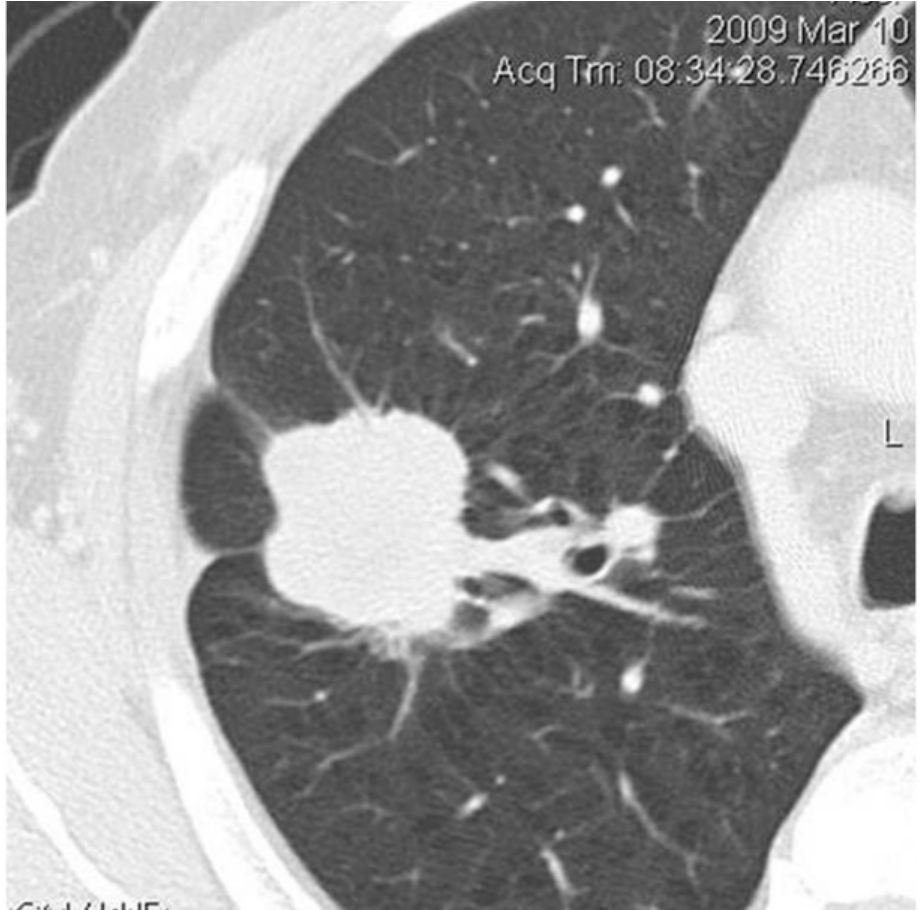
图2-12-8 胸膜凹陷征。右肺上叶中分化腺癌,其外侧缘显示典型的胸膜凹陷征
3.卫星灶从理论上说,肺腺癌可出现卫星灶,表现为肿瘤附近边缘清晰的小结节影,但在实际工作中很少遇到。卫星灶的出现,一般高度提示结核性病变。301医院的100例小肺癌中,无1例见到卫星灶。而另一组资料显示,结核伴有卫星灶者占83.3%。国外的一组资料表明,卫星灶对良性结节的阳性预测值在90%以上。
4.肿瘤胸膜侧模糊小片影出现率约为10%,为细支气管阻塞的征象。该征象的出现几率在周围型肺癌中虽然不是太高,但一旦出现,高度提示肺癌的诊断。
(五)肺癌的CT增强特征
肺内孤立性病灶的强化程度与结节内的微血管密度和对比剂进入细胞外液的多少有关,恶性病变强化明显高于良性结节。多数学者报道认为,增强扫描与平扫相比,以增加15~20 HU作为鉴别良恶性病变的阈值比较合适。国外一组多中心研究550个肺结节的结果显示,以15 HU为阈值,敏感性、特异性和准确性分别为98%、58%和77%。Swensen则通过对163例孤立性肺结节的增强扫描研究发现,具有诊断意义的强化界值为20 HU。其研究表明,利用这一界值,对恶性孤立性肺结节的诊断具有很好的敏感性(98%)和一定的特异性(73%)。我们在日常工作中采用20 HU的阈值鉴别良恶性,其诊断准确性在80%左右。这一理论在实际应用中价值最大的在于鉴别肺癌和结核球,而在实际工作中最难鉴别的也是这两种疾病。因为结核球从病理上讲是干酪坏死灶,因此增强后绝大多数是不强化的或边缘呈薄线样强化;而肺癌或多或少均有一定的血供,因此增强后常呈不同程度的强化。我们通过大宗病例的总结显示,造成该理论敏感性较低的因素是一部分以肺泡癌为主的混合性腺癌和黏液腺癌其微血管密度较为稀疏,其增强后CT增加值较低;而大部分的炎症和动静脉畸形、肺的硬化性血管瘤则可以显著强化,从而降低了其特异性。如果结合病灶的形态,同时运用20 HU的诊断阈值,则正确性更高。
在增强方式上,直径<3 cm的肺癌在增强早期强化均匀或不均匀,延迟扫描大多呈均匀性强化。当然,较大的肺癌由于其中心可发生,也可表现为环形强化,但其强化的环常常厚薄不均。结核球一般是不强化的。而炎性病变,常常表现为显著强化或环形强化,较小的病灶内即可出现不强化的坏死灶。
恶性肿瘤和良性病变强化的时间密度曲线也不一样。肺癌的曲线上升较快,达到峰值后曲线维持在高值。炎性肿块的曲线上升速率快且峰值高,达到峰值后曲线稍有下降,然后再有所提高,呈“双峰样”。良性肿块的时间密度曲线低平或几乎无升高。
(六)肺癌的倍增时间
倍增时间是指病变体积增加1倍的时间。倍增时间介于30~490 d通常为肺癌。而<30 d和>490 d者常考虑为良性病变。偶尔有肺癌在2年或更长时间内保持不变或缓慢增大,在病理上大多为肺泡癌或腺癌。但是对这些病变诊断的延误,对于大多数病例常没有太大的临床影响。需要明确的概念是,直径增加1倍体积即增加8倍,因此,病变的直径增加25%其体积即增加1倍。对于较小的病灶,增加25%在肉眼上是很难鉴别的,如病变的直径自5 mm增加至6.25 mm,其体积即增加1倍,这种差别很难在肉眼上区分出来。而多层螺旋CT的三维体积重建(3D)测量更易于精确对比结节大小的变化,而且不受呼吸运动和扫描层面的影响。目前,在16层及以上的高端CT扫描机上均有类似的结节体积测量软件推出,结节体积较容易获得。
三、弥漫性肺癌的CT诊断
弥漫型肺癌常指细支气管肺泡癌中的炎症型和弥漫型结节型两种亚型。肺炎型对应的病理类型常为黏液性或混合性细支气管肺泡癌。在CT上常呈大片肺炎样实变影,可按肺叶或肺段分布,可累及多个叶、段,密度增高且均匀一致,易与炎症混淆。病灶内可见空气支气管征、磨玻璃影、支气管枯树枝征、小叶间隔增厚(铺路石征)、叶间胸膜膨出等表现。由于癌细胞分泌多量黏液,实变区病变密度较低,可见到其中高密度的血管影,称为“血管造影征”,为其重要特征。大叶性肺癌和阻塞性肺炎内虽然有时也可见到强化的血管影,但由于实变的肺组织同时强化,故其内血管的强化与实变肺的CT值差异往往不如肺泡癌显著,二者可以此鉴别。另外,在实变型肺泡癌周围或对侧肺常可合并一些小斑片状影或腺泡样结节影的存在,这也是一个重要的佐证;这种征象较少见于大叶性肺炎。当然,在诊断过程中需要密切的结合有无发热等临床症状,而咳大量的白色泡沫样痰或水样痰则是弥漫性肺泡癌的特点,因为其在病理上为黏液型,常有大量的黏液分泌。如果实在鉴别困难,抗炎治疗后复查CT也是一个切实可行的鉴别方法。弥漫型结节型表现为双肺多发结节,大小不一,边缘模糊,以两肺中、下叶分布为主,部分结节有融合、实变趋势。部分病灶内可有小空洞或小囊状影出现,在诊断上具有一定的特异性,其成因可能与终末细支气管的活瓣阻塞有关。总之,弥漫型肺癌CT表现多样,诊断比较困难,必要时应辅助CT导引经皮肺活检或痰捡(图2-12-9)。
四、肺癌侵犯肺动脉、肺静脉干的影像表现
通过对肺癌侵犯中央肺动、静脉CT征象及其病理相关性研究,对肺癌侵犯肺血管的CT表现及其病理解剖基础获得了初步的了解和认识。肺癌侵犯中、小肺动脉的病理表现主要为:①癌肿浸润管壁;②管壁肉芽、结缔组织增生。肺癌侵犯中央肺动脉的病理解剖表现为:①癌肿的侵犯以外膜及中膜为主;②管壁炎性浸润、水肿或肉芽及结缔组织增生突出;③癌肿较少突破内膜面。肺癌侵犯肺静脉干的病理解剖表现为:①癌肿易于浸润管壁全层,形成腔内癌栓或混合血栓;②肺静脉干管壁的纤维结缔组织增生不明显。在观察及判断肺癌侵犯肺血管的CT征象时,应该注意:①癌肿的位置;②癌肿与肺血管的关系;③周围肺血管的表现;④周围肺野的表现;⑤心脏及邻近纵隔大血管的表现;⑥癌肿侵犯肺血管的途径。
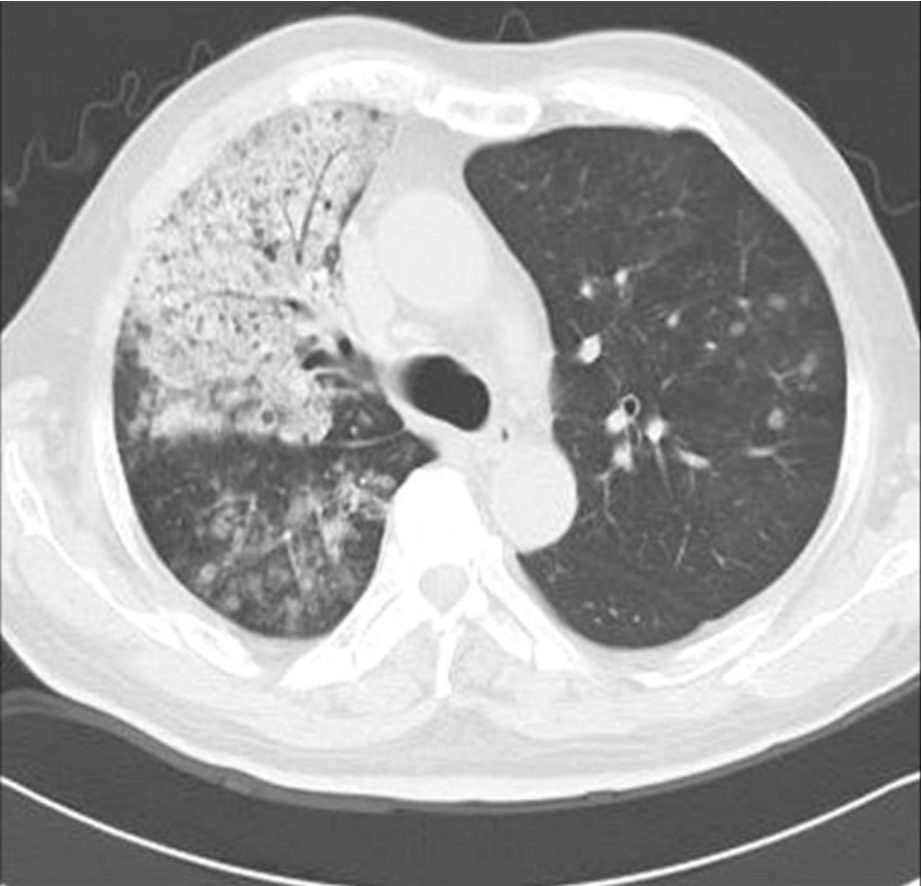
图2-12-9 弥漫性细支气管肺泡癌。右肺上叶见磨玻璃密度影,其内可见支气管充气征。注意
(一)肺癌侵犯中央肺动脉的CT征象
1.管周脂肪异常征象在CT上出现血管周围脂肪层的模糊或中断,即管周脂肪征阳性,对肺癌侵犯中央肺血管的确定有重要的意义。
2.肺动脉异常征象①肿块相贴:在CT上肿块与管壁之间即可呈等密度,二者不可区分。但表现为肿块与管壁相贴的病变,并不一定是癌肿浸润,有时可是手术可分离的粘连。②肿块包埋、管腔狭窄:表现为肿块包埋及管腔狭窄明显,血管的腔面可能凹凸不平,但仍然较光滑。③压迫及位移:癌肿压迫中央肺动脉并使之位移,常发生于左侧。
3.继发征象相应的肺实质可能出现低肺血流灌注,CT像表现为肺野透明度增加,肺血管分支变细、稀疏。
(二)肺癌侵犯肺静脉干的CT征象
1.管周脂肪征象表现为管周脂肪的模糊或中断。
2.肺静脉干征象①肿块相贴:CT表现为一侧管壁与肿块融合呈等密度,增强CT图像管腔未见确切狭窄及变形。②肿块包埋:在增强图像上,可以显示不规则狭窄或闭塞的管腔。③癌栓:癌检的CT取决于癌栓的大小,较小的癌栓不易显示,较大的癌栓表现为腔内的低密度充盈缺损区。
3.继发征象肺癌侵犯肺静脉干后,其相应肺野内以肺淤血、间质或实质性肺水肿的表现为突出。
(三)肺癌侵犯周围肺血管的CT表现
在CT像上表现为肿块外周肺动脉分支的变细、僵直、短缩。较局限的肺野透明度增大。在HRCT像上,可见胸膜下终末小肺动脉与胸膜面的距离增大,管径变细。肺癌侵及周围肺静脉时,肿块与其相应胸膜面间常常可见一支或多支增粗的静脉,其管径甚至可超过同级肺动脉。
在肺癌的诊断及鉴别诊断中,肺血管征象可能成为最具价值的征象。当前对肺癌侵犯肺血管的影像学表现及其基础认识仍然是不足的,应该重视并深入探索,提高认识水平,制订统一的影像学诊断及分期标准。
五、肺癌胸部转移的影像表现
(一)胸内淋巴结转移
CT能够对肺癌患者淋巴结状态提供有效的信息。在进行肺癌根治性切除以前,发现和确定纵隔淋巴结增大的位置,对于治疗手段的选择如能否手术切除等具有重要的临床意义。为了准确的确定有无肺门及纵隔增大淋巴结,应常规进行增强扫描。对于肺门及纵隔淋巴结肿大目前尚无统一标准。一般认为,测量淋巴结的短径比测量长径更具有临床意义,常将肺门及纵隔淋巴结短径>10 mm视为淋巴结肿大;也有部分学者将肺门淋巴结的上限定为10 mm,而纵隔定为15 mm。目前,虽然公认CT检出肺门及纵隔淋巴结转移明显优于胸部X线片,但CT的总体准确性并不甚理想。Fraser的一组资料显示,CT诊断纵隔淋巴结的敏感性较高,约85%,而特异性偏低,为69%~84%。
1.淋巴结的大小一般以短径1.0 cm作为纵隔淋巴结异常的标准,但仅根据淋巴结的大小作为分期的标准并不可靠。对于肺癌患者,短径>1.0 cm的淋巴结并不意味着发生了转移,约有20%的假阳性。而部分转移的淋巴结,直径却可<1.0 cm。目前倾向于不同的部位采取不同的短径作为转移的标准,AJCC及UICC的标准为2区淋巴结短径的上限为7 mm,4、5区为9 mm,6、8区为8 mm,而7区则为12 mm,因为隆突下正常的淋巴结常较其他部位的淋巴结大。
2.淋巴结的密度中心坏死的淋巴结,如果排除了感染性因素,即使其短径在正常范围内,也应诊断为转移,在病理上为肿瘤的变性坏死,常见于鳞癌。有时还应与原发肿瘤的CT值增强程度进行比较,当肿大的淋巴结与原发肿瘤的CT值相似时,提示淋巴结有肿瘤转移。例如,产生大量黏液的腺癌,其转移淋巴结往往密度较低,且与原发灶一致。而淋巴结中心或一侧的脂肪样密度,则是良性淋巴结的可靠依据。一旦淋巴结内出现脂肪密度,即使其短径高于正常值,也可排除转移。最新的研究表明,淋巴结转移后,常表现为淋巴结门的消失,并导致淋巴结门正常的脂肪密度消失。所以,CT上淋巴结内含有脂肪密度,表明其淋巴结门并未受累,提示其转移的可能性极低。
(二)癌性淋巴管炎(淋巴管转移)
也称作淋巴结癌病(pulmonary lymphangitic carcinomatosis,PLC)。肿瘤细胞经淋巴管转移并在肺淋巴管内弥漫性生长者,称为PLC。以往认为较少发生,但近年来随着高分辨率CT和多层螺旋CT的应用,其在肺癌患者中的检出率越来越高,但目前尚未引起临床医生的足够重视。国外有文献报告,确诊为PLC的病例其生存期为10~30个月,平均为13个月,5年生存率极低。对于肺癌所致的PLC,一旦确诊,一般无手术指征,常以化疗为主。对于同样分期的肺癌,出现PLC者,其生存期显著低于无PLC者,故PLC为影响肺癌患者生存期的重要因素之一。但目前包括UICC的TNM分期标准,尚未把癌性淋巴管炎考虑在内,需要在以后不断补充和完善。
肺癌是最易发生癌性淋巴管转移的恶性肿瘤,其发生常为单侧,而原发灶位于肺外的肿瘤常为双肺同时发生。肺癌PLC的病理基础为:一为逆行性,指肺癌段、叶旁或肺门淋巴结及纵隔淋巴结转移,使局部淋巴回流受阻,远端淋巴管扩张,继而肿瘤细胞脱落,并沿淋巴管逆行生长,甚至达周边肺组织的淋巴管起始部位;二为顺行性,肺癌首先通过血行转移在肺内形成小的肺转移灶,随后侵犯肺间质和淋巴管,肿瘤细胞在肺间质和淋巴管内生长,形成PLC,一般不伴有肺门淋巴结肿大的PLC多为此型。
癌性淋巴管炎的CT或HRCT表现为:①光滑或结节状的小叶间隔增厚,有时可完整勾画出肺小叶的六边形结构,广泛者可呈网格状改变。因为小淋巴管从解剖上位于小叶间隔内,所以小叶间隔的增厚是其最主要的影像学表现。增厚的小叶间隔可以较为光整,类似间质性肺水肿的影像学表现,也可以不光整,在增厚的小叶间隔内出现小结节灶,其病理基础为在淋巴结内生长的肿瘤组织团。后者是本病的特异性征象。②支气管血管束增粗,有时可呈套袖征,其病理基础为支气管及血管周围的肺间质受累。支气管血管束的增粗与对侧正常的支气管及血管比较时更易诊断。③光滑或结节状的叶间裂增厚。④胸腔积液,但与胸膜转移引起的胸水不易区分。PLC需要与肺间质纤维化鉴别,最主要的一点为PLC常无肺小叶大小和体积的扭曲,而后者则常常出现。总之,对肺癌的癌性淋巴管转移诊断的关键是提高对PLC的认识,必要时应行薄层CT或HRCT扫描,一般不难诊断。
(三)纵隔大血管受侵(https://www.daowen.com)
螺旋CT已成为诊断肺癌侵犯大血管的常规方法。轴位的薄层影像及多平面成像(MPR)可较准确的评价血管受侵,并可判断在肺门区肿瘤与血管的三维关系。使用表面重组技术的三维血管成像取代了肺动脉的导管血管造影,但不能显示血管外的情况。有的研究表明,大血管受损的征象为肿瘤引起的压迫变形。在主动脉受侵的敏感性、特异性和准确性方面,CT分别为100%、43%、65%。对于上腔静脉受侵的显示,CT分别为90%、67%、77%。
(四)胸膜、胸壁受侵
肺癌的广泛胸膜转移引起胸腔积液,发现胸膜强化结节是胸膜受累的可靠依据。周围型肺癌可直接侵及临近的胸膜,并进一步侵及胸壁。但CT往往很难区分脏层胸膜受侵或是仅仅贴邻。肺癌侵犯临近的胸膜时肿瘤与胸壁的交角为钝角。CT判断肺癌侵犯胸壁的准确性较低,敏感性为38%~87%,特异性为40%~90%。根据三维成像诊断胸壁受侵优于轴位像。MR对肺癌侵犯胸壁的诊断优于CT检查。MRI可清楚显示胸壁肿瘤及骨骼、脂肪和肌肉等结构,其中对于肋骨侵犯的诊断,MRI易显示骨髓转移,表现为骨髓信号的异常减低,但对于骨皮质破坏MRI诊断有限度,主要靠CT检查。
六、肺癌TNM分期的CT表现
TNM分期对肺癌治疗方法的选择及预后判断具有重要临床意义。CT是目前最为常用的肺癌TNM分期影像学手段之一。
(一)T分期
CT对肺癌的T分期可提供有价值的诊断信息,文献报道T分期的准确性为56%~89%。一般而言,CT不能检出T0期的病灶,对于T1及T2期病灶,CT的T分期结果令人满意,特别是薄层CT图像。需要强调的是,对于肿瘤直径的测量,有时需要结合MPR图像,以便更为准确的测量肿瘤的直径。但是外科医生更为关心的是对T3和T4病变的区分,因为这将直接影响患者能否手术。纵隔胸膜、心包或其他重要结构的局部侵犯(T3)并不排除根治性切除的可能性。如果肿瘤广泛累及纵隔结构,如大血管、气管或隆突、食管或心脏,那么肿瘤被划分为不可切除的肿瘤(T4或Ⅲb期)。因此,影像医生的一个很重要的任务就是根据CT的表现判断病变是否应归属于T4期。既往文献报道,CT对T3及T4期病变的分期的准确性较低。但近年来随着多层螺旋CT的应用,特别是MPR和CTA(CT动脉造影)的应用,其准确性不断提高,有文献报道,其分期的准确性由既往的76%提高至92%。但CT对肺上沟癌及肿瘤侵犯胸壁的评估不如MRI准确,因为MRI对软组织的观察优于CT。
(二)N分期
CT检出纵隔淋巴结转移显著优于胸片已得到公认。CT的敏感性较高,大于85%,而特异性偏低,为69%~84%。N1期的淋巴结在增强CT图像上可清晰显示,但这并不是影像科医生的主要任务,因为肺癌手术时要常规清除肺门淋巴结(N1)。所以,影像科医生的N分期任务主要是对N2和N3期病变的界定。
目前,AJCC/UICC将肺内及纵隔的淋巴结划为14个分区,目前已广泛应用于影像及临床诊断中。现在CT图像上首先界定5条假想的水平线,分别与下列器官结构相切:第一线:头臂静脉弓上缘;第二线:主动脉弓上缘;第三线:右上叶支气管上缘;第四线:左上叶支气管上缘;第五线:隆突角。根据上述5线进一步划分纵隔各区淋巴结(图2-12-10,11):1区:最上纵隔淋巴结。位于第一线以上,肺尖水平以下。2区:上段气管支气管淋巴结(左侧为2L,右侧为2R)。位于第1、2线之间的气管两侧。3区:血管前(3A)及气管后(3P)淋巴结。位于第1、2线之间。中线处的淋巴结归属同侧。4区:下段气管旁淋巴结。4R区在第2、3线之间中线偏右,包括奇静脉淋巴结;4L区在第2、4线之间左侧。5区:主肺动脉窗区淋巴结。位于动脉韧带、主动脉、左肺动脉外侧、左肺动脉第1分支的近端。6区:主动脉淋巴结。在第2线以下,升主动脉、主动脉弓或无名动脉前方的淋巴结。7区:隆突下淋巴结。自隆突角向下2 cm范围内的淋巴结,但与下叶支气管或动脉无关。8区:食管旁淋巴结。食管两旁的淋巴结,距隆突2 cm以下的淋巴结。9区:肺韧带淋巴结。包括下肺静脉后壁及下方的淋巴结。10区:肺门淋巴结。位于近端肺叶的淋巴结。11区:叶间淋巴结。位于支气管之间,毗邻近端叶支气管。12区:叶内淋巴结,毗邻远端叶支气管。13区:段淋巴结,毗邻段支气管。14区:亚段淋巴结,位于肺实质内,毗邻亚段支气管。

图2-12-10 纵隔淋巴结分区示意图1
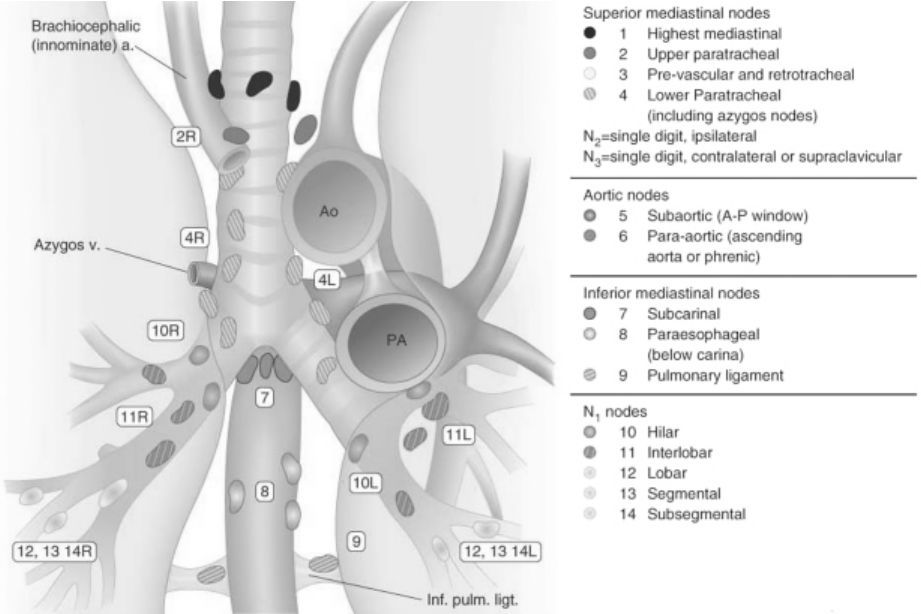
图2-12-11 纵隔淋巴结分区示意图2
对于正常与转移淋巴结的界定,前面已经叙述,在此不再赘言。对于出现同侧淋巴结转移的患者(N2),常提示预后较差和不可治愈疾病,仅有少数N2病例通过手术可延长生存期。出现对侧纵隔淋巴结转移者归属N3,则是手术的禁忌证,通过手术不能延长N3期患者的生存期。影像科医生除了需要明确N2或N3之外,还必须在诊断中提示淋巴结是否有包膜外侵犯,尤其对N2期病例,一旦出现,往往提示手术并不能改善其预后。因为肺癌患者淋巴结转移一旦侵出包膜外,往往提示是不可治愈的疾病,且放化疗后复发的几率远远高于无包膜外侵犯者。侵出包膜外的CT表现为,淋巴结边缘毛糙或模糊,周围脂肪间隙密度增高,并可累及周围结构,如上腔静脉、肺动脉等;或者表现为淋巴结的相互融合。淋巴结的包膜外侵犯强烈提示肿瘤已播散至其他淋巴结或进入血液循环。
(三)M分期
M1指远处转移。肺癌患者出现同一个肺叶的转移划归T4,但若出现同侧肺不同叶或对侧肺的转移则属M1。CT对检出胸内的转移具有很好的准确性,尤是薄层CT扫描,可检出肺内微小的转移灶,但有时需要和肺内陈旧性的纤维灶相鉴别。
胸外转移最常见的部位是肝脏、肾上腺、骨骼和脑。发现胸外转移最常用的方法为超声、CT、MRI、骨扫描,近年来PET-CT也较为常用,但昂贵的价格对其应用有一定限制,目前还不能作为常规使用的检查方法。
1.肝脏应常规进行增强扫描,平扫CT并不能鉴别肝内的病灶为良性或恶性,还常遗漏病变,患者有过敏体质者应选用MRI扫描。典型肺癌的肝转移表现为肝内低密度结节或肿块,边缘欠清晰,可有周边强化或低密度。
2.肾上腺肾上腺是肺癌最常见的转移部位,在国外通常的做法是行胸部CT扫描时向下延续包括肾上腺,但在现行国内的医疗体制下,会增加医疗费用。肺癌患者发现肾上腺结节或肿块必须与腺瘤鉴别。国外报道,肺癌患者发现肾上腺结节,无功能腺瘤的几率与转移瘤的几率相近。国内也有文献报道,肺癌患者发现肾上腺结节或肿块,约1/3为无功能腺瘤。肿物直径较小(<3 cm)、圆形或椭圆形、边缘清晰、由于富含脂质成分而呈相对均匀的低密度(<20 HU)、没有周边强化且呈廓清迅速,提示为腺瘤。直径>3 cm,尤其是密度不均匀、有厚壁的肿物,增强后廓清延迟,大多提示为转移瘤。
3.脑常规应行增强CT扫描,平扫可遗漏部分转移灶。MRI检出脑转移的准确性高于CT。增强CT表现为脑实质内环形强化灶或显著均匀性强化灶,病灶周围常见不规则低密度水肿带。
4.骨转移骨核素扫描常规应用于肺癌骨转移的筛查,但不能作为确诊依据。临床的确诊依据必须为平片、CT或MRI证实是转移。CT对骨转移的检出具有一定的敏感性和较高的特异性。
七、肺癌的鉴别诊断
肺癌常与某些肺部疾病共存,或其影像学形态表现与某些疾病相类似,故常易误诊或漏诊,必须及时进行鉴别,以利早期诊断。
(一)肺结核
1.肺结核球可见于年轻患者,多无症状,常位于结核好发部位(上叶后段和下叶背段)。病灶边界清楚,无分叶或仅浅分叶,可有包膜,内容密度高,有时含有钙化点,周围有纤维结核灶,在随访观察中多无明显改变。如有空洞形成,多为中心性空洞或位于近端,洞壁规则、较薄,直径很少超过3 cm。结核性空洞常伴有引流的支气管,而空洞型肺癌则很少出现。增强扫描对于鉴别二者价值巨大,结核球增强后不强化或仅包膜线样强化,而肺癌的CT增加值常在15~20 HU以上。
2.肺门淋巴结结核易与中央型肺癌相混淆,应加以鉴别。肺门淋巴结结核多见于儿童或老年,多有发热等结核中毒症状,结核真菌试验多呈强阳性,抗结核药物治疗有效。中央型肺癌其特殊的X线征象,可通过体层摄片、CT、MRI和纤支镜检查等加以鉴别。
3.急性粟粒性肺结核应与弥漫性肺泡癌相鉴别。粟粒性肺结核发病年龄相对较轻,有发热等全身中毒症状。CT上病灶为大小一致,分布均匀,密度较淡的粟粒结节。而肺泡癌两肺多有大小不等的结节状播散病灶,边界清楚、密度较深、进行性发展和扩大,且有进行性呼吸困难。根据临床、实验室等资料进行综合判断可以鉴别。
4.结核性胸膜炎胸膜腔积液与癌性胸水鉴别
结核性胸膜炎所产生的胸水,常见粘连包裹,胸膜呈一致性增厚,斜裂、水平裂等叶间裂常同时增厚,无肋骨破坏。癌性胸水,多为肿瘤侵犯胸膜或胸壁所致,胸膜常厚薄不均,多见结节,若侵犯胸壁常见肋骨破坏或胸壁软组织肿块。同时有时伴有纵隔胸膜不规则增厚或心包不规则增厚,同侧肺门及纵隔常见淋巴结肿大。
(二)错构瘤
典型的错构瘤内有脂肪及钙化,典型者呈爆米花样,肿瘤边缘光滑锐利多有浅分叶或无分叶。个别病例既无钙化,也无脂肪密度,而且分叶较深,此时易误诊为肺癌。但错构瘤偶尔分叶可较深外,一般缺乏其他恶性肿瘤特点,如毛刺、支气管充气征、小空洞、胸膜凹陷征等,也无肺门与纵隔淋巴结肿大等征象。增强扫描强化不明显,CT增加值多<20 HU。
(三)肺硬化性血管瘤
多数表现为肺内类圆形孤立性肿块(SPN),肿瘤轮廓清晰、边缘光滑、锐利,可有浅分叶和小钙化。肿块多数位于肺边缘近胸膜下。CT平扫密度多较均匀,偶见钙化和空气半月征。空气新月征是肺硬化性血管瘤较为特征的表现,但此特征不常见。CT薄层强扫见瘤体内有界限清晰的高密度与低密度之分,而且增强扫描高密度区强化扫描明显。低密度区基本不增强,此表现较为特征;另外,肿块强化明显而且出现混杂密度,也考虑到肺硬化性血管瘤的可能。诊断不清时经皮肺穿刺可酌情使用。
(四)球形肺炎
是一组肺内瘤样增生的病变,大部分由慢性感染引起。表现为胸痛;形成边界不清、欠规则的肿块,病灶较大,多位于下肺野,边缘多模糊,周围血管纹理增多、增粗,邻近胸膜反应较广泛;病灶中央CT值较低,多在20~25 HU;临床上常有近期感冒发烧史,白细胞增高,经短期(7~10 d)抗感染后病灶多有缩小。增强后其CT值一般较肺癌高,呈显著强化。
(五)支气管囊肿
含液支气管囊肿发生在肺内,可呈孤立性结节性阴影,CT表现为边缘清楚的肿块,密度均匀,CT值在0~20 HU;但当囊肿内蛋白成分丰富时,CT值可达20 HU以上,增强扫描无强化表现。有时病变内有空气进入,可形成空泡状气体密度影,需与细支气管肺泡癌鉴别。
(六)肺炎
应与癌性阻塞性肺炎相鉴别。肺炎起病急骤,先有寒战、高热等毒血症状,然后出现呼吸道症状,抗菌药物治疗多有效,病灶吸收迅速而完全。而癌性阻塞性肺炎炎症吸收较缓慢,或炎症吸收后出现块状阴影,且多为中央型肺癌表现,纤支镜检查、细胞学检查等有助于鉴别。
(七)肺脓肿
应与癌性空洞继发感染相鉴别。原发性肺脓肿起病急,中毒症状明显,常有寒战、高热、咳嗽、咳大量脓臭痰,周围血象白细胞总数和中性粒细胞分类计数增高。CT上空洞壁薄,内有液平,周围有炎症改变。癌性空洞常先有咳嗽、咯血等肿瘤症状,然后出现咳脓痰、发热等继发感染的症状。胸片可见癌肿块影有偏心空洞,壁厚,内壁凹凸不平。结合纤支镜检查和痰脱落细胞检查可以鉴别。
(八)肺动静脉瘘(动静脉畸形)
影像片示肿块影,边缘光整,常见供血动脉和引流静脉。增强动态CT检查有助于鉴别血管与非血管的疾病。
(九)结节病
结节病初次诊断时,误诊为肺癌的几率较高,常误诊为中心型肺癌伴广泛淋巴结转移。典型的结节病表现为双侧肺门及纵隔对称性淋巴结肿大,其增大的淋巴结往往不融合,且短径常<2 cm,其增大淋巴结分布较为广泛,和肺癌具有一定的淋巴引流途径不同。仔细观察,发现其肺门区无边缘分叶及毛刺的肿块及结节,各叶、段支气管均显示通畅。若累及肺可表现为肺内多发粟粒样小结节,结节分布多呈淋巴管周围分布,即沿支气管血管束、小叶间隔、胸膜和叶间裂分布。部分不典型肺结节可表现为边缘光整的肺内结节,和肺转移瘤不易区分。50岁以上的患者影像表现可不典型,表现为单侧的肺门和纵隔淋巴结肿大,诊断较为困难。诊断时必须密切结合临床症状,结节病往往影像学表现较为严重,但临床症状却较为轻微,最常见的为咳嗽及发热,临床与影像的不一致性可提示诊断。另外,其常常累及皮肤形成典型的结节性红斑,女性多见,春季发生红斑者居多,典型的为双侧胫前对称性分布。对于影像诊断不易确诊的,可行激素实验性治疗或纵隔镜活检。
八、结束语
就肺癌的CT诊断而言,应是不同征象的综合分析。根据病灶的CT特点,可对大多数的肺癌作出正确诊断。据文献报道,经验丰富的影像科医生平扫CT对周围型肺癌的诊断准确率可达85%,若结合增强扫描,确诊率可达90%以上。但肺癌所具备的绝大多数征象并不是特异的。虽然有些征象在肺癌较常见,但也可见于良性病变,因此在肺癌的CT诊断中不能仅凭某一种征象作为依据,必须仔细分析病灶所具有的CT征象,并对其作出综合分析。根据CT和病理对照观察,分叶征是周围型肺癌的基本征象,在此基础上再出现其他征象诊断意义较大。动态观察往往具有重要价值,对于中老年患者,如果既往胸片或CT正常,肺内有新出现的孤立性结节,或结节随诊中增大,无论其影像学特点如何,应首先考虑肺癌。而对于不易区分的炎症和肺癌,抗炎后的复查是必需的,不要只凭一次的CT勉强做出诊断。需要强调一点,CT诊断必须密切结合患者的临床资料,如年龄、临床症状等。总之,肺癌的CT诊断必须密切结合临床和影像学特征,才能提高诊断准确率。
(黄 勇 李文武)
参考文献
1.吴恩惠,冯敢生.医学影像学[M].第6版.北京:人民卫生出版社,2008.
2.蔡祖龙,高元桂.胸部CT与MRI诊断学[M].北京:人民军医出版社,2005.
3.石木兰.肿瘤影像学[M].北京:科学出版社,2003.
4.Joseph KTL,Stuart SS,Robert JS,et al.Computed Body Tomography with MRI Correlation.4th ed.New York:the Lippincoptt Williams & Wilkins Co,2006.
5.Flohr TG,Schaller S,Stierstorfer K,et al.Multi-detector row CT systems and image-reconstruction techniques[J].Radiology,2005,235:756-773.
6.Flohr T,Stierstorfer K,Bruder H,et al.Image reconstruction and image quality evaluation for a 16-slice CT scanner[J].Med Phys,2003,30:832-845.
7.Hsieh J.Computed tomography[M].Bellingham,WA:SPIE,2003:1-12.
8.Aamer A,Kazuto A,Kenji N,et al.High resolution CT anatomy of the pulmonary fissures[J].J Thor Imag,2004,19:186-191.
9.Aronberg DJ,Peterson RR,Glazer HS,et al.Superior diaphragmatic lymph nodes:CT assessment[J].J Comput Assist Tomogr,1986,10:937-941.
10.Baron RL,Lee JKT,Sagel SS,et al.Computed tomography of the normal thymus[J].Radiology,1982,142:121-125.
11.Brink JA.Multidetector CT.general principles.In Body CT Categorical Course Syllabus[J].American Roentgen Ray Society,2002,1-7.
12.Brink JA,Heiken JP,Wang G,et al.Helical CT:principles and technical considerations[J].Radiographics,1994,14:887-893.
13.Buckley JA,Scott WW,Jr,Siegelman SS,et al.Pulmonary nodules:effect of increased data sampling on detection with spiral CT and confidence in diagnosis[J].Radiology,1995,196(2):395-400.
14.Calhoun PS,Kuszyk BS,Heath DG,et al.Three-dimensional volume rendering of spiral CT data:theory and method[J].Radiographics,1999,19:745-764.
15.Colice GL.Chest CT for known or suspected lung cancer[J].Chest,1994,106:1 538-1 550.
16.Corcoran HL,Renner WR,Milstein MJ.Review of high-resolution CT of the lung[J].Radiographics,1992,12:917-939.
17.Geer G,Webb WR,Gamsu G.Normal thymus:assessment with MR and CT[J].Radiology,1986,158:313-317.
18.Dorfman RE,Alpern MB,Gross BH,et al.Upper abdominal lymph nodes:criteria for normal size determined with CT[J].Radiology,1991,180:319.
19.Fishman E,Magid D,Ney D,et al.Three-dimensional imaging[J].Radiology,1991,181:321-337.
20.Gale ME.Anterior diaphragm:variations in the CT appearance[J].Radiology,1986,161:635-639.
21.Genereux GP,Howie JL.Normal mediastinal lymph node size and number:CT and anatomic study[J].AJR Am J Roentgenol,1984,142:1 095-1 100.
22.Glazer HS.Anatomy of the major fissure[J].Radiology,1991,180:839-834.
23.Berger WG,Erly WK,Krupinski EA,et al.The solitary pulmonary nodule in chest radiography;can we really tell if the nodule is calcified[J].AJR Am J Roentgenol,2001,176:201-204.
24.Padovani B,Mouroux J,Seksik L,et al.Chest wall invasion by bronchogenic carcinoma:evaluation with MR imaging[J].Radiology,1993,187:33-38.
25.Port JL,Kent MS,Korst RJ,et al.Tumor size predicts survival within 1A non-small cell lung cancer[J].Chest,2003,124:1 828-1 833.
26.De Hoop B.,Gietema H van Ginneken B,et al.A comparison of six software packages for evaluation of solid lung nodules using semi-automated volumetry:What is the minimum increase in size to detect growth in repeated CT examinations[J].Eur Radiol,2009,19:800-808.
27.Marchianò A,Calabrò E,Civelli E,et al.Pulmonary Nodules:Volume Repeatability at Multidetector CT Lung Cancer Screening[J].Radiology,2009,251:919-925.
28.Frank,Friedrich,Volker,et al.Detection of pulmonary nodules by multislice computed tomography:improved detection rate with reduced slice thickness[J].Eur Radiol,2003,13:2 378-2 383.
29.Yue Y,Tsuneo M,Atsuto H,et al.The probability of malignancy in small pulmonary nodules coexisting with potentially operable lung cancer detected by CT[J].Eur Radiol,2003,13:2 447-2 453.
30.Kazuo A,Kohei M,Akio O,et al.Pulmonary Nodules:Estimation of Malignancy at Thin-Section Helical CT-Effect of Computer-aided Diagnosis on Performance of Radiologists[J].Radiology,2006,239:276-284.
31.Webb WR,Brant WE,Major NM.Fundamentals of Body CT[M].3rd.Singapore:Elsevier,2006.
32.Hsieh J,Toth TL,Simoni P,et al.A generalized helical reconsruction algorithm for multidetector row CT(abstract)[J].Radiology,2001,221:217.
