肿瘤免疫治疗概述
第一节 肿瘤免疫治疗概述
1909年Ehrlich首先提出,免疫系统不仅负责防御微生物侵犯,而且能从肌体内清除变异细胞。本世纪中期,Foley证实,纯系小鼠诱发的肿瘤能在同系小鼠之间移植,如在肿瘤的生长过程中将移植瘤完全切除,小鼠会对再次接种的肿瘤产生抵抗能力,再次接种的肿瘤或者不再生长,或者长到一定的大小便自行消退。这种抗性有专一性,对再次接种来源于同系动物的另一肿瘤没有抵抗能力。实验证明,肿瘤确能被宿主视为“非己”而产生特异的免疫排斥反应,机体存在着抗肿瘤免疫机制。60年代,Thomas、Burnet和Good等将该观点系统化,提出了免疫监视学说。认为免疫系统能精确地分辨“自己”和“非己”,有效清除各种微生物,排斥同种异体移植物,消灭机体内突变的细胞,防止肿瘤的生长。70年代,掀起一次肿瘤免疫治疗高潮,是以非特异性免疫治疗为主,最具代表性的是采用细菌制剂,如卡介苗(BCG)、短小棒状杆菌(C.Pavum)。1975年Kohler和Milestei建立B淋巴细胞杂交瘤技术制备出单克隆抗体,对指导肿瘤诊断及治疗产生重大影响。80年代,伴随着分子生物学技术的发展,许多细胞因子基因被克隆,运用基因重组技术在原核或真核细胞中表达,使细胞因子大量生产并成为临床制剂,促进了肿瘤免疫治疗研究。80年代末期至90年代初期,对于人类肿瘤抗原、抗原的加工呈递和T细胞识别机制的研究有了突破性进展。基因重组细胞因子、人源化基因工程抗体已作为药物进入临床应用。树突状细胞的深入研究为肿瘤免疫提供了有力武器。
一、肿瘤抗原
抗肿瘤免疫以细胞免疫为主,肿瘤只有表达特异的标志或靶子,免疫细胞才能够识别。如前所述,50年代应用纯系小鼠早已证实了肿瘤特异性移植排斥性抗原(TSTA)。然而,早期采用血清学方法仅发现人类胚胎性的肿瘤相关抗原,如甲胎蛋白(AFP)和癌胚抗原(CEA)。虽然这些抗原可诱导机体产生特异性抗体,但却不能诱导产生肿瘤特异性细胞毒性T细胞(CTL)介导的肿瘤排斥反应。应用单克隆抗体技术发现了大量肿瘤相关抗原,但它们仍然是基于异源抗原抗体识别的产物,不能作为肿瘤排斥抗原,然而,它们可用于肿瘤的辅助诊断和生物导弹的导向工具。人类肿瘤特异性抗原一直是困扰肿瘤免疫学界的难题。
肿瘤特异排斥性抗原是指肿瘤细胞上特异表达的能够被T淋巴细胞识别并参与T淋巴细胞活化的分子。人类肿瘤是否存在这种抗原呢?人们探索多年的重要问题终于在80年代末期有了答案。比利时的ThierryBoon研究组巧妙地应用T细胞克隆技术,找到了人类肿瘤抗原并运用分子生物学方法克隆了该抗原的基因。他们首先取患者的黑色素瘤进行体外培养,再将已建系的MZ2-MEL瘤细胞与患者自身的淋巴细胞重复进行混合培养(MLTC),刺激和扩增的(CTL)用有限稀释法建立了不同的CTL克隆。用一个克隆化的CTL杀伤MZ2-MEL瘤细胞,未被杀死的残余瘤细胞经扩增后再用其他CTL克隆进行杀伤,如对前者抵抗的残余肿瘤能被后者杀伤,说明MZ2-MEL瘤细胞存在不同的T细胞识别表位。应用此法发现了MZ2-MEL瘤细胞系至少有6个不同的T细胞识别表位。进而发现MAGE是一个大的基因家族,其中MAGE-1、2、3、4、6、12基因与肿瘤密切性关。这些基因在其他多种组织来源的肿瘤也有高表达,如MAGE-1在NSCLC和乳腺癌中高表达;MAGE-2在头颈、膀胱、结直肠癌中高表达,但除睾丸外其他正常组织均不表达。因此,这些基因编码的抗原有称为肿瘤特异性共同抗原。在此基础上,该研究小组用类似的方法从黑色素瘤中又分离出BAGE、GAGE基因家族,及在肾癌中分离的RAGE基因家族。前两者基因和MAGE一样,惟一表达的正常组织是睾丸。近几年,UGURSAHIN等研究人员应用肿瘤患者自身血清筛选重组cDNA表达文库(SEREX)方法寻找肿瘤抗原。此法是提取患者肿瘤细胞的mRNA,翻转录为cDNA并将它们插入噬菌体表达载体上位于β-半乳糖苷酶的α多肽基因上的多酶切点中,形成融合基因。当基因重组的噬菌体复制扩增时,肿瘤细胞表达的蛋白即以融合蛋白的形式表达于噬菌体表面。此基因文库称为噬菌体表达文库。应用肿瘤患者自身血清中存在的抗肿瘤抗体,利用抗原抗体特异性反应,结合放射性标记或酶标记技术,筛选肿瘤细胞的cDNA表达文库。将阳性反应的噬菌体克隆后即获得了相应的基因和多肽抗原。目前,用此法已找到了一批肿瘤抗原,其中也包括了应用T细胞克隆发现的MAGE-1、Tyrosinase等。因此,用SEREX方法克隆的某些肿瘤抗原也可以被T细胞识别。这也说明人体内肿瘤细胞表面存在多种肿瘤抗原或肿瘤相关抗原可被免疫系统识别。有趣的是,用SEREX方法从食管癌中克隆的NY-ESO-1肿瘤抗原基因和从黑色素瘤中克隆的HOM-MEL-40也存在于正常睾丸转录的基因中,在卵巢中亦有少量表达。这说明某些肿瘤与睾丸存在着共同抗原,或者说细胞癌变后可以表达生殖细胞抗原或标志。现在将这类抗原称为肿瘤/睾丸抗原(CTAG)家族。
随着研究的深入,人们已突破了原有观念。原来认为不能作为肿瘤排斥性抗原的癌胚抗原(CEA),现将其基因插入痘苗病毒载体后,也可作为肿瘤疫苗诱导肿瘤特异的CTL。至今,已发现了大量肿瘤排斥性抗原。按抗原的基因类型分为:①静止基因(silent gene)的表达产物:此类基因在正常情况下是关闭的,癌变细胞将该基因启动表达,被T细胞视为非己物质,可产生排斥反应,如MAGE。②分化抗原基因的表达产物:CEA是胚胎时期表达的产物,出生后该基因关闭,细胞癌变后则重新开启该基因,成为免疫系统识别的靶子。MART-1、tyrosinase、gp100等均为分化抗原。③癌基因的异常高表达:如HER-2/neu虽然某些正常细胞也有微量表达,但自身T细胞对其耐受,癌变细胞由于异常高表达,打破了这种耐受,成为免疫系统可识别的靶子。④突变的抑癌基因产物:如突变的p53可造成其产物的堆积,同样可作为免疫系统识别的靶子。⑤突变的癌基因表达产物:如正常的ras基因产物无免疫原性,癌细胞中在编码ras第12或61位发生基因突变,形成具有新表位的p21 ras产物,而被免疫系统识别。⑥染色体易位产生的融合基因产物:如白血病细胞的原癌基因c-abl从9号染色体易位到22号染色体与bcr基因连接形成bcr-abl融合基因编码210 KD融合蛋白(p210bcr-abl),这种蛋白可被T细胞识别。⑦致癌病毒性基因产物:如人乳头瘤状病毒(HPV)的16和18型与宫颈癌密切相关,HPV16的E6、E7基因能使宫颈鳞状上皮转化为肿瘤细胞,而E6、E7的基因产物可被T细胞识别。⑧其他:如MUC-I基因编码的与细胞膜相关的黏蛋白,在某些癌细胞中高表达,关键是糖基化不完全,而暴露出多肽骨架,成为免疫识别的靶子,并且属于MHC非限制性的肿瘤相关抗原。从严格的定义来讲,肿瘤抗原并不绝对是肿瘤特异性抗原(如MAGE-1正常的睾丸组织同样表达),但对诱导特异性抗肿瘤免疫反应却是良好的肿瘤排斥性抗原,它为肿瘤的免疫治疗奠定了基础。
二、抗原加工和呈递
目前,抗原呈递细胞(antigen-presenting cell,APC)的概念也已发生了变化,除了单核—巨噬细胞、树突状细胞等专职的APC外,肿瘤细胞本身也是APC。抗原呈递主要有两种形式:内源性抗原呈递和外源性抗原呈递。前者主要指细胞内自身抗原、肿瘤抗原和病毒抗原,由主要组织相容性复合物Ⅰ类分子(MHCⅠ)途径呈递。胞质内蛋白在蛋白酶作用下降解成肽段,依次被热休克蛋白HSP70和HSP90传递给膜上的TAP(tansporter associated with antigen processing),同时,在蛋白酶的作用下进一步被剪切成小肽。小肽由TAP经HSP96传递给内质网内新合成的MHCⅠ类分子上,最后由MHCⅠ类分子将结合的抗原小肽托出细胞膜外。后者是指细胞外物质经专职APC吞噬(phagocytosis,指颗粒抗原)、胞饮(pinocytosis,指可溶性抗原)或内吞(endocytosis,指抗原经细胞上的受体导入胞内),在胞内形成吞噬体(phagosome)由主要组织相容性复合物Ⅱ类分子(MHCⅡ)呈递。肿瘤抗原的呈递同样存在上述两种形式,肿瘤细胞本身由MHCⅠ类分子将内源肿瘤抗原小肽呈递给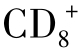 T细胞,而专职APC也可捕捉肿瘤释放出的抗原,由MHCⅡ类分子呈递给
T细胞,而专职APC也可捕捉肿瘤释放出的抗原,由MHCⅡ类分子呈递给 T细胞。近期有实验表明,专职APC也可将捕获的外源肿瘤抗原,由MHCⅠ类分子呈递给
T细胞。近期有实验表明,专职APC也可将捕获的外源肿瘤抗原,由MHCⅠ类分子呈递给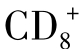 T细胞。
T细胞。
MHC在人类称为人白细胞抗原(HLA)。与抗原呈递相关的主要是HLAⅠ类和Ⅱ类分子或叫做MHC-Ⅰ类和Ⅱ类分子。经典的MHC-Ⅰ类分子主要是HLA-A、B、C系列,它们广泛分布于人体有核细胞上。MHC-Ⅱ类分子HLA-DR、DP、DQ分布较窄,主要表达于树突状细胞、单核—巨噬细胞、B细胞、并指状细胞、血管内皮细胞、精细胞等。
肿瘤抗原基因所编码的多肽一般含有多个抗原表位,由MHC-Ⅰ类分子结合并能诱导CTL的小肽是其中极小部分。MHC不同的细胞可表达同一肿瘤抗原,如MAGE-3抗原即可被HLA-A1呈递,又可被HLA-A2呈递,但所呈递的抗原小肽不同,它们代表着同一抗原的不同表位,这些小肽即属于MHC限制性抗原小肽。某一特定型别的MHC-Ⅰ类分子可与多种不同的肽结合,但这些不同的氨基酸有共同特点,即某些位置总是某一种或很少几种具有相似侧链/或化学性质的氨基酸。它们对肽与某一特定MHC-Ⅰ类分子之间的结合起决定作用。这些位置上的氨基酸残基为锚定残基(anchorresidues)。锚定残基一般为2~3个,其中一个总是在肽的羧基端(C末端)。C末端氨基酸残基在MHC-Ⅰ类分子中相当保守。目前已知的MHC-Ⅰ类分子结合肽中,95% C末端残基为Ile、Val、Arg、Lys、Tyr和Phe。不同的MHC-Ⅰ类分子,其结合肽的锚定残基氨基酸性质不同。这种特定的氨基酸组成顺序称为MHC-Ⅰ类分子等位基因特异性基序(allele-specific consensusmotif)或肽结合基序(peptide-bindingmotif)。对于已知氨基酸序列的抗原,根据肽结合基序可预测被CTL识别的表位。实验证实,有些预测完全正确,但也有些MHC-Ⅰ类分子限制性抗原肽与上述特异性基序不一致,进而发现除锚定残基外还有一些氨基酸在特定型别的MHC-Ⅰ类分子结合肽的某些位置上出现的频率比较高。这些位置上的氨基酸对肽与MHC-Ⅰ类分子之间的结合不是必需的,却可不同程度地增加二者的亲和力。根据它们影响程度的大小分别称为辅锚定残基(auxiliaryanchor residues)和优选残基(preferredresidues)。有了上述理论的依托,人们可以预测肿瘤抗原表位,人工合成肿瘤抗原小肽用于肿瘤的免疫治疗。目前,已鉴定出一批与人MHC-Ⅰ类分子结合的肿瘤抗原小肽,用人工合成的一些抗原小肽,在临床研究中已产生效果。
黏蛋白MUC-Ⅰ作为肿瘤抗原与前面所述的不同,它激活T细胞不受MHC限制。黏蛋白MUC-Ⅰ,又称为上皮细胞黏蛋白(epithelial cell mucin)、多肽性上皮黏蛋白(polymorphic epithelial mucin)或episialin。MUC-Ⅰ表达于腺上皮细胞,通过其羧基端的疏水性穿膜区与细胞膜连接,其胞外区很长,由1 000~2 200个氨基酸组成。正常情况下,MUC-Ⅰ黏蛋白高度糖基化,在腺上皮细胞的分布局限于细胞的顶部,即朝向腺腔的部分。而腺癌细胞MUC-Ⅰ黏蛋白表达量明显增加,除细胞顶外其他部位细胞膜均有表达,并且其糖基化不完全,从而暴露出蛋白的多肽骨架,成为免疫攻击的靶位。
三、T细胞识别与共刺激分子
T细胞通过T细胞受体TCR和CD3复合物对抗原进行识别。T细胞所识别的是MHC-Ⅰ或Ⅱ类分子和被呈递抗原肽的复合物。单纯的抗原肽是不能直接被T细胞识别。由MHCⅠ呈递抗原肽时,其a3功能区与T细胞表面的CD8分子相互作用,CD8分子同时还与部分a2功能区结合。由MHCⅡ呈递抗原肽时,其a2和b2功能区还与T细胞表面的CD4分子相互作用。
T细胞识别机制另一个重要的进展是共刺激分子的研究。T细胞的活化除了上述识别条件外,还必须有共刺激分子(costimulator)参与。在T细胞激活诱导阶段缺乏共刺激信号,不仅不能活化T细胞,还会引起T细胞克隆特异性无反应性,导致免疫耐受。不同的细胞系统传递共刺激信号的分子有所不同,包括B淋巴细胞激活抗原(B7)、细胞间黏附分子(ICAMs)、淋巴细胞功能相关抗原(LFA-3)、血管内皮黏附分子(VCAM-1)、热稳定抗原(HSA)以及近期发现的4-1BB等。它们与其相应的配体结合,发挥共刺激作用。80年代末至90年代初期共刺激分子B7在肿瘤免疫研究中较为深入和广泛。
共刺激分子B7为44~54 kD的糖蛋白,属于免疫球蛋白超家族成员。最初发现于活化的B细胞上,也表达于树突状细胞、活化的巨噬细胞。除B细胞来源的肿瘤外,其他肿瘤很少表达B7。共刺激分子的缺乏也是肿瘤的弱免疫原性的重要因素。B7又分为B7-1(又名为CD80)和B7-2(又名为CD86),两者仅有25%氨基酸同源。APC活化时,B7-2表达早于B7-1。B7有两种受体存在于T细胞表面,CD28低亲和力受体和CTLA4高亲和力受体。CD28亦是免疫球蛋白超家族成员,是相对分子质量为44 kD的同源二聚体,在95%的 T淋巴细胞、50%
T淋巴细胞、50%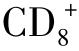 T淋巴细胞及
T淋巴细胞及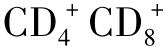 双阳性的胸腺细胞表面皆有组成性表达。CTLA4为CD28的同源分子,他们共表达于活化的T细胞表面。CTLA4虽然表达量比CD28少,但它与B7的亲和力是CD28的20倍。B7:CD28通路为IL-2的产生提供了关键信号。B7传导阳性或阴性信号取决于与其结合的配基,与T细胞上的CD28结合产生阳性信号,增强免疫应答;B7与CTLA4结合则产生阴性信号,封闭了CD28依赖的T细胞激活,下调免疫反应。4-1BB/4-1BBL共刺激途径是近几年发现的,4-1BB(CDw137)是肿瘤坏死因子受体超家族成员,主要表达于T细胞上。其高亲和力配体4-1BBL表达于APC细胞,如巨噬细胞和活化的B细胞。4-1BBL或抗4-1BB抗体与T细胞的4-1BB结合后可诱导T细胞的活化与增殖。4-1BB和CD28共刺激途径在活化T细胞抗肿瘤效应方面具有协同作用。
双阳性的胸腺细胞表面皆有组成性表达。CTLA4为CD28的同源分子,他们共表达于活化的T细胞表面。CTLA4虽然表达量比CD28少,但它与B7的亲和力是CD28的20倍。B7:CD28通路为IL-2的产生提供了关键信号。B7传导阳性或阴性信号取决于与其结合的配基,与T细胞上的CD28结合产生阳性信号,增强免疫应答;B7与CTLA4结合则产生阴性信号,封闭了CD28依赖的T细胞激活,下调免疫反应。4-1BB/4-1BBL共刺激途径是近几年发现的,4-1BB(CDw137)是肿瘤坏死因子受体超家族成员,主要表达于T细胞上。其高亲和力配体4-1BBL表达于APC细胞,如巨噬细胞和活化的B细胞。4-1BBL或抗4-1BB抗体与T细胞的4-1BB结合后可诱导T细胞的活化与增殖。4-1BB和CD28共刺激途径在活化T细胞抗肿瘤效应方面具有协同作用。
四、肿瘤免疫效应机制
(一)细胞免疫
抗肿瘤免疫是以细胞免疫为主,其中具有免疫记忆功能和特异性的主要是T细胞,因此,一直受到人们的重视,而非特异性抗肿瘤免疫细胞自然杀伤细胞(NK)和gd T淋巴细胞也日益受到人们的重视。1.T细胞T细胞主要有两类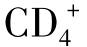 T辅助细胞和
T辅助细胞和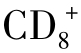
细胞毒性T细胞。它们均表达CD3标志,主要产生特异性免疫,如前面所述其活化是受MHC限制的。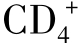 T细胞在接受专职APC上的MHC抗原复合物和共刺激分子双重信号后,细胞发生克隆性增殖,并释放出多种细胞因子,其中主要为白细胞介素2(IL-2)、γ干扰素(INF-γ)、肿瘤坏死因子(TNF)和淋巴毒素(LT)。这些因子在调节、活化细胞毒性T细胞、巨噬细胞、B细胞的抗肿瘤效应中起重要作用。
T细胞在接受专职APC上的MHC抗原复合物和共刺激分子双重信号后,细胞发生克隆性增殖,并释放出多种细胞因子,其中主要为白细胞介素2(IL-2)、γ干扰素(INF-γ)、肿瘤坏死因子(TNF)和淋巴毒素(LT)。这些因子在调节、活化细胞毒性T细胞、巨噬细胞、B细胞的抗肿瘤效应中起重要作用。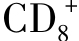 CTL也是在双重信号作用下被活化和克隆增殖。已活化的细胞毒性T细胞在杀伤肿瘤的效应阶段则不需要共刺激分子的辅助。CTL须与靶细胞直接接触才能产生杀伤作用。
CTL也是在双重信号作用下被活化和克隆增殖。已活化的细胞毒性T细胞在杀伤肿瘤的效应阶段则不需要共刺激分子的辅助。CTL须与靶细胞直接接触才能产生杀伤作用。
目前研究认为,CTL有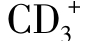 CD4-
CD4-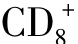 TCRab、
TCRab、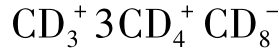 TCRab和
TCRab和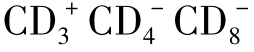 TCRgd3种。其杀伤作用方式也有以下3种:①CTL与靶细胞接触产生脱颗粒作用,排出穿孔素(perferin),插入靶细胞膜上,并使其形成通道,而粒酶(granzymes)、TNF、分泌性ATP等效应分子进入靶细胞,导致其死亡。其中穿孔素造成靶细胞膜损伤,粒酶使DNA断裂,引起细胞凋亡(PCD)。②CTL激活后表达FasL(Fas配体),它可被释放到胞外与靶细胞表面的Fas分子结合,传导死亡信号进入胞内,活化靶细胞内的DNA降解酶,引起靶细胞凋亡。激活白介素1b转换酶(ICE)或与ICE相关的蛋白酶,引起细胞凋亡。③上述两种方式共存。
TCRgd3种。其杀伤作用方式也有以下3种:①CTL与靶细胞接触产生脱颗粒作用,排出穿孔素(perferin),插入靶细胞膜上,并使其形成通道,而粒酶(granzymes)、TNF、分泌性ATP等效应分子进入靶细胞,导致其死亡。其中穿孔素造成靶细胞膜损伤,粒酶使DNA断裂,引起细胞凋亡(PCD)。②CTL激活后表达FasL(Fas配体),它可被释放到胞外与靶细胞表面的Fas分子结合,传导死亡信号进入胞内,活化靶细胞内的DNA降解酶,引起靶细胞凋亡。激活白介素1b转换酶(ICE)或与ICE相关的蛋白酶,引起细胞凋亡。③上述两种方式共存。
 CTL是体内数量最多的CTL亚群,也是最主要的效应细胞。其杀伤活性约2/3来自于穿孔素途径,而Fas/FasL诱导PCD约占1/3。
CTL是体内数量最多的CTL亚群,也是最主要的效应细胞。其杀伤活性约2/3来自于穿孔素途径,而Fas/FasL诱导PCD约占1/3。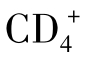 CTL在体内少于
CTL在体内少于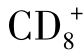 CTL,对其细胞毒机制尚无统一认识,对于穿孔素和Fas/FasL诱导PCD途径既有支持证据,又有不支持的结果。gdT淋巴细胞在外周血淋巴细胞中仅占1%~10%,具有细胞毒活性的比例更低。gdCTL杀伤途径与NK相似,即通过穿孔素途径非特异性杀伤靶细胞,是否有其他途径尚待研究。由于其杀伤靶细胞是非MHC限制性的,所以逐渐被重视。
CTL,对其细胞毒机制尚无统一认识,对于穿孔素和Fas/FasL诱导PCD途径既有支持证据,又有不支持的结果。gdT淋巴细胞在外周血淋巴细胞中仅占1%~10%,具有细胞毒活性的比例更低。gdCTL杀伤途径与NK相似,即通过穿孔素途径非特异性杀伤靶细胞,是否有其他途径尚待研究。由于其杀伤靶细胞是非MHC限制性的,所以逐渐被重视。
2.NK细胞自然杀伤细胞(NK)是淋巴细胞的亚群,约占外周血淋巴细胞的15%。其特征是无TCRab或gd基因重组,不表达TCR/CD3和BCR。一般用于鉴定NK细胞的标志是 、。来自于外周血的NK细胞不经活化即可杀伤某些肿瘤细胞,并且不受MHC限制。NK细胞杀伤瘤谱非常窄,只是对少数血液来源的肿瘤有效。如K562人红白血病细胞系是NK杀伤敏感细胞株,通常作为实验室测定NK活性的靶细胞。当NK细胞被IL-2、IFN-γ等因子活化后,其杀伤瘤谱和杀伤效率大幅度提高。NK细胞的活性受活化性和抑制性受体所调节。NK细胞活化性受体(Killer-cell activatory receptor,KARs)包括FcRⅢ(属Ig超家族)和NKR-P1(存在于大鼠和小鼠中,属于C性凝集素超家族),分别结合靶细胞上的IgFc区域和糖基配体,触发NK细胞的杀伤作用。人类NK细胞活化性受体尚无明确的分子。NK细胞抑制性受体(Killer-cell inhibitory receptor,KIRs),若与自身靶细胞上的MHC-Ⅰ类分子及自身多肽形成的复合物结合时,则关闭NK细胞的杀伤作用。而外来细胞上的MHC-Ⅰ类分子不能被NK细胞抑制性受体所识别,不能抑制NK细胞对其杀伤。NK细胞通过释放的杀伤介质穿孔素、NK细胞毒因子(NKCF)、TNF等使靶细胞溶解破裂。NK细胞还可以通过人抗肿瘤抗体IgG1和IgG3作为桥梁,其Fab端特异性识别肿瘤,Fc段与NK细胞FcRgⅢa结合,产生抗体依赖的细胞介导的细胞毒(ADCC)作用,并且,IL-2和IFN-γ可增强该效应。目前,NK细胞识别靶细胞机制仍有许多问题有待解决,其特异性是如何产生的及其信号传导途径机制尚不清楚。
、。来自于外周血的NK细胞不经活化即可杀伤某些肿瘤细胞,并且不受MHC限制。NK细胞杀伤瘤谱非常窄,只是对少数血液来源的肿瘤有效。如K562人红白血病细胞系是NK杀伤敏感细胞株,通常作为实验室测定NK活性的靶细胞。当NK细胞被IL-2、IFN-γ等因子活化后,其杀伤瘤谱和杀伤效率大幅度提高。NK细胞的活性受活化性和抑制性受体所调节。NK细胞活化性受体(Killer-cell activatory receptor,KARs)包括FcRⅢ(属Ig超家族)和NKR-P1(存在于大鼠和小鼠中,属于C性凝集素超家族),分别结合靶细胞上的IgFc区域和糖基配体,触发NK细胞的杀伤作用。人类NK细胞活化性受体尚无明确的分子。NK细胞抑制性受体(Killer-cell inhibitory receptor,KIRs),若与自身靶细胞上的MHC-Ⅰ类分子及自身多肽形成的复合物结合时,则关闭NK细胞的杀伤作用。而外来细胞上的MHC-Ⅰ类分子不能被NK细胞抑制性受体所识别,不能抑制NK细胞对其杀伤。NK细胞通过释放的杀伤介质穿孔素、NK细胞毒因子(NKCF)、TNF等使靶细胞溶解破裂。NK细胞还可以通过人抗肿瘤抗体IgG1和IgG3作为桥梁,其Fab端特异性识别肿瘤,Fc段与NK细胞FcRgⅢa结合,产生抗体依赖的细胞介导的细胞毒(ADCC)作用,并且,IL-2和IFN-γ可增强该效应。目前,NK细胞识别靶细胞机制仍有许多问题有待解决,其特异性是如何产生的及其信号传导途径机制尚不清楚。
3.巨噬细胞在抗肿瘤免疫中,巨噬细胞具有抗原呈递功能,参与调节特异性T细胞免疫。未活化的巨噬细胞对肿瘤细胞无杀伤作用,活化后作为效应细胞产生非特异性杀伤和抑制肿瘤作用。它可产生多种杀伤靶细胞的效应因子,包括超氧化物、一氧化氮、TNF及溶酶体产物等。巨噬细胞还可通过ADCC途径杀伤靶细胞。过度活化的巨噬细胞可抑制淋巴细胞的增殖,抑制NK和CTL抗肿瘤活性。这种抑制性巨噬细胞是否为巨噬细胞的不同分化阶段,还是其中的亚类尚不清楚。近期还发现,肿瘤宿主中骨髓来源的粒细胞巨噬细胞的前体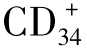 细胞具有天然的抑制活性。肿瘤产生的许多因子,如IL-4、IL-6、IL-10、MDF、TGF-β、PGE2、M-CSF等,能够逆转和抑制活化巨噬细胞的细胞毒活性,诱导巨噬细胞的抑制活性。这种抑制活性可被维生素D3逆转。
细胞具有天然的抑制活性。肿瘤产生的许多因子,如IL-4、IL-6、IL-10、MDF、TGF-β、PGE2、M-CSF等,能够逆转和抑制活化巨噬细胞的细胞毒活性,诱导巨噬细胞的抑制活性。这种抑制活性可被维生素D3逆转。
4.树突状细胞(DC)DC是最强的APC。未成熟的DC可以通过吞噬颗粒物质,胞饮可溶性物质,以及借助受体内吞来捕捉抗原。它能够吞噬凋亡细胞,并经过加工处理后由MHC-Ⅰ类分子交叉呈递给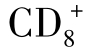 T细胞。这种作用与DC表达avb5整合素(alphavbeta5integrin)和CD36相伴随。随着DC的成熟,这些受体和吞噬能力依次被下调。巨噬细胞吞噬凋亡细胞能力强于DC,但在表达的受体中缺乏avb5整合素,不能像DC那样交叉呈递所吞噬的凋亡细胞成分。因此,在对于外来捕获抗原的交叉呈递,avb5整合素可能起决定性作用。在体外单核细胞经某些因子刺激下可转为DC,更为引人注意的是,Lactoferin阳性的中性粒细胞前体细胞与GM-CSF、IL-4、TNF-α培养后可以转化为DC,对可溶性抗原呈递能力比新分离的单核细
T细胞。这种作用与DC表达avb5整合素(alphavbeta5integrin)和CD36相伴随。随着DC的成熟,这些受体和吞噬能力依次被下调。巨噬细胞吞噬凋亡细胞能力强于DC,但在表达的受体中缺乏avb5整合素,不能像DC那样交叉呈递所吞噬的凋亡细胞成分。因此,在对于外来捕获抗原的交叉呈递,avb5整合素可能起决定性作用。在体外单核细胞经某些因子刺激下可转为DC,更为引人注意的是,Lactoferin阳性的中性粒细胞前体细胞与GM-CSF、IL-4、TNF-α培养后可以转化为DC,对可溶性抗原呈递能力比新分离的单核细 胞强10 000倍。近期研究证实,DC可分泌的exosomes(外泌小体)或称为dexosomes的小体具有抗原呈递密切相关的MHC-Ⅰ、Ⅱ类分子和共刺激分子。IL-10、IL-12、IFN-γ可促进DC分泌exosomes。动物实验表明,肿瘤抗原多肽致敏的骨髓DC制备的exosomes可在体内诱导高水平肿瘤特异性CTL,治愈荷瘤小鼠,它有望成为一种新型的肿瘤疫苗。
胞强10 000倍。近期研究证实,DC可分泌的exosomes(外泌小体)或称为dexosomes的小体具有抗原呈递密切相关的MHC-Ⅰ、Ⅱ类分子和共刺激分子。IL-10、IL-12、IFN-γ可促进DC分泌exosomes。动物实验表明,肿瘤抗原多肽致敏的骨髓DC制备的exosomes可在体内诱导高水平肿瘤特异性CTL,治愈荷瘤小鼠,它有望成为一种新型的肿瘤疫苗。
(二)体液免疫及细胞因子
在抗肿瘤免疫中,体液免疫不占主导地位。抗体结合补体后的溶瘤作用,以及依赖抗体的细胞介导的细胞毒(ADCC)作用,是人们早已了解的抗肿瘤中的作用方式。80年代至今,伴随着生物工程的发展,已发现了大批细胞因子,并在原核系统或真核系统中进行表达。它们在抗肿瘤免疫及其调节中具有重要作用,如干扰素(IFN)、白细胞介素(IL)、肿瘤坏死因子(TNF)、各种造血相关细胞因子等。
1.干扰素(IFN)IFN可分为α、β和γ。IFN-α、β有广谱抗病毒作用,促进多数细胞MHC-Ⅰ类分子的表达,提高巨噬细胞、NK细胞、CTL抗肿瘤作用。IFN-γ它可上调多种细胞MHC-Ⅰ、Ⅱ类分子表达,上调血管内皮细胞ICAM-1的表达。IFN对多种肿瘤近期疗效较好,如毛细胞白血病、慢性髓样白血病、淋巴瘤、Kaposi肉瘤、皮肤瘤、肾肉瘤、神经胶质瘤、和骨髓瘤等。IFN可抑制肿瘤细胞增殖,诱导NK、CTL等杀伤细胞,协同IL-2增强LAK活性,上调瘤细胞上的MHC-Ⅰ类分子表达,增强对杀伤细胞的敏感性。但是,有一个不容忽视的现象,即IFN-γ处理的某些肿瘤细胞转移活性增强。
2.肿瘤坏死因子(TNF)分为两种,TNF-α又称为恶质素,TNF-β又称为淋巴毒素(LT),两者都是同源3聚体。TNF是重要的炎症因子,与败血症休克、发热、多器官衰竭、恶病质相关。它们在体内外均能杀死某些瘤细胞,或抑制其增殖,激活免疫细胞攻击肿瘤,增强IL-2依赖的胸腺细胞,T细胞增殖能力,促进IL-2、CSF、IFN-γ等淋巴因子产生,干扰肿瘤血液供应。它的许多功能与IL-1相同。另一方面,TNF又可促肿瘤有丝分裂、肿瘤扩散、血管生成和恶液质。约50%肿瘤本身可产生TNF,这种内源性TNF可改变肿瘤对外源TNF的敏感性。
3.白细胞介素(Interleukin,IL)目前,已发现和命名的白细胞介素有18种,它们均为糖蛋白。其中IL-2、4、7、12、15、18在抗肿瘤免疫或辅助肿瘤治疗中具有重要作用。IL-2可促进T、B细胞增殖、分化产生细胞因子,促进CTL、NK和LAK细胞增殖、提高杀伤活性,高剂量可激活巨噬细胞。IL-7可促进前T、B细胞、胸腺细胞和T增殖,诱导LAK活性。IL-12可协同IL-2促CTL、NK细胞分化;促B细胞Ig产生和类型转换。IL-18可促进外周血单个核细胞产生IFN-γ、增强NK细胞毒作用和GM-CSF产生降低IL-10产生,增强Th1细胞由FasL介导的细胞毒作用。
4.造血相关的细胞因子集落刺激因子(CSF)包括粒细胞集落刺激因子(G-CSF)、巨噬细胞集落刺激因子(M-CSF)、粒细胞和巨噬细胞集落刺激因子(GM-CSF)、多能细胞集落刺激因子(multi-CSF或IL-3)、红细胞生成素(EPO)、干细胞生长因子(SCF)、血小板生成素(TPO),他们主要促进不同类型血细胞的增值、分化。其中GCSF、GM-CSF、EPO基因工程产品已作为正式药品进入市场,其他几种因子也在进行临床实验研究,并将陆续进入市场。此类因子在癌症中主要用于防止和对抗放疗、化疗造成各种血细胞的下降。近期,在体外用GM-CSF与IL-4、TNF-α协同扩增DC,富集抗原后作为肿瘤疫苗,临床研究已显示出良好应用前景。
五、影响肿瘤免疫机制
(一)肿瘤细胞的弱免疫原性
免疫原是指能诱导机体产生免疫应答的物质,通常免疫原的来源与应答者之间在种系进化过程中相距越远,免疫原性就越强,如细菌、病毒等对于人体来讲就具有强的免疫原性。但肿瘤来源于机体自身突变的细胞,大部分的成分与机体正常细胞的成分相同,只有极少数异常表达的蛋白质和畸形多糖具有免疫原性。从早期的研究中人们就了解到,致瘤病毒诱发的肿瘤免疫原性最强,化学致癌物诱导的肿瘤免疫原性次之,动物自发性肿瘤的免疫原性最弱。由于肿瘤细胞之间也存在免疫原性不同的差异,那些免疫原性较强的肿瘤可以诱导有效的抗肿瘤免疫应答,易被机体消灭,而那些免疫原性相对较弱的肿瘤则能逃脱免疫系统的监视而选择性地增殖,这一过程称为免疫选择。经过不断的选择,肿瘤的免疫原性越来越弱。抗肿瘤抗体与肿瘤细胞表面抗原复合物的内化或脱落的这种抗原调变(antigenicmodulation)作用,致使肿瘤抗原减少,免疫原性减弱。肿瘤细胞表面抗原还可被某些分子所遮盖,如包括唾液酸在内的黏多糖,肿瘤细胞表面通常比正常细胞表面表达更多的糖脂和糖蛋白。MHC-Ⅰ类分子递呈功能的缺乏常常是导致肿瘤免疫逃逸的主要原因之一,可由MHC-Ⅰ类分子mRNA转录水平降低,基因组丢失,或β2-微球蛋白基因的突变等引起。共刺激分子的缺乏也是肿瘤逃逸的原因,其中研究较多的是共刺激分子B7。它主要表达在激活的B细胞表面,在树突状细胞、IFN-γ激活的巨噬细胞上等也有表达,而在肿瘤细胞表面的表达缺如。肿瘤细胞可以通过其表面的MHC分子将肿瘤抗原直接递呈给T细胞,由于缺乏共刺激信号,不能激活T细胞,相反却诱导产生了T细胞耐受。T细胞除可能被肿瘤诱导产生免疫耐受外,还可能出现克隆删除。FasL或Fas抗体与细胞表面的Fas分子结合会诱导该细胞的凋亡。T细胞表面一般都表达Fas分子,有些肿瘤细胞会表达FasL,它们与浸润到肿瘤周围的T细胞上的Fas结合,导致这些T细胞的凋亡。(https://www.daowen.com)
(二)T细胞缺陷
长期以来,研究人员还发现肿瘤宿主的T细胞在体外对有丝分裂原的反应性降低,体内的迟发性超敏反应也降低。近些年来研究表明,这是由于肿瘤宿主的T细胞缺陷所致。MHC分子递呈的抗原肽与T细胞受体结合后需经TCR/CD3以及一系列信号传导系统,最后才能激活相关的基因而发挥生物学功能。CD3分子由g、d、e、z和h五种链组成,与TCR共价连接,肿瘤患者T细胞CD3分子的z链常常表达下降,且信号传导过程中涉及到的p56 lck和p59 fyn等分子的表达也会出现异常,这都会导致T细胞的活化障碍。这种T细胞障碍在体外用CD3和CD28分子的单抗以及IL-2刺激,可以使之恢复。
(三)抑制性T细胞(Ts)
目前尚无证据表明Ts是T细胞的亚类。以前认为Ts属于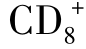 T细胞,目前对TS认识有所变化,也更加复杂化。它既可以是
T细胞,目前对TS认识有所变化,也更加复杂化。它既可以是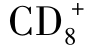 T细胞也可来自
T细胞也可来自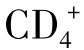 T细胞。一些Ts作用是抗原非特异性的,如
T细胞。一些Ts作用是抗原非特异性的,如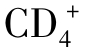 Th1和Th2辅助性T细胞各自产生细胞因子非特异性地抑制对方。肿瘤宿主可增强这种非特异性免疫抑制。Ts通过释放的可溶性TCR、可溶性IL-2受体及免疫抑制因子(如TGF-β、IL-10等)抑制抗肿瘤免疫。Ts也可以是高度抗原特异性的。一些研究表明,抗原特异性抑制是由细胞毒性T细胞介导的,它们识别辅助性T细胞TCR上的独特决定族,并且破坏这些细胞,另一些研究证实,
Th1和Th2辅助性T细胞各自产生细胞因子非特异性地抑制对方。肿瘤宿主可增强这种非特异性免疫抑制。Ts通过释放的可溶性TCR、可溶性IL-2受体及免疫抑制因子(如TGF-β、IL-10等)抑制抗肿瘤免疫。Ts也可以是高度抗原特异性的。一些研究表明,抗原特异性抑制是由细胞毒性T细胞介导的,它们识别辅助性T细胞TCR上的独特决定族,并且破坏这些细胞,另一些研究证实, Th1细胞毒性细胞识别APC上的抗原,并破坏APC;还有研究证实,分离荷瘤宿主体内激活的gdT细胞,体外培养后产生抑制CTL活性的CTL-抑制因子(CTL-IF)。
Th1细胞毒性细胞识别APC上的抗原,并破坏APC;还有研究证实,分离荷瘤宿主体内激活的gdT细胞,体外培养后产生抑制CTL活性的CTL-抑制因子(CTL-IF)。
(四)过度活化的巨噬细胞
其抑制淋巴细胞的增殖,抑制NK和CTL抗肿瘤活性。抑制性巨噬细胞是否为巨噬细胞的分化阶段,还是其中的亚类尚不清楚。
(五)抗原呈递功能障碍
研究表明,荷瘤宿主外周血获得的抗原呈递专职细胞DC往往对抗原呈递有障碍,而取自荷瘤宿主骨髓细胞在体外与GM-CSF、IL-4、TNF-α共同培养扩增的DC抗原呈递功能良好。这表明肿瘤宿主的DC可能从骨髓释放到体内的成熟过程中,受到了荷瘤宿主体内某些因素的干扰,从而削弱了对肿瘤抗原的呈递作用。
(六)免疫抑制因子
带瘤动物和肿瘤患者的免疫抑制状态常可随肿瘤的切除而消失。经检测,多种动物和人类肿瘤的提取物、血清及建系的肿瘤细胞培养上清中存在免疫抑制因子,主要有TGF-β,IL-10和PGE2等。细胞因子在免疫网络中的作用也是极其复杂的。一种因子可有多重作用,如IL-1、TNF-α和IFN-γ既有促进抗肿瘤的作用,又有促进肿瘤转移和发展的一面。
(七)TGF-β
转化生长因子β(transforming growth factor-β),是迄今发现的最强的肿瘤诱导产生的免疫抑制因子,多种肿瘤分泌TGF-β,在很多肿瘤的宿主血浆中也发现有TGF-β。在动物实验中,TGF-β能促进肿瘤的侵犯和转移。它能对抗IL-2引起的免疫刺激作用,抑制NK和LAK细胞的活性、IL-2受体的表达,以及抗原特异CTL的诱导产生及T、B细胞的增殖反应。有些肿瘤分泌TGF-β的量还与其进展和预后有关,分泌TGF-β多的肿瘤患者预后较差。用TGF-β抗体或TGF-β反义核酸处理能中和TGF-β的抑制作用,在动物实验中能降低肿瘤的转移能力。
(八)IL-10
机体的免疫功能通过正向和负向调节两方面彼此协调,相互制约而取得自稳。T辅助细胞就可以分为Th1和Th2两个亚群,Th1亚群的细胞主要分泌IL-2和INF-γ,具有正向调节功能;Th2细胞主要分泌IL-4和IL-10等,具有负向调节功能。IL-10是一种重要的负向调节因子,在很多人类肿瘤中都有过量表达,如肾癌、结肠癌、乳腺癌、胰腺癌、黑色素瘤及神经母细胞瘤等。IL-10的过量分泌会导致负向调节功能增强,打破机体的平衡。
(九)PGE2
PGE2是免疫反应的生理调节因子,活化的巨噬细胞和许多肿瘤产生前列腺素,如人的乳腺癌、头颈部癌中的PGE2水平明显增高。PGE2能引起免疫抑制,通过诱导产生抑制性T细胞和抑制性巨噬细胞,降低LAK细胞的活性,抑制CD3单抗诱导的T细胞增殖等。上面提到人的肿瘤细胞表面的MHC分子表达的下降和缺失是肿瘤免疫逃逸的因素之一,而PGE2能下调癌细胞表面的HLA-DR分子。在体内和体外的实验中,用PGE2合成的抑制剂可以增强抗肿瘤免疫反应。PGE2所产生的抑制作用是与计量相关的,在高剂量时通常呈现免疫抑制作用,而抗体的产生,Th的产生是需要低剂量的PGE2。
六、肿瘤的免疫治疗
(一)细胞过继免疫治疗
肿瘤免疫治疗的复苏开始于80年代中期。1985年,Rosenberge首次报道了应用LAK和IL-2联合静脉输注治疗25例常规疗法治疗无效的晚期肿瘤患者,11例肿瘤明显缩小治疗有效,其中1例黑色素瘤完全缓解。此后又相继开创了TIL过继免疫治疗,但是,其代价昂贵。LAK、TIL治疗剂量高达1×1010~1×1011细胞,IL-2每日输入高达1×107国际单位。主要的不良反应来自大量使用IL-2引起的毛细血管渗漏性综合征。80年代末LAK、TIL风暴席卷了我国,此间尝试了各种治疗方案,其中包括异体LAK、胎儿LAK、肿瘤局部注射,并协同其他生物反应调节剂(BRM)、化疗药物等降低IL-2使用剂量。至今,除了LAK、TIL以外,还报道了A-LAK(黏附性LAK)、CD3AK(IL-2和抗CD3抗体共同诱导激活淋巴细胞)、TAK(在前者基础上加入肿瘤抗原提取物)、CIK(多种细胞因子诱导的杀伤细胞)等。从临床疗效来看,这些方法对癌性腹水治疗效最好,对黑色素瘤、肾癌、淋巴瘤有效率一般为20%~30%,对于其他肿瘤的疗效相对较低。这种生物治疗的优点是,体外诱导效应细胞避开了肿瘤宿主存在免疫抑制,易于活化和扩增。活化的杀伤细胞在体内可以产生抗肿瘤效应,并且与现在的常规治疗方法有互补性。其缺点是不能产业化生产,制备繁琐,质量控制较难,成本高,治疗有效的瘤谱不够广泛。
(二)重组细胞因子治疗
由于生物工程的发展,生理条件下难以获得的细胞因子可以被大量生产。有一批基因重组细胞因子已成为正式的药物,与肿瘤治疗相关的有IFN、IL-2、G-CSF、GM-CSF,并有大量的基因重组细胞因子在进行临床研究。IFN-α是最早进入临床的基因重组细胞因子,对毛细胞白血病的缓解率可达60%~90%。对于慢性白血病、淋巴瘤、Kaposi肉瘤、急性白血病、多发行骨髓瘤、神经胶质瘤、肾细胞癌的部分和完全缓解率分别可达50%、37%、26%、24%、20%、17%、16%。1989年Rosenberg总结了单独使用rIL-2治疗的130例肿瘤患者,对于黑色素瘤、肾细胞癌的有效率分别为24%和22%,对其他肿瘤无明显疗效。骨髓移植配合低计量IL-2皮下注射可降低血液恶性肿瘤的复发率。有关细胞因子联合应用(rIL-2+rIFN-α、rIL-2+rTNF-α),以及联合化疗治疗肿瘤的结果尚不统一,既有协同增强疗效的结果,也有无差异的结果。G-CSF和GM-CSF对于肿瘤患者主要用于化疗所至粒细胞减少和骨髓移植,目前GM-CSF还用于DC的扩增以及协同瘤苗使用。IL-1是天然的内热源、TNF-α又是恶质素,临床实验不良反应较高,基础研究表明两者也有促进某些肿瘤发展或转移的作用。一般认为,IL-12是较好的抗肿瘤免疫因子,临床研究显示其具有抗肿瘤疗效,但是还没有使人感到惊奇的结果。IL-15和IL-18是有潜在的临床应用前景的新细胞因子,有待于进行临床研究。
(三)基于抗体的免疫治疗
生物导弹是一个理想的思路,应用毒素、放射性同位素、化疗药物与肿瘤相关抗体连接由静脉注入体内,使药物集中于瘤内,既增强疗效又减少对机体的毒副作用。但是体内实验与理想的结果差距较大,关键问题是抗体与正常组织的交叉反应,以及鼠源单克隆抗体在人体内易产生人抗鼠Ig的抗体。对于后者人们通过基因工程方法构建单链抗体,它比抗体分子小6倍,易于进入瘤组织,削弱了免疫原性。根据4-1BB/4-1BBL共刺激通路,应用抗4-1BB抗体在小鼠体内可直接活化T细胞,根除某些已种植的大肿瘤,此方法尚需进一步扩大研究。抗erbB-2癌基因产物抗体以及抗血管生成因子(VEGF)抗体作为生物药品已进入市场,配合化疗用于抗肿瘤治疗,获得较好疗效。
(四)免疫基因治疗
体内注射大剂量重组细胞因子时可获得一定疗效,但是也可以产生严重的毒副作用,如IL-1、IL-2、TNF-α、IFN。采用细胞因子基因导入免疫效应细胞(如TIL),虽然分泌量不大却能提高体内抗肿瘤免疫效应。也有将细胞因子、共刺激分子等基因,通过重组病毒、脂质体、基因枪直接导入体内的肿瘤组织中进行表达,其中包括多基因导入,本质是利用原位肿瘤诱导抗肿瘤免疫,该方法简便、经济。如将异体HLA-B7/β2-微球蛋白基因经阳离子脂质体包裹后,注射于黑色素瘤局部,在4个Ⅰ期临床研究中36%产生作用,19%诱发全身抗肿瘤反应,但对于其他肿瘤临床效果不明显。也有将细胞因子基因导入正常细胞(如纤维母细胞),或将裸基因直接肌肉注射或通过基因枪导入体内,并持续表达细胞因子,免除体内反复注射细胞因子。在已种植肿瘤的小鼠模型中,应用基因枪将IL-2、IL-4、IL-6、IL-12、IFN-γ、TNF-α或GM-CSF导入表皮细胞,其中以IL-12最为有效。美国匹兹堡大学癌症研究所,用IL-12基因转染的人成纤维细胞注入体内,在33例肿瘤患者中12例在2~3个月内肿瘤明显缩小。
(五)肿瘤疫苗
肿瘤疫苗是主动免疫的主要内容,分为细胞瘤苗、亚细胞瘤苗、分子瘤苗和基因瘤苗四种类型。
1.细胞瘤苗细胞瘤苗是一种最古老的瘤苗,但仍有优越性,因为自体肿瘤细胞包容了所有自身肿瘤抗原。早期的细胞瘤苗只将肿瘤细胞用射线或化疗药物灭活,一般只配合佐剂卡介苗(BCG)使用,临床效果参差不齐,远期疗效多数不理想。90年代初,Schriimacher应用禽类新城鸡温病毒(NDV)处理自身瘤细胞瘤苗已在临床上沿用至今,在小鼠淋巴瘤模型中NDV瘤苗可防止50%的肿瘤转移,临床研究中亦明显延长了生存期。应用NDV起到了较好的佐剂效应,对人体无不良反应。近期正在研究NDV细胞瘤苗结合双功能抗体(抗NDV上的凝血素神经氨酶HNx CD28、HN xCD3)的抗肿瘤效果。近年转基因细胞瘤苗研究较多,其中转导的基因包括IL-1、IL-2、IL-4、IL-6、IL-7、IL-12、TNF-α、G-CSF、GM-CSF、IFN-γ基因及共刺激分子(B7-1、B7-2、)基因、同种异体抗原(HLA-B7)基因等。因肿瘤和宿主的情况不同,以及方法学的差异,结果不一致,其中IL-2、IL-12、GM-CSF、HLA-B7基因转导的瘤苗效果相对较好。另一策略是去除肿瘤的免疫抑制,提高免疫效果。如应用IL-2基因和TGF-β反义基因联合导入的肿瘤疫苗能有效激活免疫系统和抑制肿瘤生长。采用APC细胞(B细胞、DC)与肿瘤细胞融合相当于多基因转导,可弥补肿瘤细胞中抗原呈递功能的缺陷,补充了共刺激分子。用该融合细胞免疫动物可治愈已形成的亲代肿瘤。我国学者用GM-CSF基因转导的DC与肿瘤细胞融合免疫效果更佳。
2.亚细胞瘤苗细胞瘤苗必须经过可靠的灭活才能用于免疫,否则会产生种植。从实体瘤分离完整的细胞需要用酶进行消化,得率较低;而直接裂解细胞,获取细胞粗提成分极为简单,进入体内也更安全。如应用同种异体黑色素瘤细胞裂解物在Ⅰ、Ⅱ期临床研究中客观反应率达20%,长期存活达8%。国内学者应用IL-2基因重组痘苗病毒转染小鼠黑色素细胞瘤,将其裂解的沉淀物作为瘤苗治疗荷瘤鼠,明显延长了生存期。近期发现DC分泌的exosomes(外泌小体)属于亚细胞结构,具有多种抗原呈递分子和T细胞共刺激分子。肿瘤抗原肽刺激的DC产生的exosomes能够呈递肿瘤抗原,活化CTL,抑制和根除已建立的小鼠肿瘤,所以exosomes瘤苗极具发展潜力。
3.分子瘤苗伴随着肿瘤抗原、抗原呈递、T细胞识别机制研究的突破性进展,分子瘤苗发展极快。根据抗体与抗原的影响关系,制备抗体独特型的抗抗体,作为独特型瘤苗,在临床上也见到一定疗效。为增强免疫效果将抗体与大分子载体(KLH等)偶联,以及与免疫增强因子合用更为有效。肿瘤抗原小肽用酸性液体可从肿瘤细胞上洗脱,再用APC(B细胞、DC)处理,后者在体内外均可诱导显著的抗肿瘤免疫作用。富集小肽的DC在体内用量小而效率高。对已知序列的抗原小肽可用人工合成方法获取,溶于DMSO溶剂中直接注入体内可诱导抗肿瘤免疫反应。但是,也有实验表明,单纯注入肿瘤抗原肽可诱导免疫耐受,促进肿瘤发展。用DC呈递这些小肽,可获得较好的免疫效果。国外一研究组用多种抗原肽或肿瘤提取物处理DC治疗16例黑色素瘤,其中11例出现肿瘤抗原特异的迟发超敏反应(DTH),2例部分缓解,3例完全缓解。对于激素治疗无法控制的33例前列腺癌,应用HLA-A2限制性前列腺特异的膜抗原PSM-P1和PSM-P2处理的DC治疗后,阳性反应率为30%,其中6例部分缓解,2例完全缓解。有效率达24%。肿瘤抗原肽可以产业化生产,不会有肿瘤种植的危险,不存在肿瘤细胞的抑制成分。其缺点是此类抗原肽是受MHC限制的,MHC-Ⅰ分子相同的患者才能用同一种小肽,并且已知抗原肽尚少。随着T细胞识别肿瘤抗原表位的不断发现,合成肽疫苗的应用会不断扩大。肿瘤细胞内的HSP(HSP70、HSP90、HSPgp96)参与抗原的加工处理,它们结合了所有的肿瘤抗原肽。将结合肿瘤抗原肽的HSP提取后,作为瘤苗可活化肿瘤特异性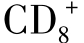 CTL,产生抗肿瘤作用。由于HSP不具多肽性,因此这种疫苗不受MHC限制。也有人证实,从肿瘤中纯化的HSP70或HSP70高表达肿瘤免疫后,在体外可扩增出大量高杀伤活性的
CTL,产生抗肿瘤作用。由于HSP不具多肽性,因此这种疫苗不受MHC限制。也有人证实,从肿瘤中纯化的HSP70或HSP70高表达肿瘤免疫后,在体外可扩增出大量高杀伤活性的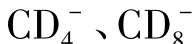 、TCRgd+T细胞。此杀伤细胞不受MHC限制,正常细胞的HSP70则不能产生该反应,所以它们识别的是HSP70与抗原复合物。由于肿瘤不表达或低表达MHC-Ⅰ、Ⅱ类分子,因此HSP-多肽复合物诱导抗肿瘤免疫备受关注。
、TCRgd+T细胞。此杀伤细胞不受MHC限制,正常细胞的HSP70则不能产生该反应,所以它们识别的是HSP70与抗原复合物。由于肿瘤不表达或低表达MHC-Ⅰ、Ⅱ类分子,因此HSP-多肽复合物诱导抗肿瘤免疫备受关注。
4.基因瘤苗基因瘤苗在临床研究中也初见端倪,以往认为不能作为肿瘤排斥性抗原的CEA,将其基因插入痘苗病毒进行体内免疫可以诱导CTL杀伤CEA阳性的肿瘤细胞。把已知T细胞识别的肿瘤抗原小肽基因串联在一起,插入病毒载体,也是一种较好的瘤苗方式。用癌基因erbB2/neu质粒DNA免疫小鼠可将降低erbB2/neu高表达肿瘤的生长和转移。基因疫苗有以下优点:①基因疫苗在体内可以不断产生抗原刺激免疫系统;②易于诱导CTL;③基因疫苗不与染色体DNA整合,使用安全;④摄入DNA不能使宿主产生抗DNA抗体;⑤可大量生产,不需低温保存。缺点是目的基因表达水平不理想;长期低水平表达抗原可能引起免疫耐受。目前研究表明,单纯肿瘤抗原基因或肿瘤抗原肽直接体内免疫,均不如导入DC和富集于DC后作为瘤苗效果好。
