骨转移
第四十九章 骨转移
随着肺癌患者生存期的延长和诊断方法、诊断技术的提高,肺癌骨转移患者的诊断日渐增多。ECT、CT、MRI、PET不但有助于早期发现骨转移瘤,而且对病变的部位、大小及其与周围组织、器官的关系均能清楚了解。Ahzams统计1 000肿瘤患者的转移情况,并分析骨转移肿瘤的来源,肺癌占32.5%。从理论上来说任何恶性肿瘤都可能发生骨转移,但临床统计多少不一。对易发生骨转移者,有人称之为亲骨性肿瘤,肺癌就是其中之一,而皮肤癌、食管癌、结肠癌等较少发生骨转移。肺癌主要经血循环转移至血管丰富的骨髓,或肿瘤直接侵入邻近骨组织为直接侵犯。文献报告,骨转移瘤发生于脊柱者占80%,股骨者占40%,肋骨及胸骨为25%,颅骨及骨盆为20%,肩胛骨9%,膝、肘以远很少发生,约占2.6%。一般恶性程度越高、年龄越小、发生转移越早。最短者可在术后1~2个月内,有的发生病理骨折后才发现,最长者可达数十年。
患者发生骨转移后,虽然内科治疗已难以治愈,但是早期确诊和及时正确处理,对缓解疼痛、预防骨折、抑制肿瘤发展、提高生活质量等方面是有益的。
一、临床表现
疼痛是最主要的症状,包括生物学和力学两个方面的原因。生物学方面是由于骨的特殊结构,骨转移首先发生于骨髓腔内,一旦髓腔内压>6.67 kPa就可以造成骨痛,这种转移所致骨痛一般随病程而逐渐加重。骨转移瘤局部释放的肿瘤相关因子使破骨细胞活性增高,形成溶骨性骨质破坏,肿瘤分泌前列腺素、乳酸、IL-2及肿瘤坏死因子等一些疼痛介质及肿瘤侵犯骨膜、周围神经、软组织可导致剧烈疼痛,其中破骨细胞的激活起了关键的作用。力学方面主要是因为肺癌骨转移导致的功能障碍性疼痛。另外,肿瘤细胞可迅速直接吸收骨,也可通过骨降解酶的分泌直接破坏骨。最终,骨骼的损伤使其强度和硬度下降,导致了活动性相关症状,又称“功能性骨痛”。功能障碍性疼痛常在消肿治疗后加重。还可能会发生骨质压缩和脱臼,这常见于脊柱病灶的治疗中。骨转移最初的疼痛情况与原发性骨肿瘤和骨坏死类似,呈间歇性的隐痛或钝痛,也可能是剧烈刺痛,夜间疼痛加重,活动后可能部分缓解。随着病变的进展,症状变得持续,并且可有局部肿胀、肿块、压痛、功能障碍,出现病理骨折等。
脊柱转移瘤多数无症状,骨质破坏从椎体到附件,当肿瘤侵出皮质进入软组织压迫神经出现相应的症状。胸椎段椎管最细,脊髓最粗,易发生压迫症状,如截瘫。脊髓受压发生水肿和白质微小变性,可发生局限性疼痛,逐渐加重,可长达数周至数月,并有叩根触疼、病理骨折有成角畸形、肿瘤破入椎管压迫脊髓、脊髓受侵和癌性脊膜炎。疼痛常位于病灶平面下方,不易定位。从肢体无力到完全麻痹的时间可以影响预后。大约1/4的患者<48 h,其预后极差;3/5的患者7~10 d,预后中等;约10%的患者>1月,预后良好。如果膀胱与肛门括约肌完全失控,其预后较差。
肢体骨转移瘤患者大约有10%可发生病理骨折,主要在下肢,股骨占61%,而转子部要占其80%。
高钙血症可累及许多器官、系统,临床上表现腹痛、顽固性呕吐、极度衰弱与严重脱水,急性肾功能不全,病情继续发展,可致昏迷,甚至死亡。
二、实验室检查
(一)碱性磷酸酶的测定(ALP)
骨骼有改变时,成骨细胞内所含高浓度的ALP释放于血液中,引起血清ALP活性升高,骨转移时特别是广泛骨破坏就可以有这种变化。黄攸生报道,骨转移时ALP不正常者可达57.5%,但应与纤维性骨炎、成骨不全、骨折等鉴别。骨转移患者血清ALP值可比正常高几倍甚至数十倍,当然,ALP不高并不能排除骨转移。
(二)血清钙的测定
肿瘤骨转移其骨骼的变化多是以溶骨性改变为主,可释放出大量的钙和磷,因超出正常的肾排出浓度,故患者的血中可有钙、磷的增高。国外报道,高血钙的发生率为15%~20%。但相比之下,国内骨转移时高血钙的发生率并不高。国内一组Ⅲ期临床试验报告显示,446例骨转移的患者中,血钙高于正常者仅2例(0.47%)。这种国内外血钙检验的明显差异,其原因可能是我们忽视了对晚期肿瘤患者血钙的检查,但是真正原因仍有待于进一步研究。高钙血症是一种可能危及患者生命的严重并发症。按血钙升高的水平高可将高钙血症分为轻度、中度和重度三类,轻度高钙血症为血总钙值2.75~3 mmol/L,中度为3~3.5 mmol/L,重度>3.5 mmol/L。当血钙水平≥3.75 mmol/L时称为高钙危象。
(三)尿NTx的测定
尿Ⅰ型胶原交联氨基末端肽(NTx)等骨代谢标志物对骨转移诊断及病情监测有一定的应用前景,但是目前该类指标尚不能作为骨转移诊断的可靠方法。
(四)其他
血红蛋白降低、红细胞减少;血沉增快;血清球蛋白增高;白蛋白与球蛋白比值倒置等,无特异性。
三、影像学检查
(一)普通X线检查
X线平片是骨转移诊断最基本和最主要的方法,特异性高,但敏感性低,仅44%~50%。当骨小梁破坏达50%以上,并且直径达1.0~1.5 cm时,才可能形成在X线平片上可见的骨转移灶。
X线表现可有溶骨性、成骨性及混合性,其中以溶骨性破坏为多。肺癌多为溶骨性,前列腺癌多为成骨性;乳腺癌一般以溶骨为主,有时溶骨和成骨可同时存在。溶骨表现不一致,常大小不一,边界模糊,骨皮质也可受侵及,形成虫蛀样、穿凿状骨质缺损,界限不清楚,边缘不规则,周围无硬化。溶骨区内可见残留骨小梁、残留骨皮质,无骨膜反应。很少出现骨膨胀、骨膜反应及软组织肿块。骨转移肿瘤可为单发或多发。常有病理性骨折。椎体受侵犯后使椎体变扁平或楔形压缩,但相邻椎间隙保持正常。成骨性骨转移肿瘤表现为圆形或不规则致密影,边界不清,骨小梁紊乱、粗糙。成骨性破坏呈斑点状、片状致密度增高,甚至为象牙质样,骨小梁紊乱、增厚、粗糙、受累骨体积可增大。混合性骨转移兼有成骨和溶骨两种阴影。
虽然,骨转移可在X线平片上具有典型征象,对诊断帮助很大,但这种改变常见于骨转移的晚期,因为只有引起钙丢失达到30%~50%时,X线才可发现骨转移的典型骨破坏。因此,X线平片不能作为骨转移早期诊断的手段。但是由于X线检查的影像空间分辨率高,应用范围广泛,操作简便,价格低廉,辐射量比较小,因此X线检查仍然是诊断骨转移的主要检查方法。
(二)CT
CT扫描也是确诊恶性肿瘤骨转移的诊断方法,对骨转移的诊断有着特殊的作用,其诊断灵敏度高于X线片,且比X线平片更易决定其确切的病变范围。不仅如此,它还可以确定某些X线平片未能显示的病变部位,帮助临床寻找原发灶。对于需要骨活检的病灶,CT引导下病变处穿刺活检,可提高骨转移病灶穿刺活检率,提高穿刺部位的准确性及操作的安全性。
(三)MRI
MRI扫描是目前诊断骨转移敏感性和特异性均较高的诊断方法。MRI扫描诊断骨转移的敏感性为82%~100%,特异性为73%~100%。它可以直接做冠状或矢状面相,显示病灶大小范围和与周围组织器官的关系,估计其与关节、血管、神经的关系,显示骨髓腔内病变及其范围,并可较早的发现骨转移。由于MRI具有高分辨率和直接多平面成像能力,因此,它显示骨转移的病变情况比X线平片和CT更为准确,对X线平片上有骨转移怀疑者可直接进行MRI检查。但是由于影像学检查确诊骨转移的可靠指标是骨破坏,而MRI检查不是判断骨破坏的最可靠方法,因此专家组对MRI用于骨转移确诊检查存在争议。
(四)骨扫描
放射性核素骨显像检查,在发现隐匿性骨损害和骨转移瘤的诊断中具有极大的价值。目前,临床应用较多的是99mTC-MDP。骨显像虽具有敏感性较高的特性,但假阳性率亦较高,对鉴别良恶性骨病变的特异性仅为61%。
骨显像的最主要的优点是在发现骨病变上有很高的敏感度,能在X线检查或酶学试验出现异常前更早的显示骨病变的存在。当骨矿物质脱失达30%时,普通X线才能发现,而骨扫描可以较早的发现病灶,不容易漏诊。骨显像假阴性比较低,通常在3%以下。可以描绘病灶大小,指导手术,计划切除范围。放疗过的骨可表现为同位素显影减低区。
骨显像可以评价肺癌骨转移瘤放化疗后的疗效。大约有15%以上的患者在治疗后最初的ECT显示病变放射性浓集增加了,又称“闪烁现象”,这反映了静止病灶周围形成了新骨。以后随着时间的推移,周围的新骨的生长,成骨细胞的活跃,病灶骨放射性浓集逐渐减轻。
其最大缺点是特异性不高,除能较敏感的早期证实和显示骨受损的区域外,难以从骨显像图上对孤立性局限性放射性增高区得出肯定的判断。为了提高骨显像对良恶性骨病变的鉴别率,国内有学者用地塞米松介入延迟骨显像的研究,据称对鉴别良恶性骨肿瘤有较大的实用价值。
(五)PET-CT扫描
PET-CT扫描是正电子发射计算机断层显像(PET)与电子计算机体层摄像(CT)相结合的影像学新技术,一次成像既可获得PET图像,又可获得CT图像。PET显像通过检测局部葡萄糖代谢活性变化而发现肿瘤病灶。因此,PET-CT能较灵敏显示骨髓微转移灶,早期诊断骨转移病变。PETCT扫描可以同时检查全身器官、淋巴结以及软组织,以全面评估肿瘤病变范围。PET-CT诊断的敏感性达62%~100%,特异性达96%~100%。PET-CT扫描诊断骨转移及全面评估肿瘤病情有特殊的优势,但由于检查费昂贵,因此不推荐作为常规检查方法。
四、骨活检
组织病理学或细胞病理学检查,是确诊恶性肿瘤骨转移的可靠方法。对于原发灶未获得组织学或细胞学诊断的患者,骨活检有确诊意义。活检指征:影像学诊断依据不够;单一骨病变;骨病变的确诊决定治疗策略;以骨病变为首发症状的骨转移癌;任何有疑问的骨病变,患者要求确诊。骨活检应注意避免病理性骨折的危险。
五、治疗原则
根据肺癌的特点,患者的机体状况,以及对药物、放射的敏感程度,制定治疗策略。原则上应包括原发灶、骨转移病灶及其所产生的合并症的治疗,以药物治疗为主。
(一)止痛治疗
肺癌骨转移瘤患者最主要的症状是疼痛,所以要适当应用止痛剂。一般按三阶梯止痛原则给药(详见有关章节)。中药活血化瘀、理气止痛及安神定志等,能通经活络,减轻痛苦,可按辨证论治原则选用。皮质类固醇激素对许多骨转移癌痛有良效,但要注意应用剂量与时机。
(二)放射治疗
放射治疗在骨转移瘤治疗中的最大作用是缓解和控制骨疼痛,能减少麻醉药类止痛剂的用量。放射治疗可明显控制局部病变发展,减少病理性骨折的发生,减轻肿瘤对脊髓的压迫等。有效的放射治疗可明显改善肺癌骨转移患者的生存质量,但对延长生存期作用不大。因此,在设计治疗方案时,应以最少合并症和最简单的方法为原则。
放疗止痛的生物学效应尚不清楚,可能与杀灭肿瘤细胞,或作用于肿瘤细胞或宿主细胞,使之产生或释放疼痛控制物质有关。而短时治疗能给患者最小干扰,减轻患者的经济负担,并能迅速达到最大剂量来缓解疼痛和减少疼痛的出现频率。放疗1~2次后疼痛好转不明显或加剧者,可能与放疗后组织充血水肿有关,以后会逐渐缓解。一般在放疗开始后的1~2周内出现疼痛缓解,3个月内将使的90%的疼痛缓解。放射治疗缓解骨痛的有效率为59%~88%。方法包括体外照射、放射性核素治疗。
1.体外照射体外照射多用于单发的骨转移瘤,对于多发性骨转移宜综合其他方法。所以估计骨转移瘤范围很重要,了解单发还是多发,不能单靠推测进行诊断而实施放疗。应用ECT来区别多发与单发,使用CT及MRI明确肿瘤的范围大小和周围软组织的关系。单发者应给予积极治疗。疼痛缓解从侧面反映了放疗疗效。
体外照射的主要适应证为有骨疼痛等症状的骨转移灶,用于缓解疼痛及恢复功能;选择性用于负重部位骨转移的预防性放疗,如脊柱或股骨转移。
骨转移姑息性放射治疗的体外照射常用剂量及分割方法有三种方案:300 cGY/次,共10次;400 cGY/次,共5次;800 cGY/次,单次照射。
骨转移瘤放疗还应注意放疗并发症的发生,如急性放射性肺炎、肺实变、骨髓抑制,放射性脊髓病等,但是发生率比较很小。另外,放射性骨炎、病理性骨折、骨坏死等并发症虽然很少见,但很难预测且很难避免其发生。放射性股骨头颈坏死,不完全决定于放射剂量和治疗方法,主要是由放射性脉管炎或继发性股骨头末端小动脉的阻塞造成。放射性骨炎除骨血管异常外,也可能由于放射所致骨细胞或成骨细胞坏死,严重者可有破骨细胞重吸收与溶骨性骨转移相混淆,区别它们很重要。一般的骨是对放射选择耐受的,在剂量达到7 000 cGy时,开始发生坏死、骨折、感染;低剂量3 000~4 000 cGy的照射,可使骨有很好的恢复能力。放疗可引起病理骨折,即使在放疗的早期(放疗时间4~5周,总剂量4 000 cGy的前10 d),骨发生充血变软增加骨折的可能。因此,放疗开始前受累骨应做预防性内固定。对已出现病理骨折者提倡先行内固定,术后2~3月后开始放疗,近期放疗可影响伤口愈合并增加感染。
2.放射性核素治疗,也称内放疗骨转移瘤大多是多发病灶,注射亲骨肿瘤的放射性核素药物浓聚在多发病灶部位,进行体内辐射治疗骨转移目前已经普遍应用于临床。该法能有效地减轻疼痛,减少止痛剂的应用,提高生活质量,还可减少骨损害。自40年代以来,相继应用放射性核素有锶(89Sr)、磷(32P)、碘(131I)、钇(90Y)、铼(186Re)、钐(153Sm)等标记物。80年代初期,众多学者筛选出的一批具有良好核物理性质的、具有较高生物杀伤力的放射性核素(β辐射体或β、γ辐射体),并将这些核素与磷(膦)酸盐载体结合,使其能选择性地浓集在骨转移瘤处,由核素发出的(γ、β)射线杀伤肿瘤细胞。目前,较常用的内放疗药物89Sr(锶)和153Sm(钐)-EDTMP(乙二胺四亚甲基膦酸)等。153Sm-EDTMP在国内用的最广泛,EDTMP是乙二胺四亚甲基磷酸盐,起载体作用,153Sm-EDTMP优点是制备方便,价格便宜,几乎无副作用,可多次使用,不仅能起到缓解疼痛的目的,还能破坏肿瘤本身。
1.153Sm-EDTMP153Sm具有较好的核性质,半衰期46.27 h,β射性能量640、710、810、103 KeV的γ射线。β射线可直接或通过电离辐射作用间接杀伤肿瘤细胞,缓解疼痛和治疗肿瘤。此外,γ射线103 KeV适用于进行体外显像,可以显示药物在全身骨转移瘤处的定位,及了解用药后骨转移瘤病灶骨髓吸收剂量,一般肿瘤与正常骨摄取比为5~8∶1。153Sm-EDTMP的载体EDTMP与骨转移灶的亲和力比正常骨高16倍,其半衰期为46.6 h,可以大剂量反复给药,并对骨肿瘤组织中的破骨细胞有抑制作用。注射153Sm-EDTMP后,58%~66%可浓集于骨骼,非骨组织分布不到2%。国外报告,该药对骨转移的有效率为80%;国内施伟等用该药治疗156例骨转移患者,骨痛完全缓解率为33.3%,部分缓解率为51.9%,无效的14.7%,总有效率达到85.2%。
2.89Sr(锶)亦具有亲骨性,对骨转移有较好的效果,有效率可达73%,且骨痛缓解快,多在治疗后24~48 h产生疗效,可维持1~4个月。一般用量为按每公斤体重1 MBq计算,用89Sr治疗骨髓抑制较轻,少有白细胞和血小板下降的报道,个别患者用后可有ALP的升高,这部分患者骨痛缓解也较明显。
3.其他放射性核素还有其他一些放射性物质用于骨转移的治疗,如186Re(铼)、磷(32P)、碘(131I)、钇(90Y)等。(https://www.daowen.com)
放射性核素治疗的适应证:①临床、病理、X线、骨扫描确诊为骨转移。②白细胞>3.5×109/L,血小板>90×109/L。③骨转移瘤所致的剧烈骨痛,经化疗和放疗无效者。
禁忌证:①刚进行过细胞毒素治疗的患者。②化疗或放疗出现严重骨髓障碍者。③骨显像显示转移瘤仅为溶骨性冷区,且呈空泡者。④严重肝、肾功能障碍者。
下列情况可以反复使用:①骨痛未完全消失或有复发。②第一次治疗反应好,效果明显,但未达到红骨髓最大吸收剂量。③虽达到红骨髓最大吸收剂量,间隔1个月后,血象变化不明显者(白细胞>3.0×109/L,血小板>80×109/L),为达到肿瘤消退的目的可以重复使用。但国外89Sr用得较多,它的β射线能量较高为1.46 MeV,半衰期较长达50.5 d,其特点是在反应性骨组织中浓聚和存留时间较长,且价格较高,对患者不易进行第2次治疗,不能对病变组织作出定位和了解其生物学分布情况。
(三)化学治疗
对肺癌有效的化疗药物,对肺癌骨转移灶的疗效并非十分理想,但可对控制原发灶的发展会起到一定的抑制作用,从而可改善患者一般状况,提高生活质量。用药方式主要是联合方案全身化疗,具体化疗方案详见各有关章节。
(四)双磷酸盐类药物的应用
在正常生理状态下,人体骨骼的完整借助于破骨细胞进行骨溶解,成骨细胞诱导新骨形成维持动态平衡。恶性肿瘤可通过体液因子或破骨细胞激活因子,使破骨细胞活性增强,破坏了正常骨代谢与平衡。
骨转移瘤破坏骨骼的途径有:①肿瘤细胞直接破坏骨的矿物性基质;②间接刺激破骨细胞,增强骨溶解,使其骨代谢的动态平衡受到破坏。
双磷酸盐是内源性的焦磷酸盐类似物,能够抵抗水解,并允许另外两条不同结构的侧链的连接。其中一条侧链通常包括部分羟基,可使钙离子晶体与骨质无机物高度亲和;另一条侧链的差别使不同的双磷酸盐抗骨吸收的能力不同。双磷酸盐与骨有高度亲和力,并能优先被转运到骨形成或吸收加速的部位,选择性的沉积到破骨细胞的下面,牢固地吸附在骨小梁的表面,形成一层保护膜,阻止破骨前体细胞吸附于骨及随后被转化成为成熟的破骨细胞。当发生骨吸收时,就会被破骨细胞摄取,使破骨细胞难以达到骨质引起骨吸收,各种活性降低,表现为乳酸的生成减少,溶酶体活性降低,前列腺素生成减少。在形态学方面,破骨细胞内溶酶体减少,破骨细胞褶皱边缘收缩,即使结合到骨的表面也丧失了吸收骨的能力。吞噬了含双磷酸盐骨质的破骨细胞可以死亡。由此抑制了破骨细胞对骨小梁的溶解和破坏,因此,能阻止肿瘤引起的溶骨性病变、减少骨吸收、减轻疼痛及由骨转移所致的高钙血症及其他并发症。目前还认为,肿瘤细胞导致骨质破坏,而破坏的骨质释放的细胞因子或生长因子又能刺激肿瘤细胞的活性和生长。双膦酸盐类药物能阻断这种作用,减慢骨转移的发生和发展,并可导致某些肿瘤细胞的死亡。
第一代双膦酸盐类药物羟乙膦酸钠(Etidronate)、氯屈膦酸钠(Clodronate骨膦),第二代双膦酸盐类药物帕米膦酸钠(Pamidronate阿可达、博宁),这类药物可以改善肺癌骨转移的疼痛、控制病情、预防骨转移并发症并且提高生活质量。第一代双膦酸盐类药物不宜长期使用,现已逐渐被疗效更强、在骨化上无副作用的第二代双膦酸盐类药物所替代。第三代双膦酸盐类药物Bondronat(Ibandronate帮乐力、艾本)和唑来膦酸能显著降低骨转移瘤患者的高钙血症,降低尿钙的吸收,并可增加骨矿密度,减少骨代谢紊乱。目前还可用于治疗绝经后妇女骨质疏松。更新一代的双膦酸盐类药物英卡膦酸二钠(Incardronate)国内正在进行临床研究。
常用于骨转移治疗的双磷酸盐药物的用量与用法如下:氯磷酸1 600 mg/d,口服;或氯磷酸盐注射液300 mg/d,静脉注射,>2 h,连续5 d,之后改为口服制剂。帕米磷酸90 mg,静脉注射>2 h,每3~4周重复。唑来膦酸4 mg,静脉注射>15 min,每3~4周重复。伊班磷酸6 mg,静脉注射,每3~4周重复。
在双磷酸盐类药物的应用过程中应注意以下几个问题:①双磷酸盐类药物对肿瘤患者的总生存率没有影响,对证实有明确骨破坏的患者应用双磷酸盐类药物对减少由于骨转移引起并发症有一定好处。主要是减少骨骼并发症如病理性骨折、骨折或脊髓压迫症、高钙血症。②美国临床肿瘤协会建议,对经影像学检查证实有明确骨破坏的患者,应用双磷酸盐类药物;对仅有骨扫描异常,而无影像学确诊的骨破坏,或无局部疼痛的患者,没有充分理由建议应用这类药物;对没有骨转移的患者,即使出现骨外其他器官的转移,也不应使用双磷酸盐类药物。对仅有骨扫描异常而无X线片、断层X线片、CT或MRI证实有骨质破坏且无局部疼痛的患者,此类临床情况尚未经研究,并将是临床研究的新热点,目前不赞成使用双磷酸盐。③双磷酸盐在辅助治疗方面作用的研究结果尚不一致。对于任何期别的非骨性病变,无论其将来出现骨转移的危险性有多高,目前均不推荐应用双磷酸盐。双磷酸盐在辅助治疗预防骨转移方面的研究很多,但结果却很不一致。部分研究证实双磷酸盐类药物对骨转移有预防作用,但有些研究却得出了相反的结果,因此双磷酸盐辅助性治疗的好处尚不能确定,同时疗程也不清楚。④可用于多发性骨髓瘤的治疗。口服双磷酸盐可作为骨质疏松症的治疗。⑤双磷酸盐的应用还不能代替目前癌痛的标准治疗— — —止痛药物和局部放疗。由于在对照研究中发现,双磷酸盐对疼痛有轻度控制作用,因此对于全身治疗或放疗后仍有疼痛的患者应用双磷酸盐类药物。
双磷酸盐类药物有较好的耐受性,其主要不良反应为体温增高、流感样症状、一过性疼痛、胃肠道反应、一过性肌病、关节病等,偶有注射部位的轻度反应。很少有患者因不良反应而中断治疗。未见到有长期的不良反应。
对于多数有明确骨转移的癌症患者,双磷酸盐类药物可提供有意义的支持治疗。进一步的研究应明确何时开始和停止治疗的临床指征,用药的疗程,明确其作为辅助治疗在预防骨转移中的作用以及与其他方法综合治疗骨转移的应用。
(五)手术治疗
骨转移瘤一般不采用手术治疗。但是在骨转移瘤的综合治疗中,非手术治疗有时难以达到确定的疗效,手术治疗可以发挥其特殊的作用,特别是骨转移瘤引起的病理性骨折、脊柱不稳、脊髓压迫和疼痛。如果患者一般状况良好,原发瘤可切除,在某些特殊情况下可采用手术方法。对缓解病情,提高患者生活质量,预防骨折和瘫痪亦是必要的。
对肢体骨转移瘤可以考虑手术治疗,但应掌握好以下适应证:①肢体骨病理性骨折;②X线显示>50%骨皮质被破坏;③股骨转子部位骨缺损>2.5 cm;④放疗后仍有应力性持续性疼痛,且估计患者生存期>6周者。手术前后需要配合化疗药物。早期发现骨破坏时,就应选择合适的时机进行预防病理骨折的治疗。如骨壳破坏不大者,可用闭合性髓内针技术;破坏广泛者应切开清除肿瘤,填塞骨水泥和内固定。Mirels对骨转移瘤的部位、疼痛的程度、破坏的性质及大小等情况,对濒临病理性骨折的骨转移瘤进行了综合定量分析(表4-49-1)。其认为评分≤7分时骨折的可能性较小,可行非手术治疗(即治疗前不必做内固定);如评分≥8分时,则骨折的可能性较大,应先做内固定,以防止病理性骨折的发生,然后再行非手术治疗。手术方法可根据不同的部位和病灶范围,选取相应的治疗方法。对于四肢骨干骨折,最适宜的方法是采用交锁髓内钉内固定,术后可早期下床活动。而加压钢板内固定术,则因骨折端常有骨质缺损,难以起到加压固定的作用,且由于应力集中于钢板两端的骨质而造成再次骨折,影响术后的骨牢固度,因此已趋淘汰。股骨颈骨折可采用长柄股骨头或全髋关节置换,股骨转子部骨折用Gamma钉、Ziekel钉或重建针内固定,也可采用Rechards针内固定。上述手术过程中应将骨转移瘤病灶切除,骨缺损处可用骨水泥堵塞,骨水泥能协助内固定物固定骨折提高瘤骨的机械强度。
表4-49-1 骨转移瘤濒临病理性骨折评分表

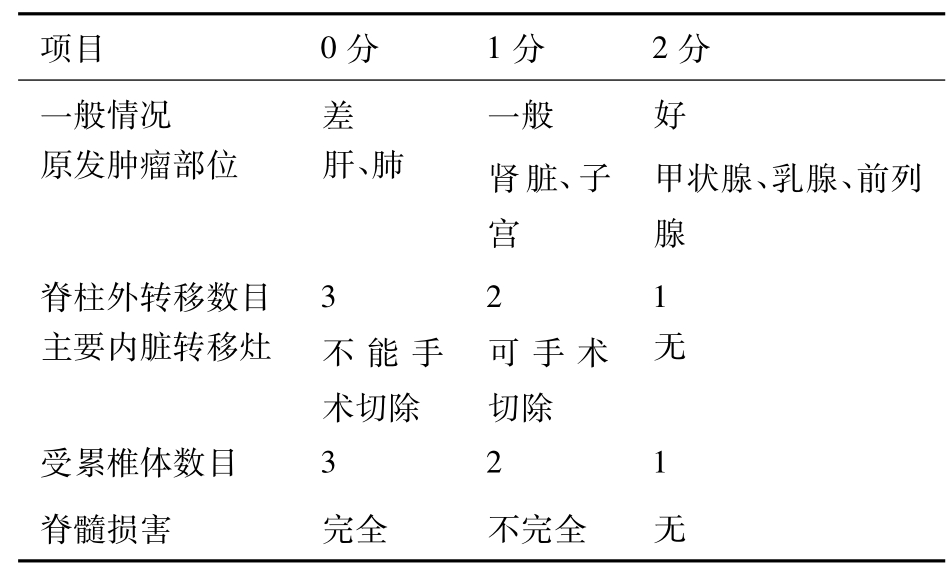
脊柱转移瘤是肺癌骨转移的常见部位,手术治疗对这部分患者是非常必要的,可起到缓解症状,稳定脊柱、改善瘫痪的作用。临床上如果发现由于骨转移瘤破坏使脊椎骨塌陷并伴有疼痛,但无明显神经损害时;椎骨塌陷或不稳,伴主要神经损害时;最大耐受剂量放疗后复发,或放疗不敏感出现神经压迫症状时均可考虑手术治疗。如前方、后方或侧前方减压术,必要时再加脊柱固定或融合术。椎体病变可以切除用植骨、人工椎体固定或用骨水泥充填固定。这样处理后甚至可以使部分瘫痪时间短的不全瘫痪者恢复功能。Enkaoua等根据Tokukashi的脊柱转移瘤的手术指征和预后评分系统(表4-49-2),综合分析了71例脊柱转移瘤患者的临床资料。表2中评分≥9分可做手术治疗,而≤5分者只能做放疗、化疗等非手术治疗。最高分12分提示预后较好,最低分为0分预后最差。根据Enkaoua等的统计,评分≥8分者存活期平均23.6个月,而≤7分者平均存活期为5.3个月。该表对手术的选择及预后有一定的参考价值。
表4-49-2 脊柱转移瘤的手术及预后评分表
骨盆是骨转移瘤的好发部位,大多数采用了非手术方法治疗;当转移瘤累及到髋臼和骶髂关节,影响患者行走时,则需手术治疗。但是骨盆手术时间长,出血多,危险性大,预计患者能存活>4个月,才进行手术。髋臼出现骨转移瘤破坏和病理性骨折后,在治疗上有其特殊性。Harrington根据髋臼病损部位不同进行分型,并采用相应的手术方法治疗。Ⅰ型为髋臼顶和内侧壁完好,髋臼下及前后方破坏缺损,可采用全髋关节置换术治疗,肿瘤切除后的缺损可用骨水泥堵塞。Ⅱ型为髋内侧壁缺损,先用骨水泥金属网填充缺损区,再通过金属杯将应力引致髋臼缘,然后再安装髋臼假体。Ⅲ型为髋臼外缘及髋臼顶缺损,可用骨水泥填充缺损处,多枚斯氏针呈扇形自髋臼外缘打入正常骨质,将应力引到正常骨质。Ⅳ型髋臼广泛破坏,但肿块能被完整切除而获得治疗者。结合术后放疗,大部分患者能扶单拐行走。当实体转移瘤能被广泛切除,而肿瘤溶骨并不明显,对骨机械强度影响较小的患者还可选取瘤骨切除高温高压灭活再植重建。
病理性骨折发生时,应行积极手术治疗。内固定治疗可以改善预后、延长寿命。有效的内固定可以止疼安定情绪、便于护理,早期活动、早期离床和进行其他治疗如放疗,可预防其他并发症。四肢长骨转移瘤发生病理骨折时,可作牵引甚至内固定,并配合药物化疗,如果转移瘤发展缓慢,骨折还可愈合。
病理骨折一般较正常骨折愈合困难,其愈合好坏决定于以下因素:①切除肿瘤时骨膜程度、骨折周围软组织血运的保存程度,采用内固定和骨水泥填充后愈合率明显提高。②骨水泥对愈合的影响是有限的,骨内膜血运可以通过与骨之间的纤维层长入,骨水泥可刺激骨愈合。③肿瘤生物学行为,生长缓慢者愈合率高。④手术、放疗后与化疗,尤其是化疗。植骨的愈合要考虑上述因素,对放疗后6个月出现病理性骨折,如果术后该病灶不再局部放疗者可以植自体骨,提高愈合率。
骨水泥的应用为骨转移瘤的外科治疗扩大了指征,提高了骨转移瘤的疗效。它具有能填充不规则空腔和立即承重的优点,尤其是对转子部骨折的治疗,可以填充内侧皮质缺损,修复内侧压力骨小梁,减少内翻倾向,同时用金属内固定物可以恢复张力骨小梁的作用,并克服旋转扭矩。Bartueci试验证明,骨水泥与金属内固定物同时应用,可大大提高股骨上端承压能力并减小骨水泥的易碎性。Ryan等对骨水泥进行生物力学测试,在尸体股骨上造成骨缺损,一组用骨水泥堵塞,而另一组不予处理,然后进行抗轴向和扭转测试,发现骨水泥堵塞组抗压力和抗扭转力分别增加50%和70%。而骨水泥并不会影响术后的放疗疗效。
骨转移瘤患者一般属癌症晚期,体质较弱,生存期又有限,所以在决定手术前考虑手术并发症(如感染、血肿和内固定松动等)的同时,又要重视熟悉影响患者预后的一些因素:①原发肿瘤的恶性程度就生物学行为决定了骨转移患者的预后,分化程度高的预后较好,肺癌骨转移确立之后一般平均生存仅10个月左右。②原发肿瘤是否得到手术根治,以及对放疗、化疗的敏感程度。③转移瘤的部位、数量及有无合并其他器官转移。Yamashita等将全身骨骼分成三区:中心区(胸、腰椎和肋骨)、中间区(颈椎、颅骨、骨盆和骶骨)及周围区(肩胛骨、股骨、肱骨和锁骨),并认为乳腺癌骨转移相应可分为三期,Ⅰ期仅局限于中心区骨骼,Ⅱ期中心区加中间区骨骼受累,而Ⅲ期则三区均累及,属终末期。而Hosono等发现,前列腺癌骨转移局限于骨盆和腰椎者预后较好,而超出以上范围者预后差。通常两处以上骨转移预后要比孤立病灶要差,而合并有其他器官转移提示肿瘤已进入终末期。④影像学表现,X线片示溶骨破坏、边界不清者预示肿瘤预后差,而肿瘤边界清晰有硬化带说明肿瘤进展慢,预后相对较好。
只有通过临床和辅助检查等了解熟知以上情况之后,我们才能对具体的骨转移瘤患者作出较全面的判断,从而选择合适的治疗手段。
(刘 波)
参考文献
1.Body JJ.Current and future directions in medical therapy:hypercalcemia[J].Cancer,2008,88(Suppl 12):3 054-3 058.
2.Rybak LD,Rosenthal DI.Radiological imaging for the diagnosis of bone metastases[J].Q J Nucl Med,2001,45(3):53-64.
3.Helms CA,Cann CE,Brunelle FO,et al.Detection of bone marrow metastases using quantitative computed tomografy[J].Radiology,1981,40(3):745-750.
4.Steinborn MM,Heuck AF,Tiling R,et al.Whole-body bone marrow MRI in patients with metastic disease to the skeletal system[J].J Comput Assist Tomogr,1999,23(1):123-129.
5.Peterson JJ,Kransdor MJ,O,Connor ML.Diagnosis of occult bone metastases:positron emission tomography[J].Clin Orthop,2003,415(10):120-128.
6.Cook GJ,Houston S,Rubens R,et al.Detections of bone metastases in breast cancer by 182FDG PET:Differing metabolic activity in osterblastic and osteolytic lesions[J].J Clin Oncol,1998,16(10):3 375-3 379.
7.Bury T,Barreto A,Daenen F,et al.Fluorine-18 deoxyglucosepositron emisson tomography for the detection of bone metastases in patients with non small cell lung cancers[J].Eur J Nucl Med,1998,25(9):1 244-1 247.
8.Ross JR,SaundersY,Edmonds PM,et al.Systematic review of role of bisphosphonates on skeletal morbidity in metastatic cancer[J].BMJ,2003,327(7413):469.
9.WHO,Achieving balance in national opioids control policy:guidelines for assessment[J].Geneva:WHO,2000,3-4.
10.Lacy MQ,Dispenzieri A,Gertz MA,et al.Mayo clinic consensus statement for the use of bisphosphonates in multiple myeloma[J].Mayo Clin Proc,2006,81:1 047-1 053.
11.Diel IJ,Solomayer EF,Costa SD,et al.Reduction in new metastases in breast cancer with adjuvant clodronate treatment[J].N Engl J Med,1998,339(6):357-363.
12.Windsor PM.Predictors of response to strontium-89(Metastron)in skeletal metastases from prostate cancer:report of a single centre' s 10-year experience[J].Clin Oncol(R Coll Radiol),2001,13(3):219-227.
13.Olea E,Riccabona G,Tian J,et al.Efficacy and toxicity of 153-Sm-EDTMP in the palliative treatment of painful skeleton metastases:results of an IAEA international multicenter study[J].J Nucl Med,2001,51:146.
14.Galasko CS.Skeletal metastases[J].Clin Orthop,1995,312:2-3.
15.Christopher JB,Thomas HT.Management of metastatic lesions of the humerus [J].Orthopedic Clin North America,2000,31(4):597.
16.Harrington KD.Orthopedic surgical management of skletal complications of malignancy[J].Cancer,1997,80(Suppl8):1 614-1 623.
