局部晚期肺癌的手术治疗
第四节 局部晚期肺癌的手术治疗
一、概述
当前NSCLC的基本治疗原则总的来说仍是早期患者争取手术治疗,中期、局部晚期患者争取以手术为主的综合治疗,晚期患者采用放、化疗的模式。随着手术技能的提高及监护情况的改善,肺癌的切除率不断提高,并发症及死亡率不断下降。术后总5年生存率已达30%~42%。肺癌的外科治疗在不断的发展提高。上世纪70年代,人们已意识到最大限度切除肺癌和最大限度保留肺组织的重要性,已开展支气管及隆突成形术;上世纪80年代,认识到淋巴结清扫在外科手术中的价值并统一了国际标准;上世纪90年代,心血管外科技术应用于局部晚期肺癌手术,实行扩大切除及心脏大血管重建;最近10年,认识到以手术为主的综合治疗能提高生存率,并进行个体化治疗。
局部晚期肺癌(locally advanced non-small cell lung cancer,LANSCLC)是指尚未发生远处血道转移,肿瘤较为局限,但已侵犯邻近的组织或器官,或伴有纵隔淋巴结或颈部淋巴结转移的患者,即主要为T4或N2或N3M0的患者(ⅢA或ⅢB期肺癌),这里肺癌指的是NSCLC。据文献报道,LANSCLC占NSCLC的60%~70%,占全部肺癌的50%左右。该患者中的一部分适合手术,而手术往往不同于常规手术方式,常需要所谓的扩大切除术。肺癌的扩大切除术是指对于无远处及广泛淋巴结转移而主要是因肿瘤侵及邻近器官的肺癌,手术切除病变及受累组织,并进行必要的器官重建的手术方式。一般包括心包内处理肺血管,肺动脉成形,上腔静脉修补或置换,心房部分切除,隆突切除重建,主动脉修补、置换,食管、膈肌、胸壁切除重建,体外循环辅助肺癌切除等。
就单纯手术技巧而论,肺癌扩大切除术最能体现外科医生的个体化水平,加之患者的个体化差异充满挑战性,使得很多外科医生对此孜孜以求、乐此不疲。应当说,肺癌的扩大切除术一直是肿瘤科医生与外科医生所争议的区域,哪些患者应当手术,哪些患者应放弃手术,作为肿瘤外科医生则应当作出很明智的决断。既不能因手术的风险而明哲保身,也不能一味追求手术技巧而忽视患者的长期生存及生活质量。该部分患者个体化差异大,外科医生个体化亦较大,同样的患者由不同的医生操作其预后可能截然不同,这就需要医生个体化的治疗策略。因此,对这部分患者的治疗,一方面应遵循一定的规范、指引,另一方面还要结合患者及医生的具体情况选择最恰当的治疗策略,以最大限度有利于患者。
国内外不少学者认为,对部分局部晚期肺癌实行肺癌的扩大切除术可提高其生存率及生活质量(见表3-24-1)。
表3-24-1 部分局部晚期NSCLC扩大切除生存概况
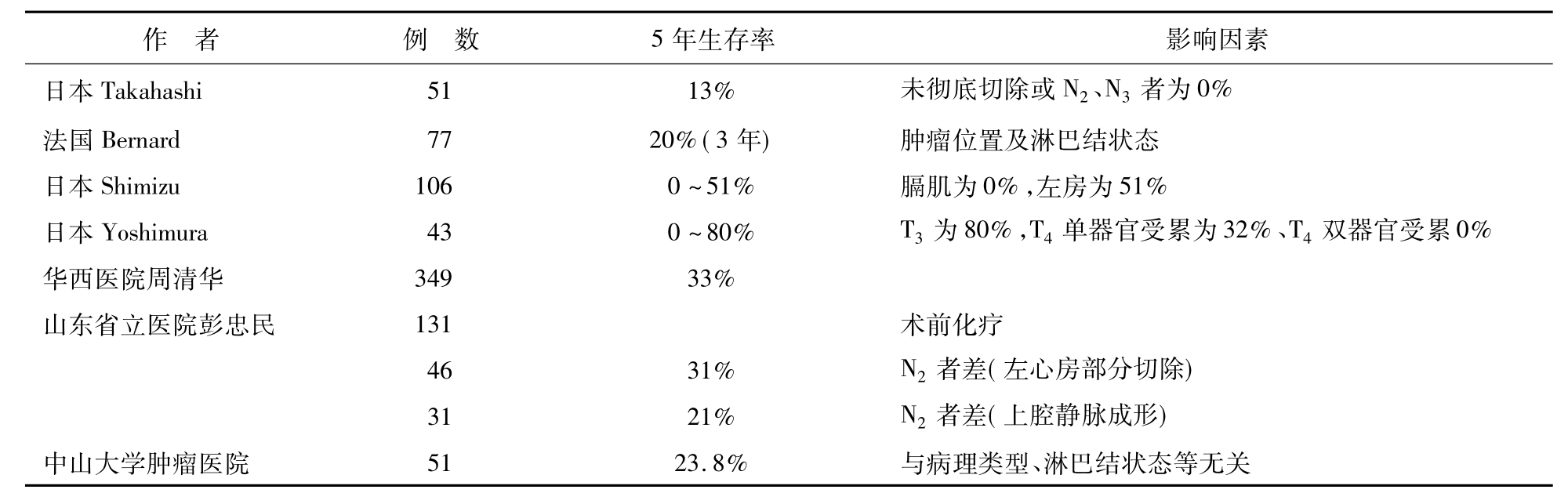
日本Takahashi等根据受侵器官行相应扩大切除,包括左心房15例,上腔静脉13例,气管11例,主动脉5例,脊柱4例,食管3例。结果根治35例,总5年生存率为13%。影响因素包括是否彻底切除及淋巴结转移情况。彻底切除者,5年生存率为18%,未彻底切除者为0%。N0、N1者5年生存率为36%,N2、N3为0。日本Shimizu对106例肺癌行扩大切除,包括胸膜62例,胸壁25例,膈肌11例,左心房7例,上腔静脉6例,主动脉5例,5年生存率依次为20%、14.9%、0、51.4、0、20%。其中左心房部分切除中有2例存活5年11个月及10年6个月,主动脉切除1例存活6年。日本Yoshimura对43例肺癌累及心脏大血管的患者手术,单器官受累32例(左心房20例,主动脉7例,上腔静脉3例,主动脉外膜2例)、双器官受累11例(主动脉及其他器官或左心房及食管或气管)。T3(6例),T4(24例单器官受累),T4(11例双器官受累)的5年生存率分别为80%、32.2%、0。
山东省立医院于2001年总结了131例行扩大切除的患者,分别行上腔静脉修补或置换术17例,左无名静脉与右心耳搭桥术1例,肺动脉成形术86例,左心房部分切除术27例。部分病例经随访结果满意,认为局部扩大切除可提高患者生活质量,延长患者寿命。以后又分别随访统计左心房部分切除及上腔静脉成形的患者,有纵隔淋巴结转移者预后差。华西医院曾报道349例肺癌累及上腔静脉、主动脉、主肺动脉、心房等心脏大血管,行切除重建术,其1、3、5、10年生存率分别为79.36%、59.93%、33.14%、23.56%。
总之,就已有的资料来看,就T分期而言,单器官受累优于多器官受累,手术相对积极;就N分期而言,N0应积极手术,N2则应谨慎手术;鉴于该类手术的复杂性及创伤性,无论T及N分期如何,M1的患者均不应考虑扩大切除。扩大切除的前提至少应达到肿瘤切除,切缘阴性。此外,应当强调,手术仅是综合治疗的一部分,如何结合其他治疗及掌握手术时机是另一关键所在。
二、心包内扩大切除
Ⅲ期中心型肺癌在临床占相当比例,对于肺门局部呈冰冻状或心包外无法处理肺血管者(图3-24-1),切开心包可能达到切除彻底且安全的作用,且就长期生存来看,心包内肺切除患者的生存率令人满意。孙玉鹗报道91例心包内切除者占同期肺癌手术的5.6%,1、3、5年生存率分别为79.0%、37.7%、23.8%。赵凤瑞报道59例心包内处理血管的全肺切除患者,占同期肺癌的3.9%,1、3、5年生存率分别为86.0%、31.6%、26.3%。
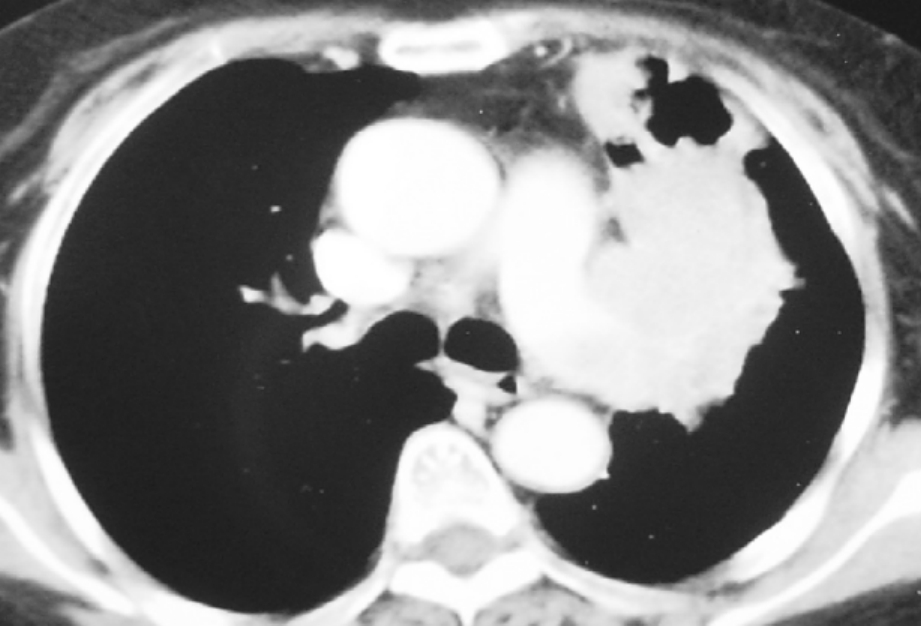
图3-24-1 为肺癌患者CT表现,心包外无法处理肺血管,打开心包安全可行,切除完全
(一)手术适应证
1.中心型肺癌侵及包绕心包外血管干,心包外无法常规处理血管。
2.肺门淋巴结广泛转移,肺门冻结。
3.侵及心包或沿肺血管侵至肺血管根部或心房。
4.术中意外损伤肺血管,心包外无法处理者。
(二)手术要点
1.心包内游离血管较长时,可直接结扎,若血管较短或肿瘤沿血管侵至心包内时,应于近端血管或心房夹无创伤钳,再切断血管或部分心房,然后连续缝合。
2.对某些因肿瘤较大,或即使行心包内处理血管仍较困难的患者,可逆行切除,即先处理其他血管及支气管,最后充分暴露该血管后再处理。
3.游离时一定要轻柔,不可粗暴,尤其是游离肺动脉后壁更应注意。右肺动脉若游离长度不够,可将上腔静脉近心端及右心房进行锐性解剖,同时将上腔静脉及右心房向前推,可使右肺动脉暴露增长2 cm左右。
4.手术后一般应修补心包,以防心脏疝的发生。
三、扩大上腔静脉切除
肺癌合并上腔静脉综合征是晚期肺癌的表现,是最严重的并发症之一,一旦出现,患者多在3月内死亡。虽经导管行血管内支架或外科旁路术可减轻症状,但由于未去除肿瘤,患者多在短期内死于转移或再狭窄。近年来国内外不少学者对单纯上腔静脉受累的患者,行肺肿瘤及受累上腔静脉切除并行上腔静脉修补或置换术,不少患者可获长期生存,生活质量明显改善(表3-24-2)。
图3-24-2为一肺癌患者手术前后的CT表现。上腔静脉受累分为肿瘤直接侵犯(图3-24-3)及淋巴结的侵犯(图3-24-4)两种情况。
表3-24-2 上腔静脉置换后的生存概况
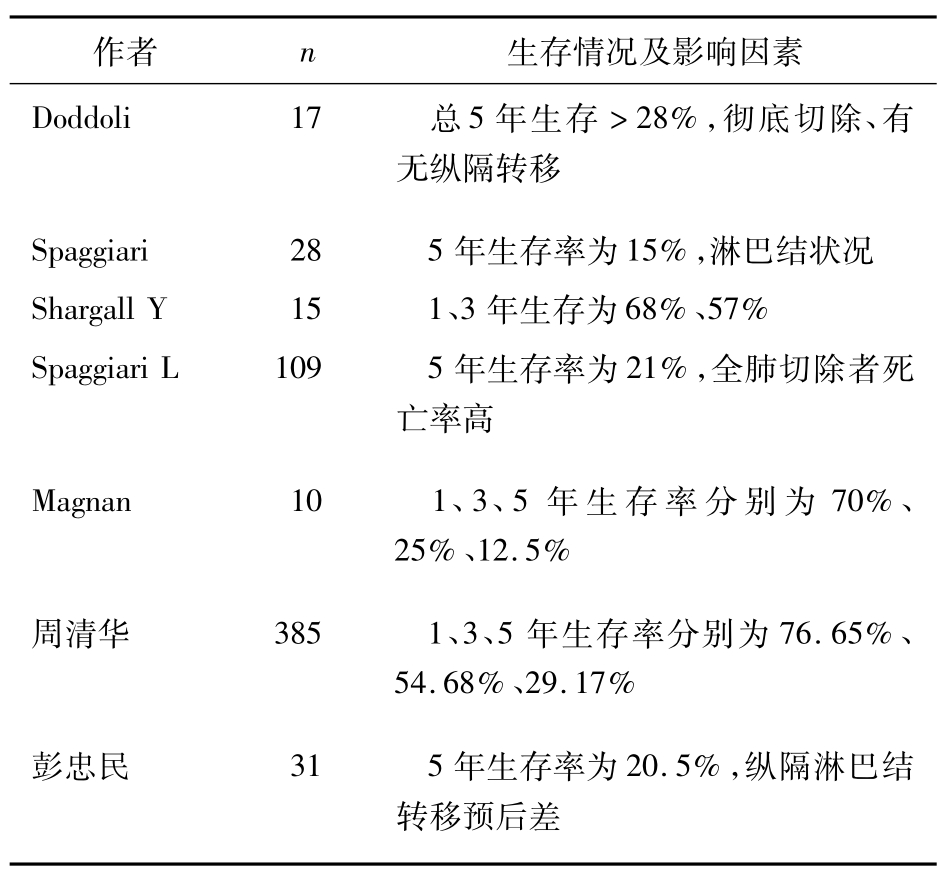
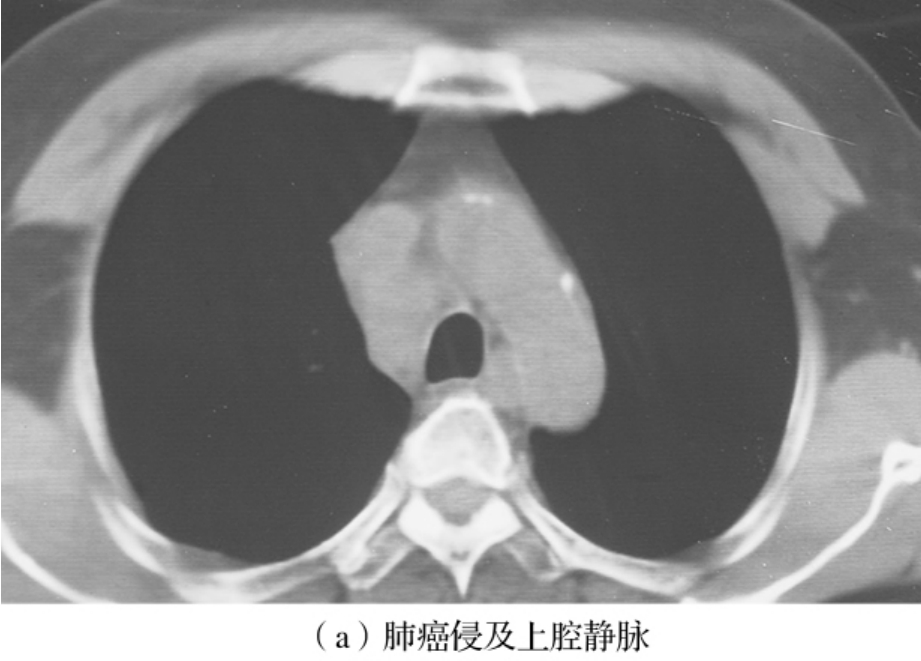
图3-24-2 (a)、(b)肺癌患者上腔静脉受侵,术中切除上腔静脉并置换人造血管,术后随访人造血管通血良好
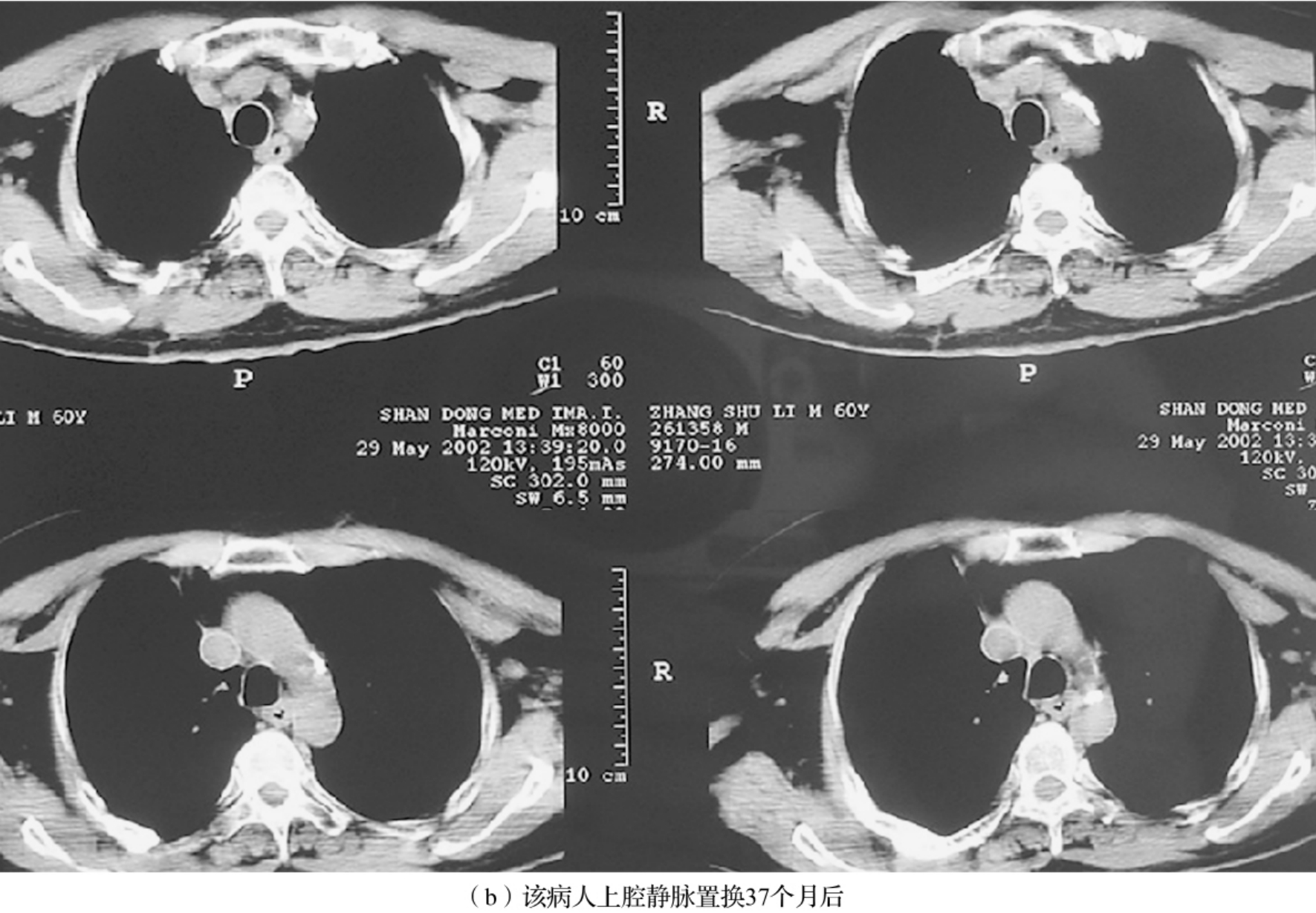
图3-24-2 (a)、(b)肺癌患者上腔静脉受侵,术中切除上腔静脉并置换人造血管,术后随访人造血管通血良好
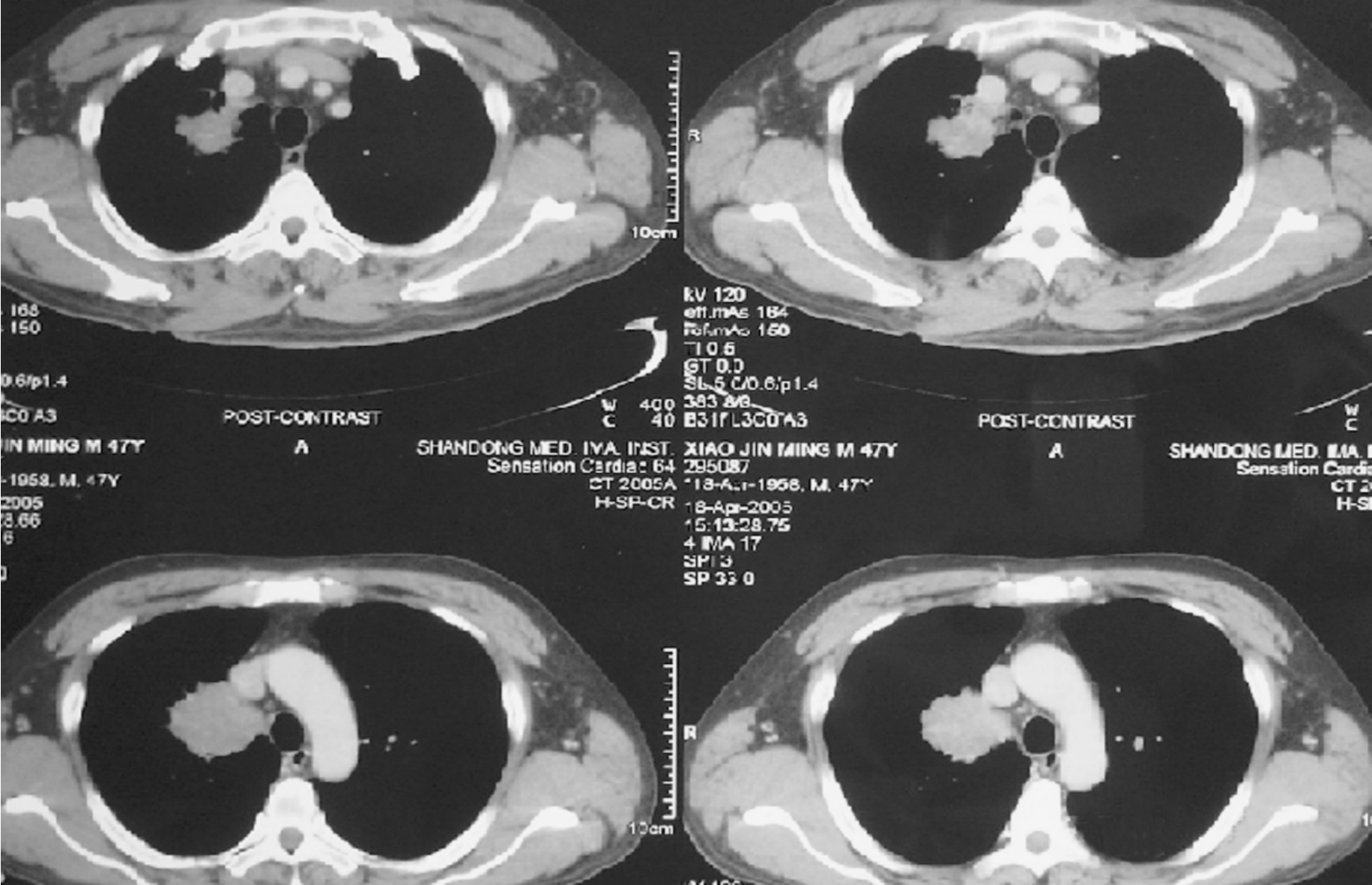
图3-24-3 肿瘤侵及上腔静脉,奇静脉弓入口处受侵,术中上腔静脉成行,术后病理:腺鳞癌,淋巴结无转移,切下的上腔静脉查见癌,T4N0M0
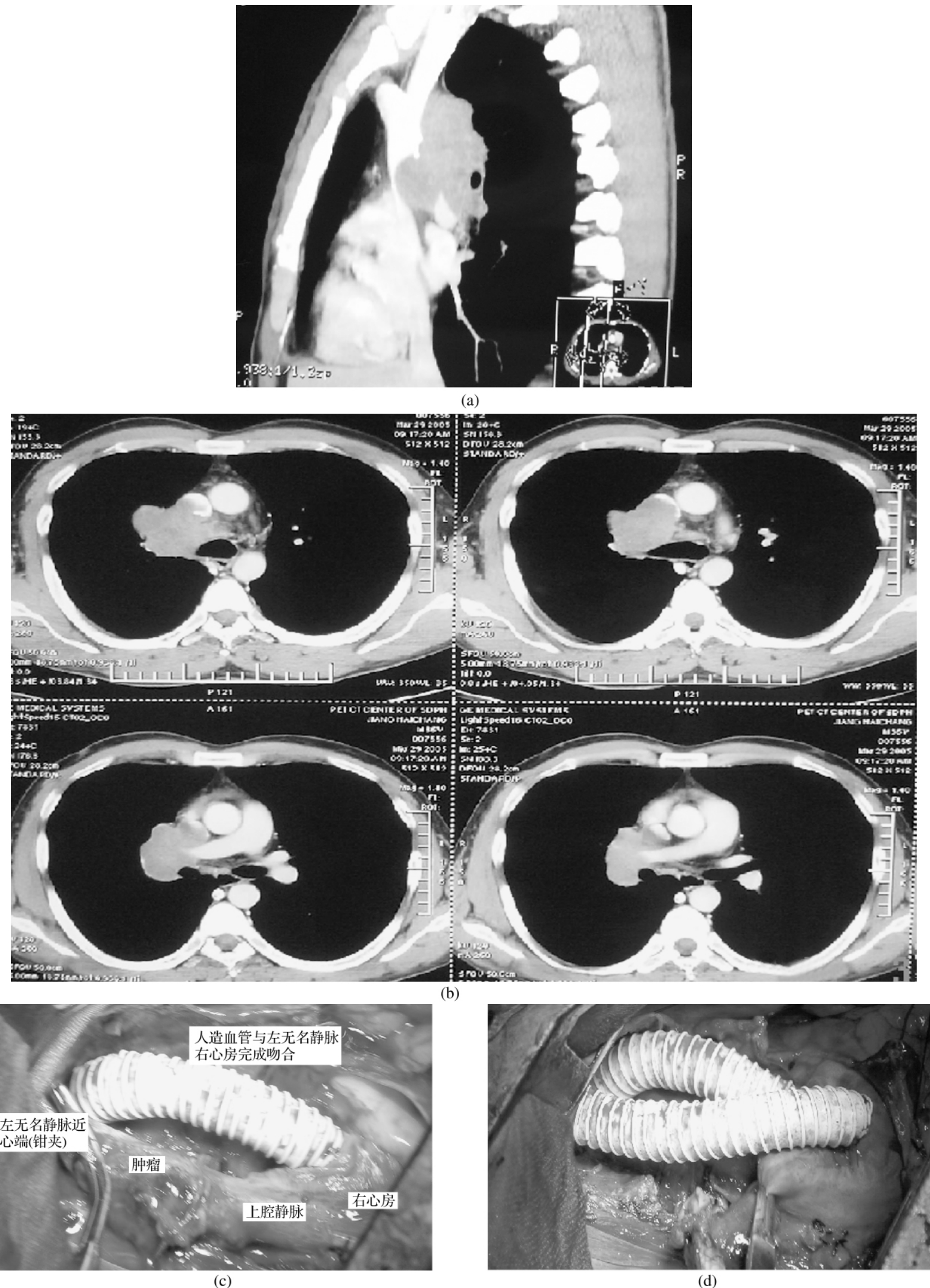
图3-24-4 (a)、(b)为肺肿瘤连同淋巴结侵及上腔静脉,(c)为术中情况,左无名静脉已切除并置换,(d)为右无名静脉与右心房搭桥置换,上腔静脉尚未切除,最后上腔静脉切除
(一)手术适应证的选择
无论是肺癌本身还是淋巴结侵及上腔静脉均为Ⅲ期(ⅢA或ⅢB),属局部晚期肺癌,单纯保守治疗预后不佳,采用手术参与的综合治疗可直接去除病灶,并于术前或术后辅助放或化疗,使总的生存率明显提高,长期存活者并不少见。但该类患者毕竟属晚期肺癌,且手术及术后管理相对复杂,应掌握好适应证。我们认为其适应证如下:①患者一般情况较好,各脏器功能基本正常,能耐受手术,年龄不作为筛选的决定因素,但老年患者仍应慎重。②经术前充分检查包括头颅、胸腹部CT、骨ECT等证实无远处血道转移,且不为N3,广泛N2应慎重。即肿瘤或局部淋巴结转移较局限,可经手术切除者。③最好为NSCLC,我们的经验认为SCLC手术后预后并不差,因此不应构成禁忌。在术前化疗的前提下,如果手术可切除病灶,又无远处转移,仍可将手术作为治疗的一部分,术后再加强辅助治疗。④如果同时合并其他脏器的侵犯需要切除重建者,手术适应证应相对严格些。如需同时切除部分心房或食管时,由于手术创伤较大,对患者的一般情况的要求应相应有所提高。
(二)术中脑保护注意事项
上腔静脉切除修补或置换一般需阻断血管,上腔静脉阻断后,头颈部及上肢血液回流困难,最易造成脑淤血水肿。一般上腔静脉阻断在22~65 min,最长可达105 min而无明显脑部并发症的发生。为减少脑损伤,常采取以下保护措施:①上腔静脉阻断前可先控制性降低血压、冰帽降温等。②应尽量缩短上腔静脉阻断时间,包括提高吻合技术,加快吻合速度等。传统的手术方法为首先阻断上腔静脉,再切除受累的上腔静脉,再将人造血管与上腔静脉远心端及近心端或右心房吻合。我们体会是不首先阻断血管,先完成人造血管与右心房吻合,再阻断并切除受累的上腔静脉,然后完成人造血管与上腔静脉远心端的吻合(图3-24-5),这样阻断时间节省将近一半,一般控制在20 min内,脑损伤大大减轻,可不行控制性降压等措施。③术前经颈静脉或锁骨下静脉置管,上腔静脉阻断后如果吻合时间较长(如>40 min)或上腔静脉压较高时(如压力较阻断前上升20 cmH2O),可经静脉置管放血然后回输下肢静脉,或施行无名静脉与右心房插管转流。④上腔静脉回流无阻断,即切除上腔静脉前,先实行右心房与无名血管插管转流,使上腔血液回流不受影响,然后手术切除及吻合,手术从容,无需急迫,但手术创伤大,增加了手术工作量。此外,如果肿瘤侵及上腔静脉分叉处需要切除部分无名血管时,我们体会可首先于分叉处结扎并切断左无名静脉,先完成左无名静脉与右心耳的吻合,通血后再切除并完成右无名静脉与右心房或上腔静脉近心端的吻合,即左、右无名血管分别与右心房吻合,整个手术过程亦无上腔静脉血液的阻断,可谓一举两得。赵风瑞等认为,先完成左或右无名静脉与右心房的吻合,再切除受累的上腔静脉,无需进行另一支无名静脉与右心房的吻合亦可。⑤术后为减轻脑水肿,应即刻给予速尿,对有睑结膜水肿较明显或阻短时间较长的患者可重复用,并加用甘露醇。
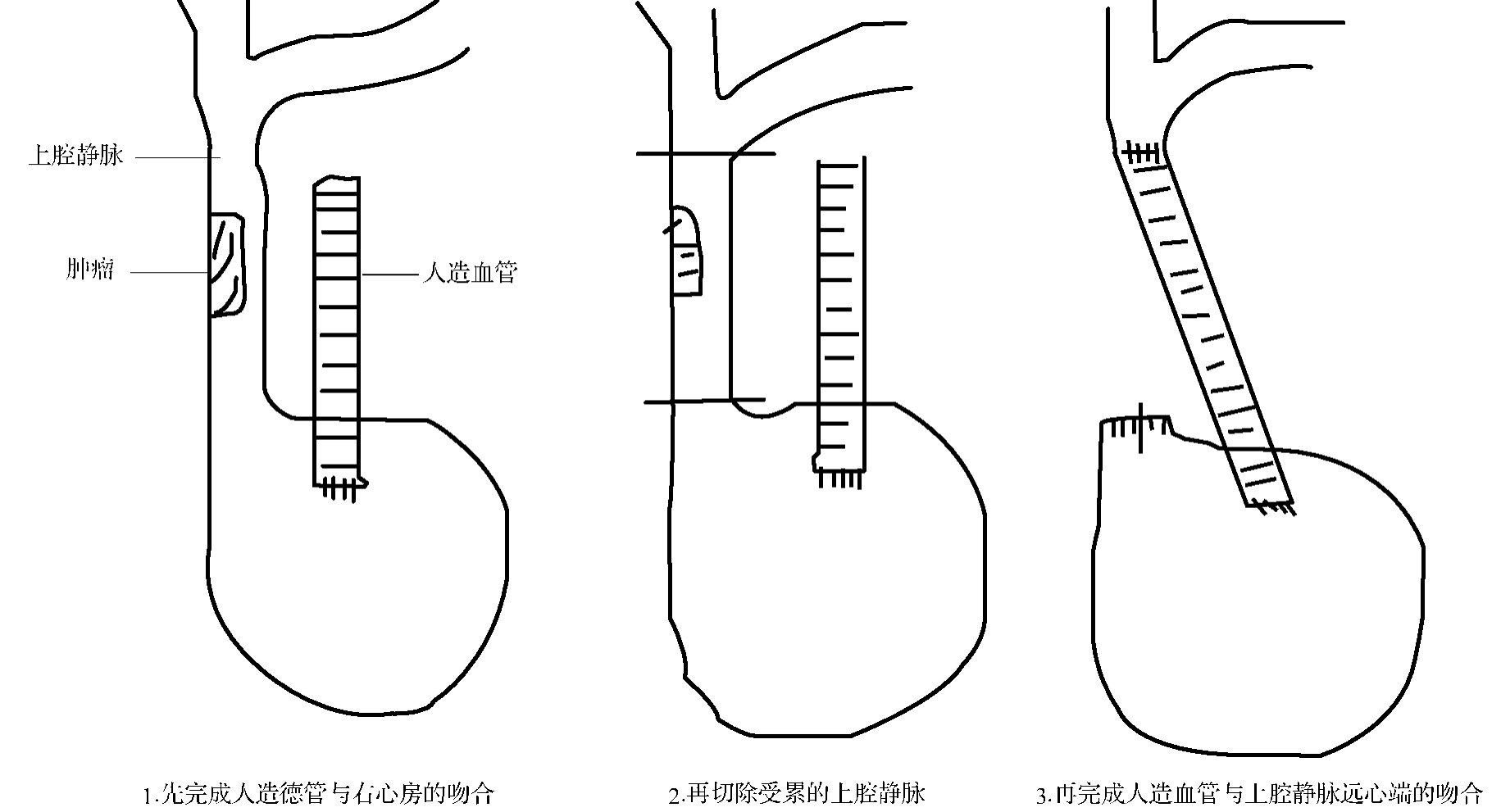
图3-24-5 人造血管置换吻合顺序示意图
(三)手术方式的选择
手术可采用上腔静脉切除置换(包括单纯上腔切除置换及分别左右无名血管置换)、上腔静脉修补及上腔静脉壁部分切除直接缝合三种方式[图3-24-6(a)、(b)、(c)、(d)]。对切除肿瘤侵及的上腔静脉如果直接缝合后管腔直径不小于原直径的1/2,可直接缝合(图3-24-7),否则用自体心包片修补较好,对切除较多的病例则考虑血管置换。由于血管置换术后需要抗凝,故不列为首选。人造血管置换可选用国产涤纶人造血管及其他进口材料,如Gore-Tex或巴德IMPRA人造血管。后两者组织相容性及缝合严密性较好,应列为首选。缝合线为4-0 proline无创伤滑线较好。
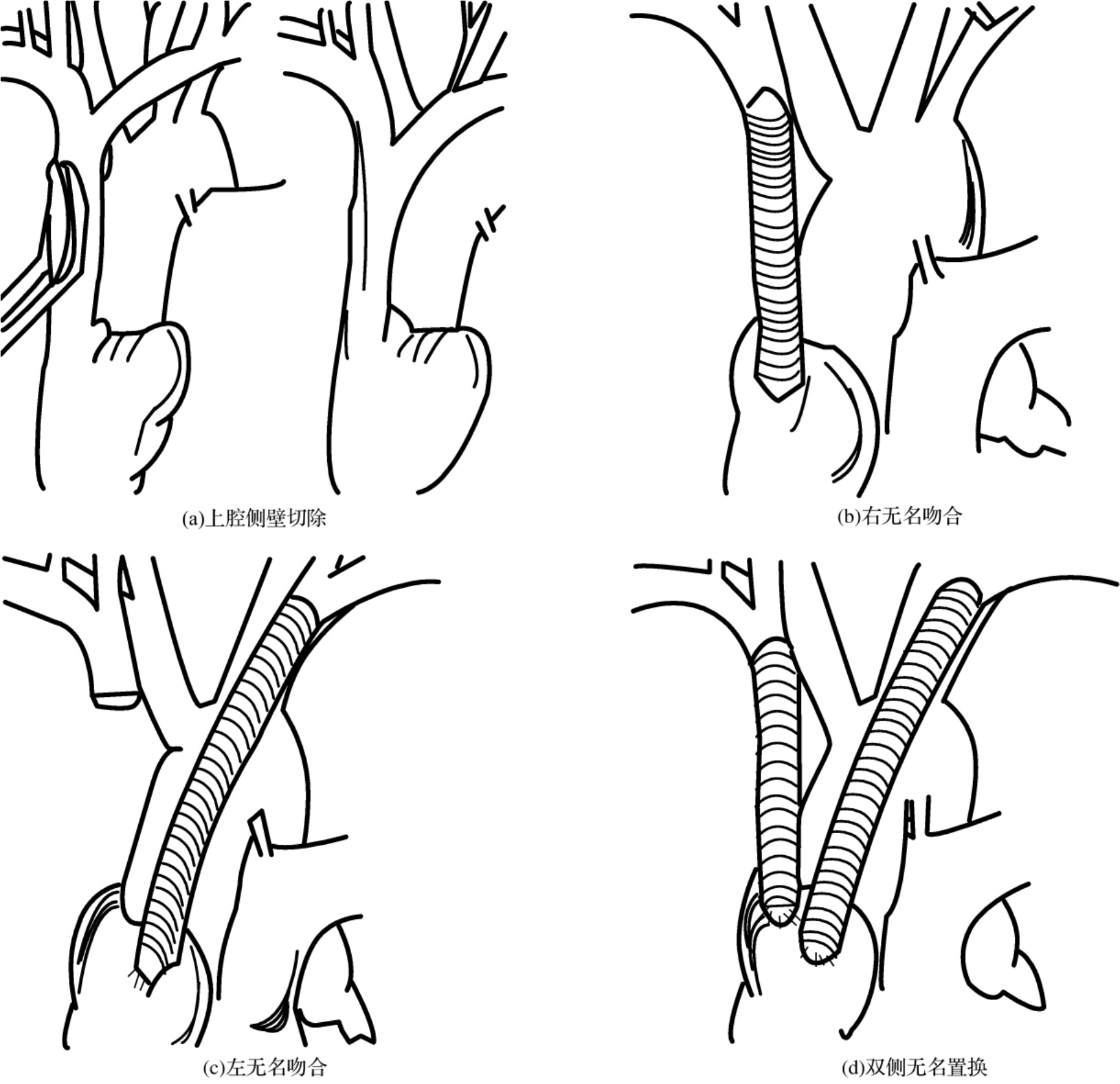
图3-24-6
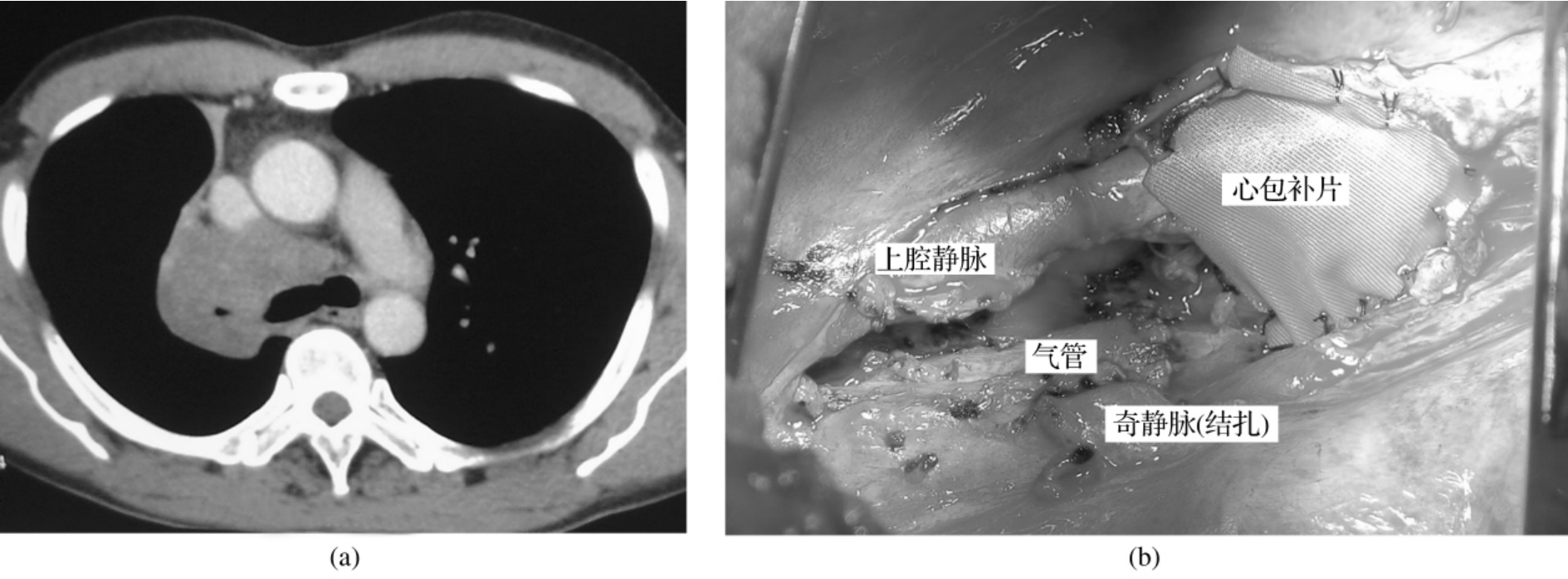
图3-24-7 上腔静脉奇静脉汇入处为肿瘤及淋巴结侵犯,切除部分上腔静脉,直接缝合,即上腔静脉成型。术后病理为不典型类癌
(四)抗凝
术中及术后抗凝仍有争议。周清华等认为,术中应肝素化,术后华法令抗凝终生;有人认为,术中应肝素化,术后抗凝3~6个月;赵风瑞等认为,术中仅需局部用肝素水冲洗,若应用Gore-Tex人造血管,术后则无须抗凝;彭忠民等认为,术中无须全身肝素化,术后每天肌注低分子肝素2 500 IU,1周左右渐改为华法令口服,使凝血酶原时间控制在正常时的1.2~1.5倍,亦可于3~6个月后改为口服潘生丁及阿司匹林,应终生服药较妥,但部分患者自动停药后未见血管栓塞。
术后并发症方面,需要注意的是术后吻合口出血及血管栓塞。如果术后胸腔引流量较多,考虑吻合口出血时应及时开胸探查,保守治疗有害无益,一般直接缝合出血部位即可。对术后发生上腔静脉综合征的患者,即考虑为血管栓塞,应及时开胸再次切除人造血管、取出血栓再行吻合。山东省立医院遇到1例胸腺瘤切除加上腔静脉置换的患者,术后第2天即出现头面部水肿,经超声诊断为置换之血管栓塞。急症手术证实后切除置换的血管,取出血栓并重新吻合置换的人造血管,术后恢复顺利。亦有报道,术后发生上腔静脉血栓未手术,而采取全身肝素化治愈。为避免血栓形成,术中可选用较粗的人造血管,且长度适宜,过短易造成牵拉出血,过长则使血管扭曲栓塞;术后近期抗凝是必要的。
(五)影响生存的因素
由于该期肺癌属局部晚期肺癌,以手术参与的综合治疗是较理想的治疗措施。术前化疗优于术后化疗的模式正为越来越多的癌症中心所推荐,有效的术前化疗可消灭微小转移灶,还可使肿瘤缩小,甚至降期利于手术切除的彻底性。Spaggiari、Shargall均认为,术前化疗能提高患者生存质量或生存率;周清华、彭忠民等认为,术前或术中用化疗者比单纯手术或术后化疗者生存率有所提高,术前化疗应当提倡。尤其是SCLC应加强综合治疗,术前化疗更是不可少。但对于有明显上腔静脉综合征者而言,由于化疗的作用迟缓或无效,为尽快缓解上腔静脉综合征,应及时手术。对于一般情况较好,血常规、肝肾功能无异常者可术中化疗1次,可能对已存在的微小转移灶及减少术中播散有积极意义。
对单纯由肿瘤引起的上腔静脉侵犯,手术效果优于淋巴结的侵犯,应积极手术。而对于广泛纵隔淋巴结转移的患者,则应相对慎重。肿瘤及淋巴结彻底切除者预后优于未彻底切除者,因此,术中应争取彻底切除肿瘤及清扫相应的淋巴结,不主张行淋巴结摘除术。无论肉眼残留还是镜下残留,术后应给予治疗量的放疗,并对能耐受者同时给予化疗。对血管置换及修补者预后无明显差异,从而提示只要能彻底切除肿瘤,局部切除修补是可行的。
肺癌累及上腔静脉保守治疗效果不理想,以手术为主的综合治疗可能能延长患者的生存并提高其生活质量。手术是可行的,手术中应尽可能减少上腔静脉的阻断时间并注意脑保护。
无纵隔淋巴结转移者预后较好,应尽可能手术治疗,术前或术中化疗值得推荐。
四、扩大左心房切除
肺癌侵及肺静脉根部或进而侵及左心房均属局部晚期肺癌(T4)(图3-24-8、3-24-9),单纯保守治疗效果很差。若能完全切除肿瘤包括部分左心房并辅以放、化疗,即采用以手术为主的综合治疗,很多患者可获长期生存。扩大左心房切除治疗肺癌,已为国内外许多学者所接受。
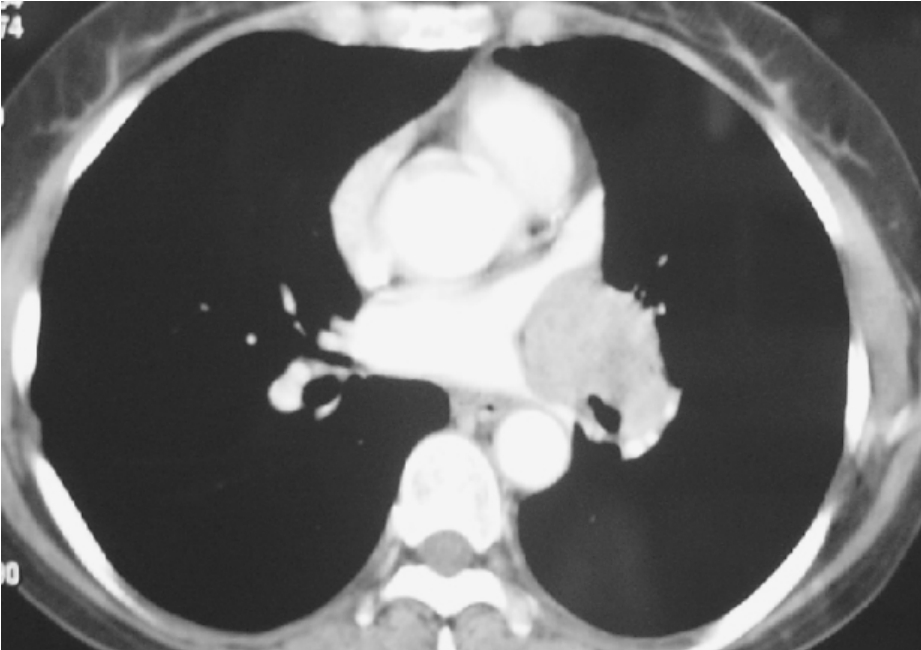
图3-24-8 肿瘤位于肺上静脉与肺下静脉之间,切除肺上静脉、肺下静脉及部分左心房
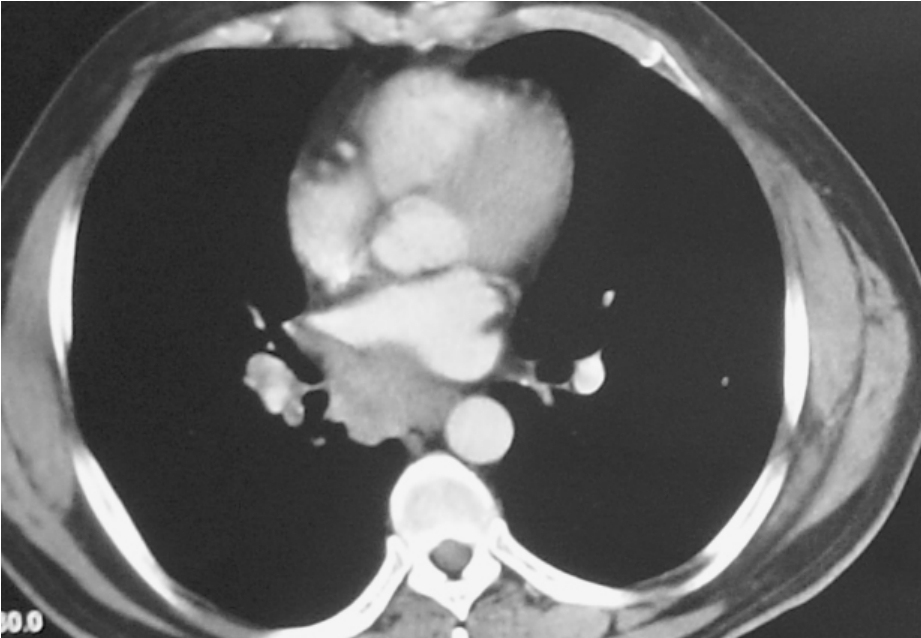
图3-24-9 肿瘤侵及肺下静脉及部分左心房,术中切除部分左心房
Doddoli等报道,29例侵及主动脉或左心房行手术治疗的局部晚期肺癌,总的5年生存率达28%。国内周清华等报道,肺癌行左心房扩大切除75例,其5年生存率为31.23%。彭忠民等总结了46例左心房部分切除的患者,其中2例因同时侵及肺动脉分叉处,常规无法处理肺动脉,在体外循环下切除全肺及部分左心房,其1、3、5年生存率分别为84%、44%、30%。影响预后的因素为有无纵隔淋巴结转移,术前化疗与否及性别、年龄、病理类型对预后无明显影响。并认为肺癌累及部分左心房或肺静脉根部进行手术治疗是可行的,无纵隔淋巴结转移者预后较好,应尽可能手术治疗,发现有纵隔淋巴结转移预后差。
(一)手术适应证
1.经CT、ECT等检查排除颅脑、腹腔、骨骼等远处转移(M0);
2.无锁骨上、颈部、对侧纵隔及肺门淋巴结转移(非N3);
3.非广泛成团的纵隔淋巴结转移(非广泛N2);
4.估计手术能彻底切除病灶及受累组织,且受累器官要少,最好仅肺静脉或左心房受累(非多器官受累的T4);
5.患者一般情况较好能耐受手术,且为NSCLC(对无淋巴结转移的SCLC患者在诱导化疗后亦非绝对禁忌);
6.无癌性心包积液,且估计心房切除范围小于1/3;
7.有淋巴结转移或肿瘤较大时应先行新辅助化疗。
(二)注意事项
术前应充分检查,准确分期。常规行胸部螺旋CT血管强化扫描,充分了解肿瘤与周围组织尤其与大血管、心房的关系及手术切除的可能性。对肺静脉有癌栓可疑的患者,应行心脏多普勒检查,以排除心房内癌栓;如果心房内有癌栓,为防止术中癌栓脱落,该类患者应在体外循环下进行。对肿瘤同时侵及肺动脉主干,尤其是近左右肺动脉分叉处时,常规无法处理肺动脉,可在体外循环下处理,并同时切除受累的心房。
扩大左心房切除应在保证肿瘤能彻底切除的情况下进行,且注意不要超过心房的1/3,否则会影响血流动力学。术前应常规行心脏超声检查,了解心脏受累的情况及有无血栓形成,对心脏内有可疑的患者应在体外循环下进行较安全。术中应特别注意无瘤原则,通常情况下应先处理肺静脉,以防因手术操作挤压致使癌栓脱落或转移。探查肿瘤较大时,肺静脉暴露较困难,此时可逆行切除,即先处理动脉及支气管,最后提起肺组织,于左心房侧夹无创伤钳,切除肺及肿瘤。彻底清扫各组淋巴结,手术后常规用43℃蒸馏水浸泡胸腔及心包腔,对术中有播散可能的可用抗癌药物浸泡。对肺静脉有癌栓者,缝合心房前应用蒸馏水冲洗残端,以免肿瘤播散。一般认为切除范围应小于左心房的1/3,否则易引起血流动力学变化,导致心衰。对切除范围较大的患者,术中及术后应控制输液速度及输液量,并加强心电监护,避免心功能不全的发生。
(三)影响预后的因素
1.纵隔淋巴结因素多数学者认为,影响该类患者预后的主要因素为有无纵隔淋巴结转移。彭忠民等的一组病例发现,无纵隔淋巴结转移(N0/N1)者及有转移者(N2)的中位生存期分别为38、19个月(P=0.002),并认为对淋巴结阴性及肿瘤较局限者应积极手术,对纵隔广泛转移者则应慎重。
2.细胞学类型各种报道不一。有的认为预后与细胞类型无关,有的认为鳞癌预后相对较好,而小细胞未分化癌无淋巴结转移且病变局限者手术切除也可达到良好的治疗效果。
3.关于术前化疗与否及化疗周期一般认为,术前新辅助化疗有利于病灶切除,且可能消除微小转移灶值得提倡。但关于化疗周期尚有争论,欧美国家一般主张术前化疗3周期,国内同行则考虑国人的体质等影响因素,术前化疗2周期较妥。彭忠民等认为,由于化疗存在耐药性,且可减弱患者免疫力。多周期无效化疗可能会延误手术时机,化疗以2周期为妥,但经1周期化疗发现不敏感者可放弃化疗而转为手术。
4.术后治疗由于该类患者属局部晚期肺癌,术后均应化疗或(和)放疗。术后化疗应参考术前化疗的效果,术前化疗无效者应修改方案。术后化疗2~4周期,如果化疗不良反应较重且手术切除彻底又无淋巴结转移,可不必过多周期化疗,减少化疗周期可能对该类患者更有利。对切除不彻底的患者术后可先化疗1周期,再加行足量放疗,对切除彻底而纵隔淋巴结有转移者可加适当放疗,其组织量应低于治疗量,为40~45 Gy较妥,放疗后再行化疗2~3周期。
五、隆突切除成形
肿瘤侵犯隆突(图3-24-10),手术切除重建难度较大,但做好麻醉准备及配合,彻底切除肿瘤并重建隆突可获得较好的生存率(表3-24-3)。
表3-24-3 隆突切除重建术生存情况
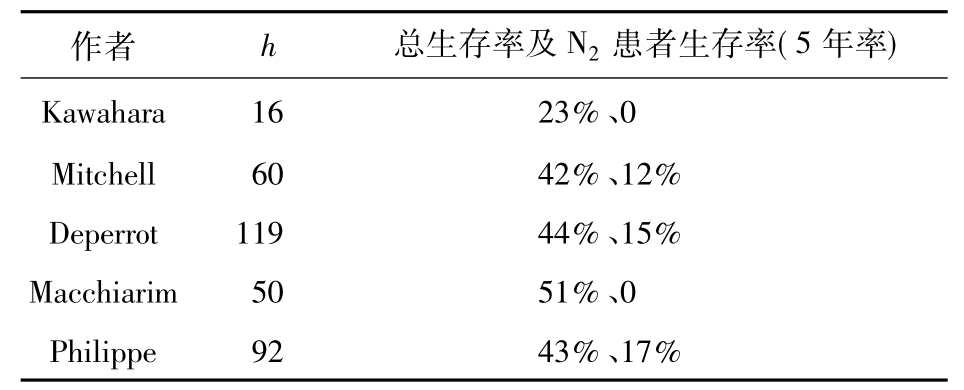
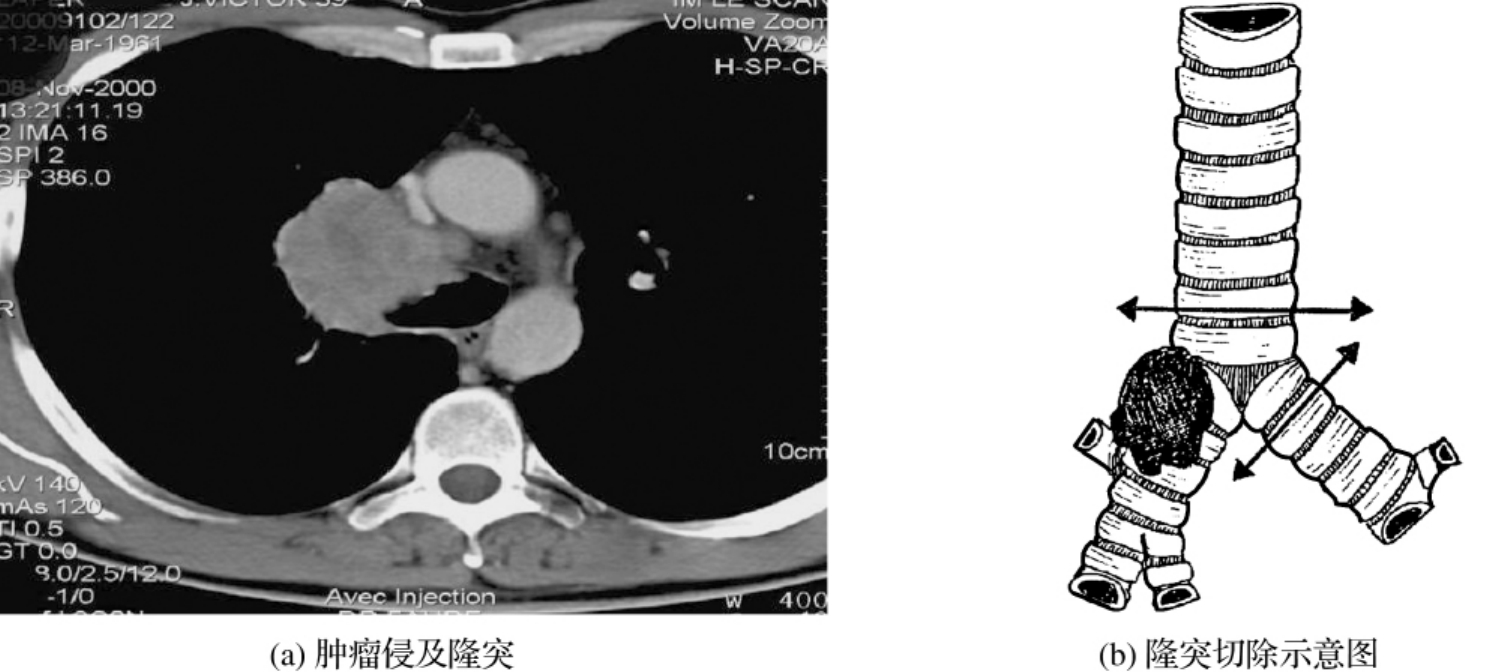
图3-24-10
隆突切除亦不断发展,Kawahara等对16例局部晚期肺癌实行隆突加相应器官如部分主动脉、部分心房、上腔静脉等切除,5年生存率达23%。对较复杂的气管、隆突和支气管重建手术,可应用体外循环辅助,由于术中无需换气,气管、支气管可任意开放,获得了较好的近、远期效果。
六、肺动脉成形
自20世纪70年代开展支气管袖状切除以来,在坚持最大限度切除肺癌组织及最大限度保留正常肺组织的原则下,在实践中不断发展改进,又开展了段支气管袖状切除、肺动脉袖状切除、支气管袖状切除联合肺动脉袖状切除(双袖)[图3-24-11(a)、(b)]以及支气管、肺动脉、肺静脉袖状切除即自体肺移植等。
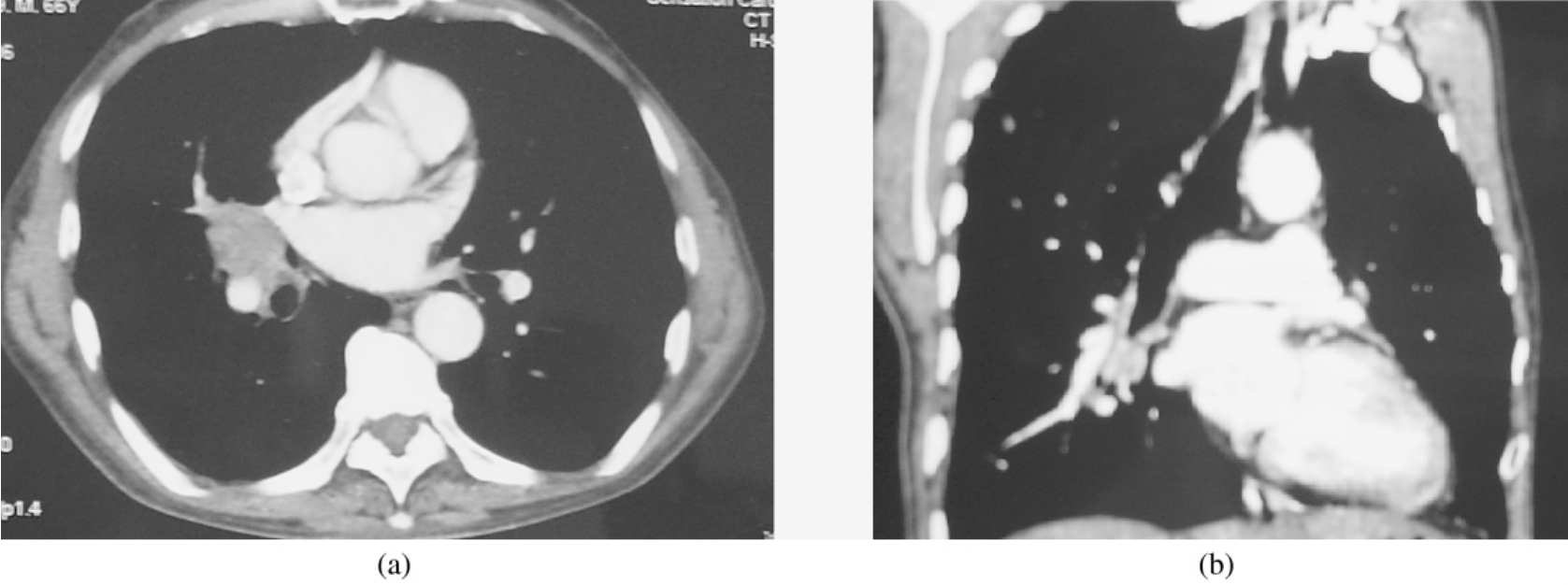
图3-24-11 (a)为肺癌患者行双袖切除的术前CT横断面图像,(b)为冠状位图像。某男,66岁,咳嗽血痰1周,术前纤支镜:中间支气管内侧可见结节,中叶管口菜花阻塞,鳞癌,术中行中叶肺切除,肺动脉及中间支气管双袖状切除成形,彻底切除肿瘤并保存了下叶
(一)手术治疗效果
通过支气管、肺动脉袖状切除成型,可避免全肺切除,最大限度地保全了肺功能,为不能耐受全肺切除的患者提供了手术机会。肺动脉袖状成形术已经开展40多年,但该种手术仅限在国内外的少数医疗中心开展。迄今为止,国内外文献报道2 000多例。Vogt-Moykopf及其同事报道29例同时施行肺动脉支气管袖状成形术病例,其平均生存时间为725 d。Rendina等报道68例施行肺动脉袖状成形术患者。国内周清华等报告,支气管肺动脉袖状成形术治疗1 200多例肺癌的结果,其5年生存率达到34.24%。
袖状切除较全肺切除而言,并发症有所降低,患者的生活质量从某种程度上得到提高,就长期生存率的情况,袖状切除并不低于全肺切除。对于同期支气管、肺动脉成形术后5年生存率,Hollaus等报道为50%(108例),Chunwei等报道为48.9%(78例),其中淋巴结转移是影响预后的主要因素。Kawahara等报道136例肺癌支气管成形的患者,37例同时行肺动脉袖状成形术,其5年生存率为37.1%。
(二)手术适应证
1.左肺癌侵犯左下叶肺动脉干或(和)下叶基底动脉干起始部者;
2.左肺癌侵犯心包内左肺动脉干或(和)肺动脉圆锥者;
3.右肺癌侵犯右肺下叶肺动脉干或(和)下叶基底干起始部者;
4.右肺癌侵犯心包内右肺动脉干者;
5.经临床检查、胸部CT、MRI、全身同位素骨扫描检查,能确定肺癌局限于一侧胸腔,而无对侧胸腔和远处转移者。
(三)手术方式
肺动脉袖状切除长度最长可达6 cm,即将下叶基底动脉在心包内与左肺动脉干起始部吻合,无需间置血管。张国良等报道,2例双袖状右肺上中叶联合切除,因支气管及肺动脉切除过长,吻合张力过大,遂切断肺下静脉,肺短时间离体后作下叶自体移植,将下肺静脉与上肺静脉断端吻合。
肿瘤侵及肺动脉部分切除缝合后可能出现狭窄(图3-24-12),肺动脉成形就显得十分必要。Toomas指出施行肺动脉成形术,应充分暴露主要动脉干以利吻合,同时钳夹肺动脉,右侧在上腔静脉下,牵拉开暴露手术区,继之分离奇静脉,扩大间隙,使上腔静脉居中。血管吻合左侧较易,行端端吻合,可使血管腔宽大一些。尽量不行长形切线切除或楔形切除肺动脉。
图3-24-12 肺动脉切线切除术后管腔狭窄
肺动脉成形术可分下列各类:
1.标准左肺动脉成形术切除一段左肺受累的动脉,往往打开心包,要注意循环系统,用6-0血管缝线缝合,若切除一部分心包,则缺损可用胸膜修补,也可用冻存的人体有关膜修补(human dura),目前已有众多材料可修补(图3-24-13)。
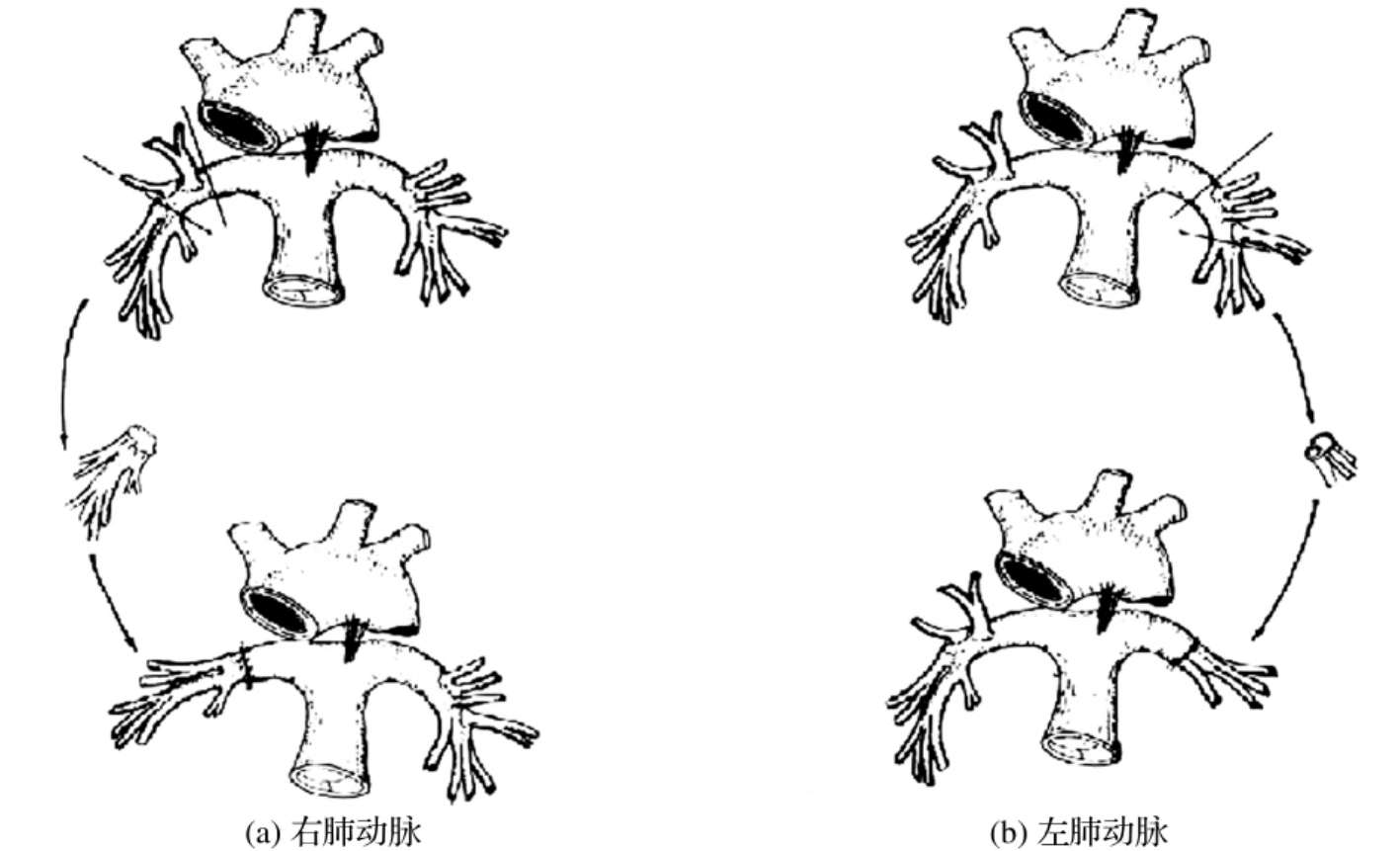
图3-24-13 标准肺动脉成形术
2.扩大左肺动脉成形术肺动脉近端或远端扩大切除,切近端若多,则吻合困难。因影响血管吻合,可打开心包,分离动脉导管,亦更要注意循环系统反应(图3-24-14)。
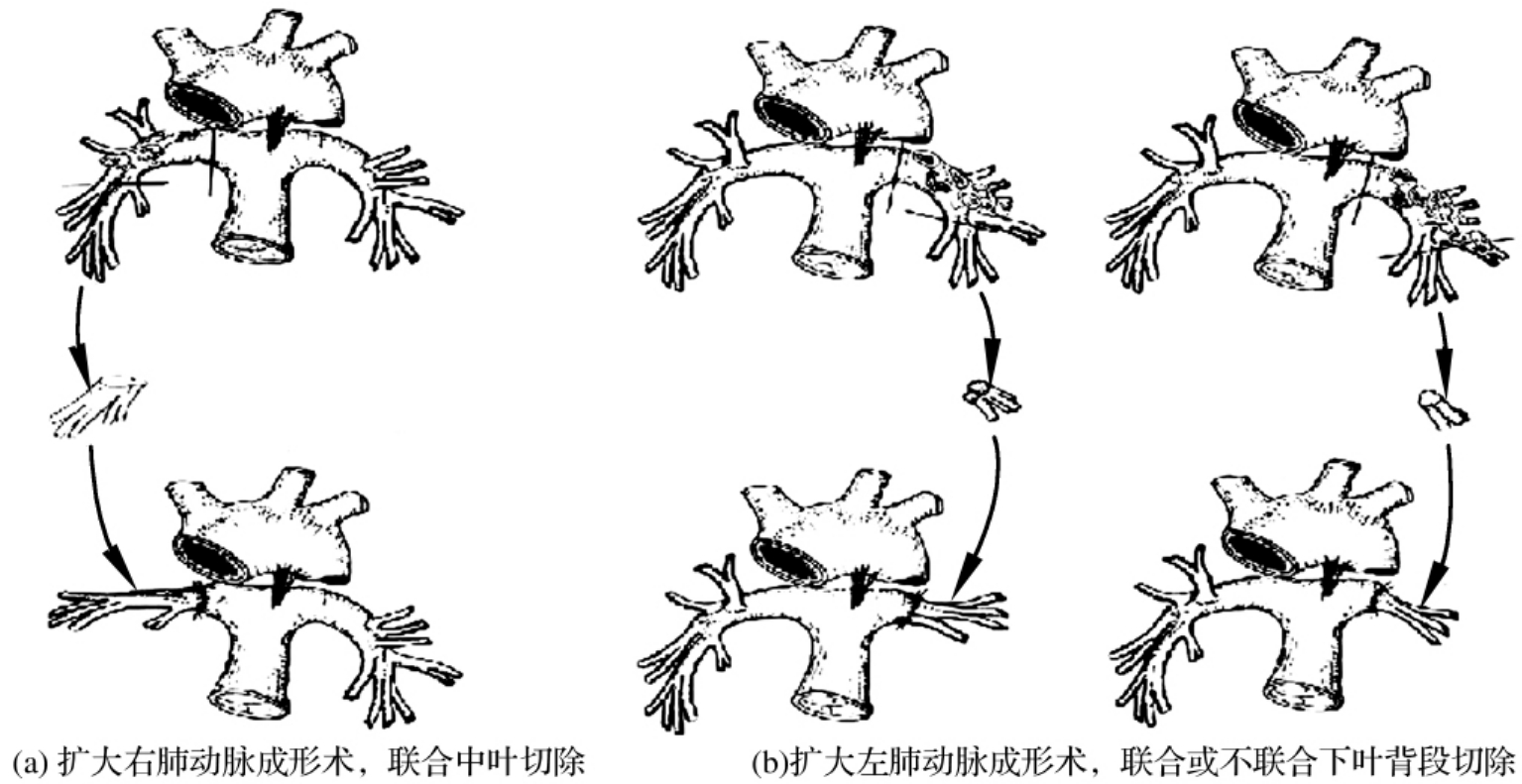
图3-24-14
3.标准右肺动脉成形术上叶三段中第一段切除,则使肺动脉存有相当短的缺损(图3-24-13)。
4.扩大右肺动脉成形术此手术要扩大切除肺动脉,使钳夹肺动脉可能困难。此入路受上腔静脉所阻挡,而非常难以接近动脉端,以至于同时要切除中叶,还要避免下肺静脉到上肺静脉的位置(图3-24-14)。
5.支气管与肺动脉联合成形术此手术几乎全部应用于肺恶性肿瘤,很少应用于良性病变。此手术应先行支气管成形术,吻合后以心包或胸膜覆盖,若行淋巴结清除也应在血管吻合前进行。对细小血管吻合,并不损伤。对此手术应有较熟练者施行。术毕应置两个胸管,一前一后以利肺膨胀(图3-24-15)。
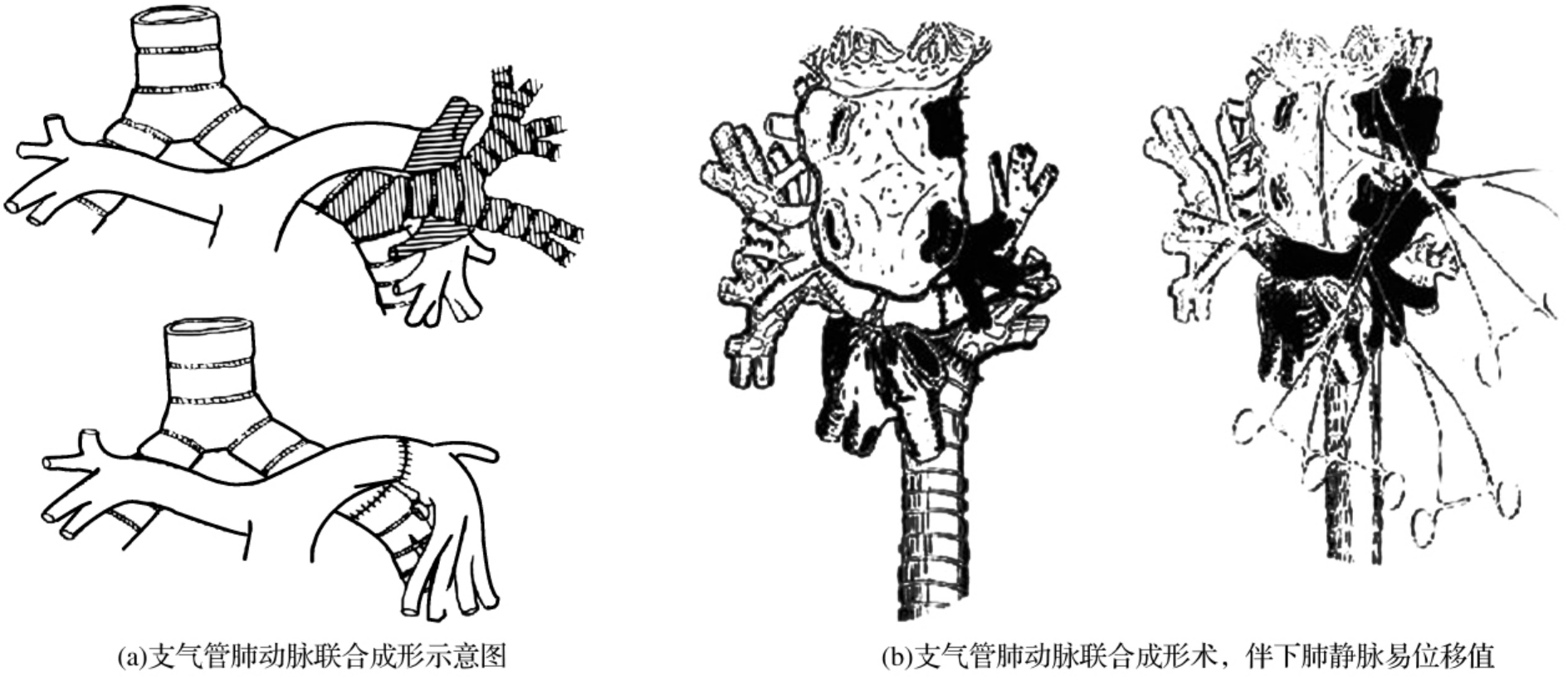
图3-24-15
七、扩大主动脉切除
左肺癌易侵及主动脉弓或降主动脉,通常情况下列为手术禁忌;即使手术切除肿瘤,亦常是肿瘤残留于主动脉的姑息性切除;术后生存率低,放疗常招致肿瘤处主动脉的大出血。近年来,开展的扩大主动脉部分切除、血管重建已见于多家报道(表4为扩大主动脉切除的生存情况),尤其是日本学者在该领域探索较多。Chida等报道,3例T4N0的患者行扩大主动脉切除,其中2例分别37个月、26个月无瘤生存,1例术后8个月肾上腺转移。Sasamoto对3例肺癌累及主动脉行肺及降主动脉切除重建术,1例行左锁骨下动脉与降主动脉旁路,术后7个月死于复发;另2例行受累降主动脉上、下插管旁路后切除受累主动脉,术后1例存活21个月,1例5个月仍健在。Tagawa等对4例肺癌侵及主动脉的患者行根治术,随访3例,2例1年内死亡,1例存活9个月仍健在。Shinada等对3例该类患者行根治术,均为降主动脉中层受累,弹力层受侵。其中1例部分阻断主动脉,2例在体外循环下完全阻断主动脉,施行主动脉切除。1例存活56个月,1例20个月,另1例术后3个月并发脓胸,死于主动脉补片缝线出血。周清华等报道4例扩大主动脉切除的患者,5年生存率为33.3%。由于扩大主动脉切除手术操作复杂,手术需要在体外循环下进行,因此,应严格适应证,手术必须保证彻底切除,且根据已有的经验,应限于N0M0的患者较为合适。
表3-24-4 肺癌扩大主动脉切除的生存情况

八、扩大食管切除
肺癌累及食管又是另一局部晚期的表现(图3-24-16为肺肿瘤侵及食管的CT及钡餐所见),总的来讲,食管受累的手术治疗效果似不如上腔静脉或左心房受累。但对于单纯食管受累,并无多器官受累及其他转移灶的情况,手术治疗应优于保守治疗,在综合治疗的前提下,可有选择的实施手术。法国Bernard等对77例晚期肺癌手术,其中食管切除重建8例,总的1、2、3年生存率分别为46%、31%、20%。彭忠民等研究了18例肺肿瘤侵及食管的患者,14例为转移淋巴结累及食管,4例为肿瘤侵及食管。7例患者切除局部受累的食管肌层;5例行食管切除、胃食管吻合术;2例切除大部受累肌层,部分肿瘤残留;4例患者单纯探查,未切除肿瘤。14例切除组患者中,其中1例行左全肺切除+食管局部肌层切除,术后4 d发生食管漏,自动出院,2周后死于衰竭,其余随访3~30个月。死亡4例,均为复发或转移,分别为术后9、10、13、26个月;9例随访中,最长者为30个月,1年生存率达78.6%。而4例探查组无1例生存超过12个月。
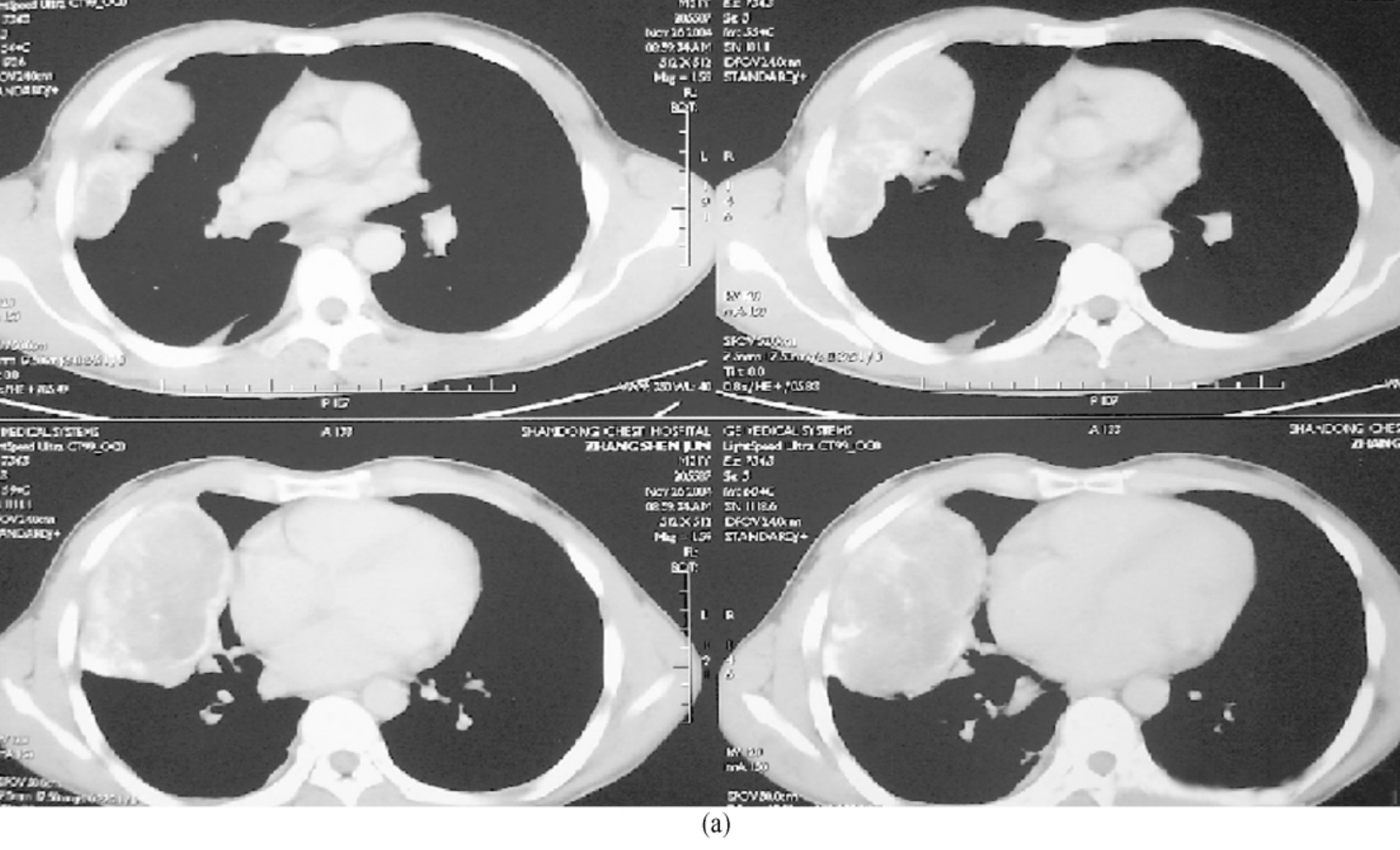
图3-24-16 (a)纵隔型肺癌侵及食管的CT
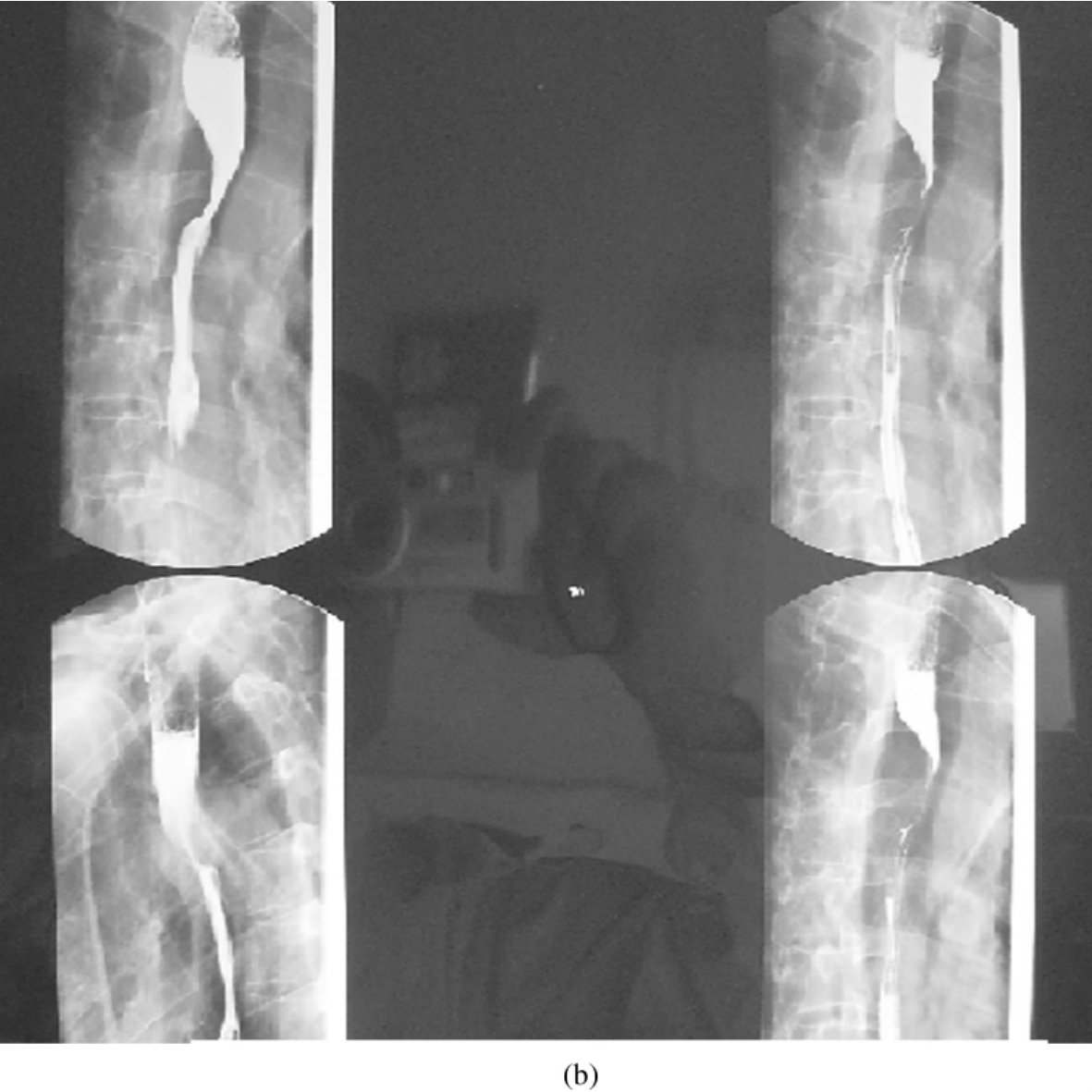
图3-24-16 (b)食管钡餐所见。术中扩大部分食管肌层切除,右肺上叶切除
(一)手术适应证
晚期NSCLC累及食管单纯保守治疗效果不好,部分患者在术前放、化疗的前提下,可能从手术中获益。手术一次切除肺及受累食管,虽手术损伤较大,但切除了肉眼所见的肿瘤,至少瘤负荷得以减轻,术后再配以化疗(若肿瘤残留可加放疗),进一步清理残存肿瘤细胞,无论从理论上还是实践中均有一定价值。一般认为适应证如下:①患者年轻、体质较好。②经充分检查无远处转移(非M);无远处淋巴结转移(非N3);纵隔淋巴结并非广泛融合(非广泛N2)。③术前放、化疗的前提下,无论肿瘤是否缩小,对于单纯肿瘤侵及食管的患者可适当放宽手术指征。
(二)术式选择(https://www.daowen.com)
手术是综合治疗肺癌的重要环节,即使残存少许肿瘤,亦为术后放、化疗奠定了基础,因此应争取彻底切除至少肉眼所见的肿瘤。但是肺癌累及食管时已晚期,对于仅少许食管肌层受累,尤其是隆突下淋巴结压迫累及食管外膜或少许肌层,而患者体质较差时,未必行食管切除,可切除受累部分后配以放化疗,效果仍能满意。术中若见剩余肌层薄弱,则可用相邻胸膜包盖,或取相邻心包翻转缝于对侧胸膜包盖,以加固食管,防止术后进食时出现食管膜破裂。对全肺切除者,因无肺压迫相应食管,更应特别注意。有1例发生食管黏膜的破裂(食管瘘),可能与全肺切除及食管肌层部分切除后未用胸膜或心包片包盖有关。对于受累食管肌层较广较深,甚至达黏膜层者,若患者体质允许,肺肿瘤及淋巴结均可切除时,则应一期行肺癌扩大切除术,胃代食管,为节省时间可用机械吻合。
(三)术后管理的注意事项
若手术未切除食管仅去除部分肌层,术后2 d可进流质饮食,3~4 d后渐改为普通饭;若切除食管行胃代术,则按食管癌术后处理。对全肺切除者,可适当推迟进食时间或多进几天流质饮食,以防食管黏膜破裂或吻合口漏的发生。
九、扩大胸壁切除
近10%的周围型肺癌侵及胸膜及胸壁,国际分期属T3(区别于肿瘤胸膜广泛转移播散的T4),尤其侵及骨性胸壁者,以往多采用局部放疗并化疗,近年来该类患者行肺切除并扩大胸壁切除的报道日渐增多,且效果满意。表3-24-5为部分行胸壁切除患者的生存情况。图3-24-17(a)、(b)为一肺癌患者肿瘤累及胸壁的影像学资料。
表2-24-5 肺切除加胸壁部分切除者生存率概况

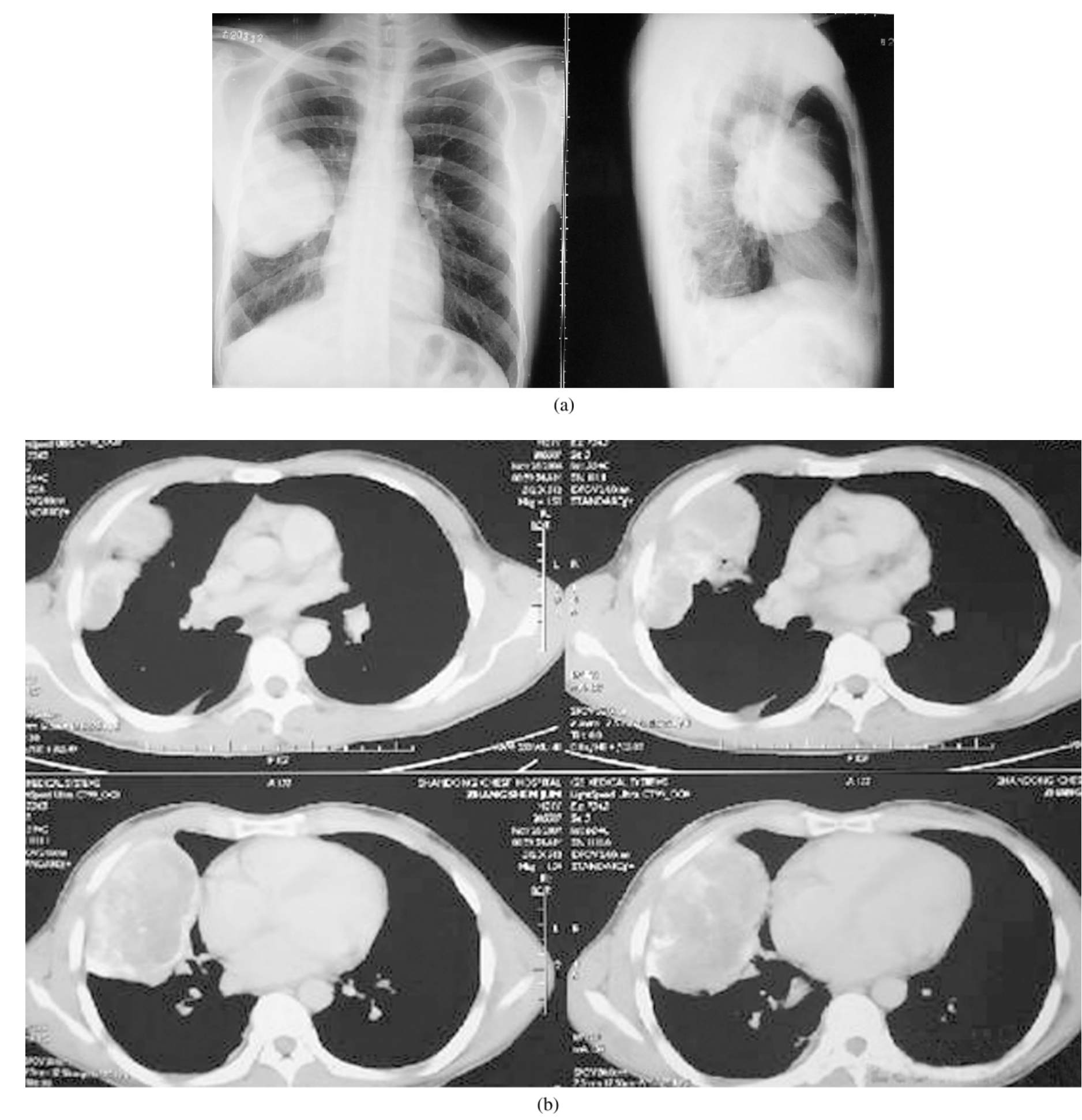
图3-24-17 (a)、(b)为一肺癌患者术前胸片及CT图像,术中切除部分胸壁,重建胸壁
手术范围:对累及壁层胸膜以外,尤其是达肋骨者,应作整块胸壁切除。其范围应超过受累肋骨上、下各1根正常肋骨,前、后缘作肋骨全长或超过病变边缘5 cm以上的整块切除(包括肋骨、胸膜、肋间肌、必要时浅层胸壁肌)。Akay等认为,对肿瘤仅累及部分胸膜者行胸膜扩大切除是可行的,其生存率与胸壁切除无差异。但我们认为,凡是肿瘤累及壁层胸膜者,只要情况许可,均应争取行肺切除加整块胸壁切除术,避免胸膜外肺切除,但对年老体弱者应适当缩小切除范围;否则,Martin-Ucar认为可明显增加并发症及死亡率。
胸壁部分切除后,重建缺损的胸壁是必要的。一般认为,胸壁缺损>6 cm×6 cm时应考虑胸壁重建。但后胸壁由于肩胛骨及厚肌层的保护,10×10 cm以下无需重建;而肩胛角处的缺损,为防止肩胛骨嵌入胸腔,应重建修补,必要时切除肩胛下角。修补时多采用肌瓣(胸大肌、腹直肌、背阔肌等)覆盖,硬质人造材料植入。较理想的材料有Marlex网+骨水泥+Marlex网的三明治修补法等。
胸壁扩大切除的辅助治疗:对于侵犯胸壁的肺癌,术前放疗适于侵犯范围广的患者,总量30 Gy,分10次进行,放疗结束后2周手术。术后放疗能提高生存率,所有该类患者手术后均应放疗。
十、体外循环的应用
对某些局部晚期NSCLC,尤其累及心脏大血管或隆突,常规手术无法切除病灶。对该期肺癌的治疗通常采取放、化疗的模式,由于肿瘤耐药的存在,很大一部分患者预后极差;即使化、放疗有效的患者最终以患者体质不能耐受治疗,或逐渐产生耐药发生远处转移而死亡。对肿瘤侵及周围器官估计手术能切除患者,尤其是无纵隔淋巴结肿大者,采用手术切除并辅以放、化疗的综合治疗,无论近期还是远期效果均较满意。但该类手术难度大,很可能需要在体外循环的辅助下将肿瘤切除,对手术者的操作要求较高;尤其是需要体外循环者还需要相应的仪器设备及心外科技术,可能进一步限制了该类手术的开展;此外,ⅢB期肺癌的现有治疗模式亦禁锢了外科医生的手脚,使许多本来对手术技巧性要求并不高应该能够切除的局部晚期肺癌失去了手术机会。图3-24-18左肺动脉根部为肿瘤包绕,常规手术不能进行手术,应用体外循环后,操作从容。图3-24-19为肿瘤侵入心房内,常规无法切除,体外循环下切除肿瘤。图3-24-20为一肺癌患者术前的CT表现及术中情况,上腔静脉、肺动脉根部、肺上静脉等均需要特殊处理,在体外循环下进行,上腔静脉切除,人造血管置换。
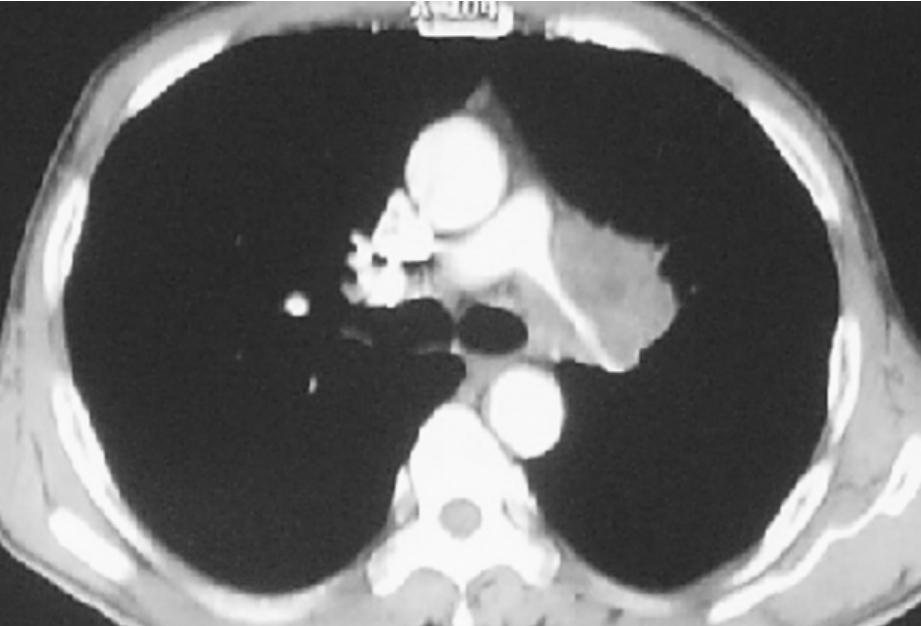
图3-24-18 左肺动脉根部为肿瘤包绕的CT表现,常规手术不能进行
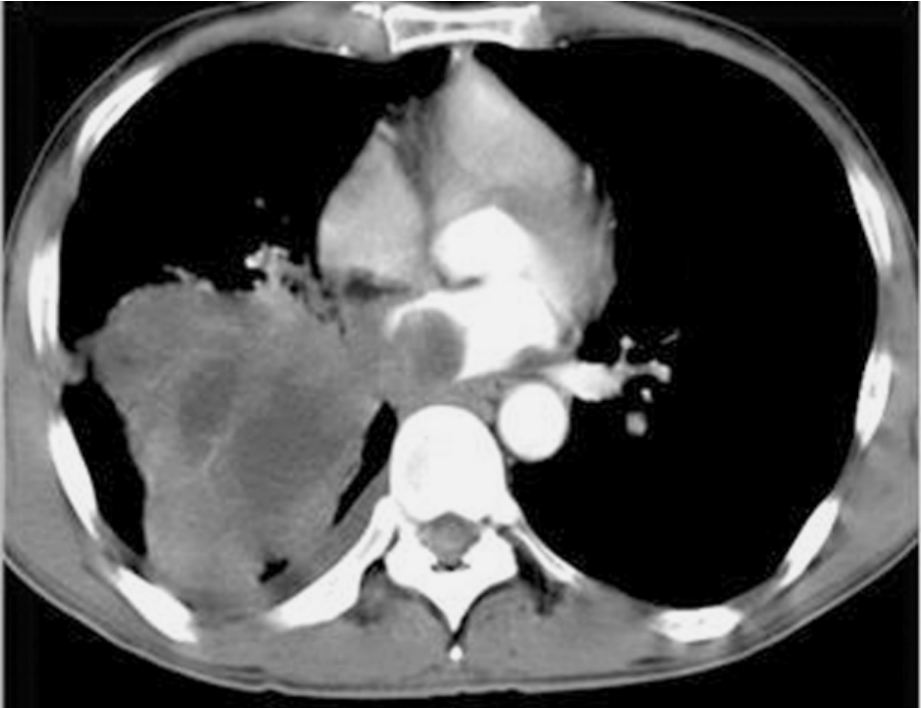
图3-24-19 肿瘤侵入左心房,常规手术无法切除
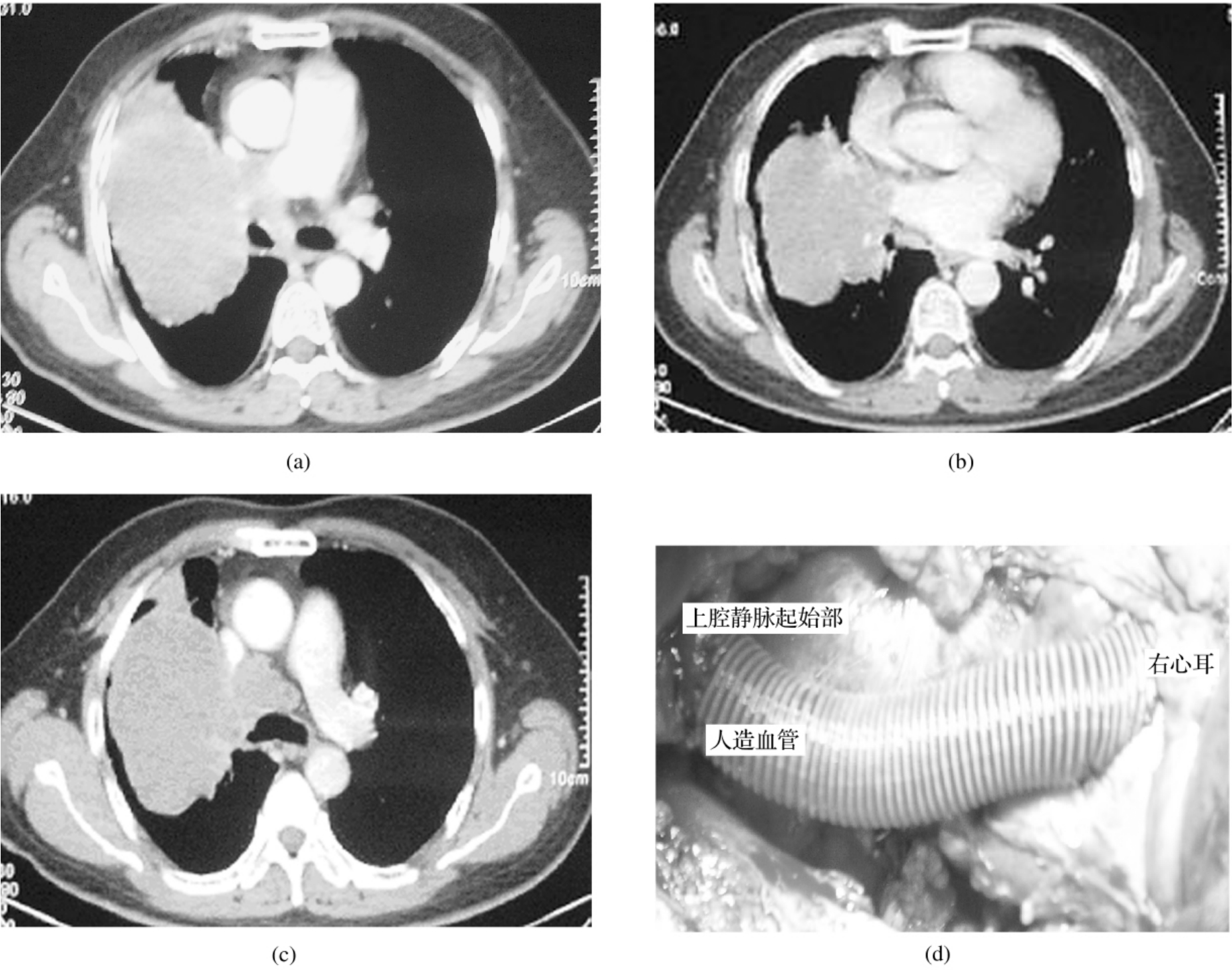
图3-24-20 (a)某患者右肺动脉根部为肿瘤包绕的CT表现,常规手术困难。(b)该患者右肺上静脉为肿瘤侵犯的CT表现,术中切除部分左心房。(c)该患者上腔静脉为肿瘤侵犯的CT表现,切除受累的血管并置换人造血管。(d)该患者切除右肺及上腔静脉,人造血管置换后
Marc等报道了7例体外循环下肺切除术,其中肺肿瘤侵及锁骨下动脉及主动脉弓2例,侵及降主动脉1例,左心房受累2例,隆突切除2例。长期随访中,2例17、25个月无复发,另3例8、13、51个月无复发;2例隆突切除的患者中,1例术后6个月死亡,但并非肿瘤所至,另1例随访72个月无复发。
Baron等在体外循环下对肺癌侵犯左心房的4例患者行手术治疗,2例生存3年,1例生存72个月无复发在随访中。Homma等报道1例肺癌,肿瘤侵及左心房,并于心房内形成瘤栓,体外循环下切开心房取出瘤栓,术后恢复顺利。周清华报道4例肺癌侵犯主动脉,在体外循环下切除肿瘤修补主动脉。
山东省立医院对3例肺肿瘤侵及肺动脉分叉处,常规无法处理肺动脉,在体外循环下直接切除肿瘤,并缝合肺动脉切缘,无手术死亡,其中1例已存活5年余。
(一)手术适应证
1.肺动脉根部受侵如肿瘤侵犯肺动脉至近左、右肺动脉分叉处时,常规方式无法处理肺动脉;或距分叉处较近,手术风险大;或术中分离时肺动脉破裂。此时,可在体外循环下直视剪开肺动脉切除肿瘤,然后连续缝合肺动脉残端,达到根治的目的。
2.肺静脉左心房受侵尤其是左房有瘤栓时,不能直接钳夹处理肺静脉,应在体外辅助下,切开心房取出血栓。
3.主动脉受侵行主动脉切除并修补或置换。
4.有学者将体外循环技术用于肺癌气管全隆突成形术,获得较好的近、远期效果。由于体外循环的应用,无需术中肺的交换,术者可从容进行手术。该部分患者采用股动、静脉插管转流即可。
(二)体外循环辅助肺切除有关手术技术方面的注意事项
1.该患者应用体外循环主要是因为右肺动脉的处理较困难,体外循环的介入不仅使肺动脉处理较安全,而且可扩大切除范围。此外,对术中因手术意外导致肺动脉干破裂,无法常规止血时可考虑先压迫止血,同时建立体外循环再进一步处理。由于体外循环操作复杂,且就现有的资料来看,远期效果与淋巴结状态密切相关,应最好限于无淋巴结转移者。
2.尽量减少转机时间,重要操作完成后即可停机。无需心脏停跳,避免了相应的操作及并发症。
3.注意无瘤操作,区别对待心内吸引器及普通吸引器,最大限度减少术中瘤细胞的播散,术后用温热蒸馏水浸泡胸腔。
4.鉴于体外循环的复杂性及相应并发症,不应轻易使用,如有报道对上腔静脉受累的手术可采用体外循环辅助。笔者认为,肺癌累及上腔静脉无需体外循环辅助,即使肿瘤侵及左、右无名血管。此外,上腔静脉切除后,应用人造血管采用上腔静脉近、远心端吻合,亦可上腔静脉远心端与左心耳吻合,后者可先将人造血管与左心耳吻合,再切除并阻断上腔静脉,然后与上腔静脉远心端吻合,可大大缩短上腔静脉阻断时间,一般无需在血管置换期间再行上腔静脉搭桥引流。
5.术后应注意体外循环相关并发症,尤其对心脏外科与普胸外科已独立的科室,应有心外科医生协助为妥。
十一、余肺切除
余肺切除是指曾因肺癌或其他原因,已手术切除部分肺组织,现又发生肺癌复发或第二原发癌等需要将残余肺切除的手术。由于胸腔粘连严重,手术解剖不清,术后疗效难以肯定等因素,很大一部分患者被放弃手术,其疗效很不理想。但对于某些合适的患者而言,再次手术仍可获得较好的远期生存。鉴于该类手术的复杂性,作为特例将其划为肺癌扩大切除术的范畴。
上海市肺科医院报道一组60例肺癌再手术的病例,余肺肺癌复发36例,第二次原发肺癌24例。术后1、3、5年生存率分别为80%、68.3%、38.3%。中国医科院肿瘤医院报道20例肺癌复发再切除,其1、3、5年生存率分别为94.1%、41.7%、40.0%。协和医科大学肿瘤医院对20例肺癌术后复发再手术,1、3、5年生存率分别为94.1%、41.7%、40.0%。手术切除率及根治率分别为75.0%及80.0%。
(一)手术适应证
该类患者手术相对复杂,手术危险性增加,并发症较多,手术适应证应相对严格,既不能盲目追求可能的长期疗效,使手术指证过分扩大,同时应避免担心手术的风险及术后并发症增加而一味保守治疗的惰性。一般认为:①患者体质较好,心、肺等重要器官的功能可较好的耐受手术;②经充分检查包括骨扫描、颅脑CT或MRI、腹部超声或CT等均无其他转移瘤的证据;③如果肿瘤为复发,估计肿块可手术切除,无淋巴结转移;④如果肿瘤是第二次原发肺癌,估计肿块可手术切除,即使有肺门淋巴结转移而无纵隔淋巴结转移,亦应积极手术。
(二)手术中应注意
二次手术难度大,风险大,主要在于其一是解剖不清晰,其二为术中及术后渗血多。①解剖方面:术中应尽量耐心细致解剖血管及分离粘连,对需要全肺切除的患者可直接打开心包处理血管。这样不仅安全而且使手术变得较为简单,出血明显减少。放疗后肺门粘连更为严重,先处理支气管可能有利于切除。②出血方面:胸膜腔的粘连松解应辨别好层次,胸膜外剥离使手术较为流畅,但术中及术后渗血明显增加;太靠近肺剥离会使肺表面破裂明显增加术中渗血;创面剥离一般用电凝止血,有血运的条索样粘连还是接扎可靠;剥离后的创面应及时用纱布垫压迫止血。术中心包内处理大血管可减少出血。肺切除后应进一步严格止血,可应用热盐水纱布、止血海绵、电刀或氩气刀、生物蛋白胶、结扎、缝扎等各种措施,确实可靠以避免再次开胸手术。
十二、小结
由于局部晚期NSCLC手术复杂、难度较大,对患者创伤大,且术后并发症较高。因此,开展该项手术应慎重,应注意患者病情的准确分期,尤其是淋巴结状态;此外,要综合患者的一般情况,且要把握好时机,结合其他治疗,以便尽可能减少手术的不利因素,最大限度发挥手术在综合治疗中的优势;同时,应当明确,对患者身体情况较好,尤其是T3或T4N0M0的患者,应当果断采取手术治疗,扩大切除相应器官,不要因惧怕手术风险而错过手术时机。
综上所述:①局部晚期NSCLC,很多患者可采取手术治疗,手术仍是提高其生存率的有力手段。②由于手术医师的个体差异性及医院条件限制,效果仍不十分满意。③术前辅助放、化疗的周期及手术的时机的选择得当,可提高生存率且不增加手术危险性。④多学科综合治疗以及使外科治疗达到个体化,应成为下一步胸外科医生努力的方向。
(彭忠民)
参考文献
1.吴一龙.2007中国肺癌临床指南[M].北京:人民卫生出版社,2007:18.
2.吴一龙.肺癌的多学科综合治疗的理论与实践[M].北京:北京人民卫生出版社,2000:43.
3.吴一龙.2007中国肺癌临床指南[M].北京:人民卫生出版社,2007:20-23.
4.吴一龙.肺癌的多学科综合治疗的理论与实践[M].北京:人民卫生出版社,2000:43.
5.赵凤瑞,译.普通胸部外科学[M].沈阳:辽宁教育出版社,1999:27-60.
6.黄孝迈.手术学全集胸外科卷[M].北京:人民军医出版社,1995:26-30.
7.于金明,左文术.现代临床肿瘤学[M].北京:中国科学技术出版社,2006:1 396-1 398.
8.吴一龙,黄植蕃,戎铁华,等.肺癌外科治疗效果的动态对照研究[J].中华胸心血管外科杂志,1992,8(4):250-252.
9.支修益,李世业,陈肖嘉,等.肺癌不同术式外科治疗的评价[J].结核病与胸部肿瘤杂志,1996,2:7-11.
10.吴一龙.2007中国肺癌临床指南[M].北京:人民卫生出版社,2007:22.
11.陈景寒,彭忠民.肺癌的扩大切除研究进展[J].肿瘤防治杂志,2004,11(7):757-760.
12.彭忠民.胸部微创外科学[M].北京:军事医学科学出版社,2009:9.
13.刘奇、刘会宁、彭忠民.实用胸部肿瘤外科学[M].北京:军事医学科学出版社,2007:8.
14.周清华,刘伦旭,刘斌,等.肺切除合并心脏大血管切除重建治疗局部晚期肺癌[J].中国肺癌杂志,2001,4(6):403-406.
15.郭永庆,赵凤瑞,梁朝阳,等.肺癌心包内处理血管的全肺切除手术59例[J].中华胸心血管外科杂志,2001,17(2):82-83.
16.彭忠民,陈景寒,孟龙,等.肺癌累及上腔静脉的外科治疗[J].中华外科杂志,2006,44(6):397-399.
17.彭忠民,陈景寒,杜贾军,等.肺切除加左心房部分切除治疗局部晚期肺癌[J].中国胸心血管外科临床,2003,10(2):105-107.
18.彭忠民,陈景寒,孟龙.肺癌累及左心房或肺静脉根部的外科治疗[J].中国肺癌杂志,2006,9(1):65-67.
19.彭忠民,陈景寒,孟龙,等.肺癌累及食管的外科治疗[J].山东医药,2003,43(33):11-12.
20.彭忠民,陈景寒,孟龙,等.体外循环下切除气管肿瘤1例[J].中华胸心血管外科杂志,2005,21(5):271.
21.彭忠民,陈景寒,孟龙,等.体外循环下切除累及右肺动脉根部左心房及上腔静脉的肺癌1例[J].中华胸心血管外科杂志,2005,21(6):333.
22.杨浩贤,吴一龙,凌莉,等.纵隔淋巴结切除方式对非小细胞肺癌患者术后生存的影响-4个相关研究的Meta分析[J].循症医学,2002,2(3):132-139.
23.Jones SR,Detterbeck FC.Surgery for stageⅠnon-small cell lung cancer[M].Diagnosis and treatment of lung cancer,2001,177-190.
24.Detterbeck FC,Egan T.Surgery for stageⅡnon-small cell lung cancer.Diagnosis and treatment of lung cancer,an evidence based for the practice clinician[M].Philadelphia:Saunders,2001:191-197.
25.Rusch VW,Giroux DJ,Kraut MJ,et al.Induction chemoradiation and surgical resection for non small cell lung carcinomas of the superior sulcus:Initial results of Southwest Oncology Group Trial 9416(Intergroup Trial 0160)[J].J Thorac Cardiovasc Surg,2001,121(3):472-483.
26.Wu YL,Liao ML,Jiang GL,et al.Consensus of diagnosis and treatment for local advanced stage non-small cell lung cancer[J].Chin J Oncol,2002,24(6):576-578.
27.Vansteenkiste JF,De Leyn PR,Deneffe GJ,et al.Clinical prognostic factors in surgically treated stageⅢA2N2 non-small cell lung cancer:analysis of the literature[J].Lung Cancer,1998,19(1):3 213.
28.Wu YL,Huang ZF,Wang SY,et al.A randomized trial of systematic nodal dissection in resectable nonsmall cell lung cancer[J].Lung Cancer,2002,36(1)∶126.
29.Yang HX,Wu YL,Ling L,et al.Effectiveness of extent of lymphadenectomy for survival in patients with resectable non small celllung cancer.A meta-analysis for 4 relative studies[J].J Evidence based Med,2002,2(3):132-139.
30.Urschel JD,Urschel DM,Anderson TM,et al.Prognostic implications of pulmonary satellite nodules:are the 1997 staging revisions appropriate[J].Lung Cancer,1998,21(2):83-87.
31.Detterbeck FC,Jones DR.Surgery for stageⅢB non-small cell lung cancer.In:Detterbeck FD,Rivera MP,Socinski MA,et al.eds.Diagnosis and treatment of lung cancer,an evidence based for the practice clinician[J].Philadelphia:Saunders,2001,283-289.
32.Zhou QH,Liu LX,Liu B,et al.Lobectomy or pneumonectomy combined with extended resection of the heart,great vessels in the treatment of locally advanced non small cell lung cancer[J].Lung cancer,2003,41(Suppl 2):S33.
33.Detterbeck FC,Bleiweis MS,Ewend MG.Surgical treatment of stageⅣnon small cell lung cancer.In:Detterbeck FD,Rivera MP,Socin ski MA,et al.Diagnosis and treatment of lung cancer,an evidence-based for the practice clinician[M].Philadelphia:Saunders,2001:326-338.
34.Fox W,Scadding JG.Medical research council comparative trial of surgery and radiotherapy for primary treatment of small-celled or oatcelled carcinoma of bronchus.Ten year follow up[J].Lancet,1973,2(7820):63-65.
35.Johnson BE,Bridges JD,Sobczeck M,et al.Patients with limited stage Small cell lung cancer treated with concurrent twice-daily chest radiotherapy and etoposide/cisplatin followed by cyclophosphamide,doxorubicin,and vincristine[J].J Clin Oncol,1996,14(3):806-813.
36.Passlick B.Can surgery improve local control in small cell lung cancer[J].Lung Cancer,2001,33(Suppl 1):147-151.
37.Meyer JA.Indications for surgical treatment in small cell carcinoma of the lung[J].Surg Clin North Am,1987,67(5):1 103-1 115.
38.Inoue M,Nakagawa K,Fujiwara K,et al.Results of preoperative mediastinoscopy for small cell lung cancer[J].Ann Thorac Surg,2000,70(5):1 620-1 623.
39.Shepherd FA,Evans WK,Feld R,et al.Adjuvant chemotherapy following surgical resection for small-cell carcinoma of the lung[J].J Clin Oncol,1988,6(5):832-838.
40.Kawahara K,Akamine S,Tsuji H,et al.Bronchoplastic procedures for lung cancer:clinical study in 136 patients[J].World J Surg,1994,18(6):822-825.
41.Groenendijk RP,Croiset van Uchelen FA,et al.Factors related to outcome after pneumonectomy:retrospective study of 62 patients[J].Eur J Surg,1999,65(3):193-197.
42.Mehran RJ,Deslauriers J,Piraux M,et al.Survival related to nodal status after sleeve resection for lung cancer[J].J Thorac Cardiovasc Surg,1994,107(2):576-82;discussion 582-583.
43.Tedder M,Anstadt MP,Tedder SD,et al.Current morbidity,mortality,and survival after bronchoplastic procedures for malignancy[J].Ann Thorac Surg,1992,54(2):387-391.
44.Jensik RJ,Faber LP,Kittle CF.Segmental resection for bronchogenic carcinoma[J].Ann Thorac Surg,1979,28(5):475-483.
45.Ginsberg RJ,Rubinstein LV,et al.Randomized trial of lobectomy versus limited resection for T1 N0 nonsmall cell lung cancer.Lung Cancer Study Group[J].Ann Thorac Surg,1995,60(3):615-622.
46.Albertucci M,DeMeester TR,Rothberg M,et al.Surgery and the management of peripheral lung tumor adherent to the parietal pleura[J].J Thorac Cardiovasc Surg,1992,103(1):8-12.
47.Carrel T,Nachbur B,Veraguth P.An bloc resection for bronchogenic carcinoma with chest wall invasion:value of preoperative radiotherapy[J].Eur J Cardiotherac Surg,1990,4(10):534-537.
48.Paulson DL.The“superior sulcus”lesion[A].Delarue NC,Eschapasse H.International Trends in General ThoracicSurgery[M].Philadelphia:WB Saunders,1985.
49.Mitchell JD,Mathisen DJ,Wright CD,et al.Resection for bronchogenic carcinoma involving the carina:long-term results and effect of nodal status on outcome[J].J Thorac Cardiovasc Surg,2001,121(3):465-471.
50.Yamato Y,Souma T.Surgical treatment of T4 lung cancer :combined resection of lung and heart or great vessels[J].Kyobu Geka,1997,50(2):114-119.
51.Zhou QH,Lin LX,Wang Y,et al .Results of extended resection of the left atrium,great vessels,or both for locally advanced lung cancer[J].Lung cancer,1997,18(suppl 1):68-69.
52.Wu YL,Huang ZF,Wang SY,et al.A randomeized trial of systematic nodal dissection in respectable non small cell lung cancer[J].Lung cancer,2002,36:1-6.
53.Martini N,Bains MS,Burt ME,et al.Incidence of local recurrence and second primary tumors in resected stage I lung cancer[J].J Thorac Cardiovasc Surg,1995,109(1):102-129.
54.Ishida T,Yano T,Maeda K,et al.Strategy for lymphadenectomy in lung cancer three centimeters or less in diameter[J].AnnThorac Surg,1990,50(5):708-711.
55.Takahashi T,Akamine S,Morinaga M,et al.Extended resection for lung cancer invading mediastinal organs[J].Jpn J Thorac Cardiovasc Surg,1999,47(8):383-387.
56.Doddoli C,Rollet G,Thomas P,et al.Is lung cancer surgery justified in patients with direct mediastinal invasion[J].Eur J Cardiothorac Surg,2001,20(2):339-343.
57.Bernard A,Bouchot O,Hagry O,et al.Risk analysis and long-term survival in patients undergoing resection of T4 lung cancer[J].Eur J Cardiothorac Surg,2001,20(2):344-349.
58.Pitz CC,Brutel de la Riviere A,van Swieten HA,et al.Results of surgical treatment of T4 non-small cell lung cancer[J].Eur J CardiothoracSurg,2003,24(6):1 013-1 018.
59.Shinada J,Yoshimura H.Concomitant surgical resection of lung neoplasms and neighbouring organs[J].Kyobu Geka,2000,53(8 Suppl):678-683.
60.Shimizu J,Ishida Y,Hirano Y,et al.Cardiac herniation following intrapericardial pneumonectomy with partial pericardiectomy for advanced lung cancer[J].Ann Thorac Cardiovasc Surg,2003,9(1):68-72.
61.Deslauriers J,Gregoire J,Jacques LF,et al.Sleeve lobectomy versus pneumonectomy for lung cancer:a comparative analysis of survival and sites or recurrences[J].Ann Thorac Surg,2004,77(4):1 152-1 156.
62.De Leyn P,Rots W,Deneffe G,et al.Sleeve lobectomy for non-small cell lung cancer[J].Acta Chir Belg,2003,103(6):570-576.
63.Ferguson MK,Lehman AG.Sleeve lobectomy or pneumonectomy:optimal management strategy using decision analysis techniques[J].Ann Thorac Surg,2003,76(6):1 782-1 788.
64.Hollaus PH,Wurnig PN,Pridun NS.Bronchoplastic procedures for the resection of malignant bronchial neoplasms[J].Chirurg,2002,73(11):1 115-1 122.
65.Chunwei F,Weiji W,Xinguan Z.et al.Evaluations of bronchoplasty and pulmonary artery reconstruction for bronchogenic carcinoma[J].Eur J Cardiothorac Surg,2003,23(2):209-213.
66.Kawahara K,Shirakusa T.Carinal resection for lung cancer[J].Kyobu Geka,2001,54(1):36-41.
67.Pfannschmidt J,Kugler C,Muley T,et al.Non-small-cell superior sulcus tumor:results of en bloc resection in fifty-six patients-non-small-cell pancoast[J].Thorac Cardiovasc Surg,2003,51(6):332-337.
68.Karmy-Jones R,Vallieres E,et al.Non-small cell lung cancer with chest wall involvement[J].Chest,2003,123(5):1 323-1 325.
69.Dilege S,Toker A,Tanju S,et al.Chest wall invasion in lung cancer patients[J].Acta Chir Belg,2003,103(4):396-400.
70.Roviaro G,Varoli F,Grignani F,et al.Non-small cell lung cancer with chest wall invasion:evolution of surgical treatment and prognosis in the last 3 decades[J].Chest,2003,123(5):1 341-1 347.
71.Facciolo F,Cardillo G,Lopergolo M,et al.Chest wall invasion in non-small cell lung carcinoma:a rationale for en bloc resection[J].J Thorac Cardiovasc Surg,2001,121(4):649-656.
72.Burkhart HM,Allen MS,Nichols FC 3rd,et al.Results of en bloc resection for bronchogenic carcinoma with chest wall invasion[J].J Thorac Cardiovasc Surg,2002,123(4):670-675.
73.Akay H,Cangir AK,Kutlay H,et al.Surgical treatment of peripheral lung cancer adherent to the parietal pleura[J].Eur J Cardiothorac Surg,2002,22(4):615-620.
74.Martin-Ucar AE,Nicum R,Oey I,et al.En-bloc chest wall and lung resection for non-small cell lung cancer.Predictors of 60-day non-cancer related mortality[J].Eur J Cardiothorac Surg,2003,23(6):859-864.
75.Tan ZB,Lamichhane N,Thakur B,et al.How we performed chest wall reconstruction:analysis 31 cases[J].Indian J Cancer,2003,40(1):27-30.
76.Spaggiari L,Thomas P,Magdeleinat P,et al.Superior vena cava resection with prosthetic replacement for non-small cell lung cancer:long-term results of a multicentric study[J].Eur J Cardiothorac Surg,2002,21(6):1 080-1 086.
77.Lequaglie C,Conti B,Brega-Massone PP,et al.The difficult approach to neoplastic superior vena cava syndrome:surgical option[J].J Cardiovasc Surg,2003,44(5):667-671.
78.Chida M,Handa M,Yaginuma G,et al.Combined resection of distal aortic arch for T4N0 non-small-cell lung cancer with aortic arch invasion[J].Jpn J Thorac Cardiovasc Surg,2001,49(9):576-580.
79.Rice TW,Blackstone EH.Radical resections for T4 lung cancer[J].Surg Clin North Am,2002,82(3):573-587.
80.Homma S,Satoh H,Ishikawa S,et al.Left atrial thrombus in a patient with lung cancer[J].Int J Clin Pract,2004,58(1):100-102.
81.Baron O,Jouan J,Sagan C,et al .Resection of bronchopulmonary cancers invading the left atrium-benefit of cardiopulmonary bypass[J].Thorac Cardiovasc Surg,2003,51(3):159-161.
82.Ishiyama T,Aoyama T,Hirahara H,Kyobu Geka.et al.Successful resection of endotracheal metastatic lung cancer using percutaneous cardiopulmonary support system:a case report[J].2001,54(1):19-23.
83.De PM,Fadel E,Mussot S,et al.Resection of locally advanced(T4)non-small cell lung cancer with cardiopulmonary bypass[J].Ann Thorac Surg,2005,79(5):1 691-1 696
84.Vaporciyan AA,Rice D,Correa AM,et al.Resection of advanced thoracic malignancies requiring cardiopulmonary bypass[J].Eur J Cardiothorac Surg,2002,22(1):47-52.
85.Baron O,Jouan J Sagan C,et al.Resection of bronchopulmonary cancers invading the left atrium-benefit of cardiopulmonary bypass[J].Thorac Cardiovasc Surg,2003,51(3):159-161.
86.Spaggiari L,Magdeleinat P,Kondo H,et al.Results of superior vena cava resection for lung cancer[J].Analysis of prognostic factors[J].Lung Cancer,2004,44(3):339-346.
87.Grunenwald DH.Resection of lung carcinomas invading the mediastinum,including the superior vena cava[J].Thorac Surg Clin,2004,14(2):255-263.
88.Spaggiari L,Regnard JF,Magdeleinat P,et al.Extended resections for bronchogenic carcinoma invading the superior vena cava system[J].Ann Thorac Surg,2000,69(1):233-236.
89.Shargall Y,de Perrot M,Keshavjee S,et al.15 years single center experience with surgical resection of the superior vena cava for non-small cell lung cancer[J].Lung Cancer,2004,45(3):357-363.
90.DiPerna CA,Wood DE.Surgical management of T3 and T4 lung cancer[J].Clin Cancer Res,2005,1(13 Pt 2):5038s-5044s.
91.Bernard A,Bouchot O,Hagry O,et al.Risk analysis and long-term survival in patients undergoing resection of T4 lung cancer[J].Eur J Cardiothorac Surg,2001,20(2):344-349.
92.Bobbio A,Carbognani P,Grapeggia M,et al.Surgical outcome of combined pulmonary and atrial resection for lung cancer[J].Thorac Cardiovasc Surg,2004,52(3):180-182.
93.Dyszkiewicz W,Piwkowski C,Kasprzyk M,et al.Extended pneumonectomy for non small cell lung cancershould we still do it[J].Neoplasm,2004,51(2):150-154.
94.Spaggiari L,D'Aiuto M,Veronesi G,et al.Extended pneumonectomy with partial resection of the left atrium,without cardiopulmonary bypass,for lung cancer[J].Ann Thorac Surg,2005,79(1):234-240.
95.Ratto GB,Costa R,Vassallo G,et al.Twelve-year experience with left atrial resection in the treatment of non-small cell lung cancer[J].Ann Thorac Surg,2004,78(1):234-237.
96.Takahashi T,Akamine S,Morinaga M,et al.Extended resection for lung cancer invading medistinal organs[J].Jpn J Thorac Cardiovasc Surg,1999,47(8):383-387.
97.Shirakusa T,Kawahara K,Iwasaki A,et al.Extended operation for T4 lung carcinoma[J].Ann Thorac Cardiovasc Surg,1998,4(3):110-118.
98.Zhou Q H,Liu L X,Yang Z H,et al.Long-term results of extended resection of heart and great vessels in the treatment of locally advanced lung cancer[J].Lung Cancer,2003,41(supple 2):194-196.
99.Doddoli C,Rollet G,Thomas P,et al.Is lung cancer surgery justified in patients with direct mediastinal invasion[J].Eur J Cardiothorac Surg,2001,20(2):339-343.
100.Bernard A,Bouchot O,Hagry O.Risk analysis and long-term survival in patients undergoing resection of T4 lung cancer[J].Eur J Cardiothorac Surg,2001,20(2):344-349.
101.Felip E,Rosell R.Neoadjuvant chemotherapy in non-small cell lung cancer[J].Curr Med Chem,2002,9(8):893-898.
