合理选用抗生素
第一节 合理选用抗生素
自从发明了磺胺药及青霉素以来,各种新型抗生素层出不穷,对人类控制感染性疾病做出了巨大的贡献。但由于抗生素的不正确使用等其他原因,耐药菌不断出现,使人类面临着严重的挑战,合理应用抗生素成为减少细菌耐药的关键。要做到合理应用抗生素,必须掌握常用抗生素的作用机理、药代动力学、不良反应及细菌产生耐药的机制。
一、抗生素的作用机理
(一)干扰细胞壁的合成
可破坏细胞壁结构,影响细胞壁合成,从而使细胞溶解死亡。主要有β-内酰胺类抗生素(如青霉素、头孢菌素类)、磷霉素、万古霉素、杆菌肽等。
(二)影响细胞膜的功能
主要为多烯类及多肽类药物。多烯类抗生素如两性霉素、制霉菌素等与真菌细胞膜上的固醇类结合,咪唑类如咪康唑、酮康唑等也抑制真菌细胞膜上的固醇类的合成而影响其通透性。由于普通细菌的细胞膜上不含固醇类,故对细菌无效。
(三)抑制菌体蛋白质的合成
与30 S与50 S核糖体亚基结合而抑制蛋白质合成。包括氨基糖苷类、四环素类、氯霉素类、大环内酯类、林可霉素类等。
(四)干扰核酸代谢
利福平可与DNA依赖的RNA聚合酶的β亚单位结合,抑制mRNA的转录。氟喹诺酮类作用于DNA旋转酶。
(五)其他
1.抑制叶酸合成 磺胺类药通过与细菌竞争二氢叶酸合成酶而使细菌核酸代谢受阻。
2.抑制结核菌环脂酸的合成 结核杆菌细胞壁有结核环脂酸,异烟肼、乙硫异烟胺可抑制结核环脂酸合成酶,导致细胞壁缺损,菌体死亡。
表4-34-1 抗菌药物的作用机理分类

3.其他 干扰叶酸合成,如磺胺药。
二、细菌耐药机理
(一)灭活酶的产生
β-内酰胺酶、氨基糖苷钝化酶、氯霉素乙基转换酶及红霉素酯酶等。
1.β-内酰胺酶:β-内酰胺酶的产生是当前革兰阴性杆菌主要的耐药机制,它不但能分泌出菌体,破坏β-内酰胺类抗生素,而且还可以通过质粒介导分四种方式在微生物间互相转移:①转导(transduction):通过噬菌体将耐药基因转给敏感的细菌;②转化(transformation):耐药菌溶解后释出DNA进入敏感的菌体内;③接合(conjugation):耐药菌敏感菌接触后交换耐药因子,如大肠杆菌可与痢疾杆菌,肺炎杆菌接合而造成耐药的传播;④易位(translocation):耐药基因从一质粒转移到另一个质粒,从质粒转移至染色体,最后可引起流行。
β-内酰胺酶是数量最多、最复杂的一组酶,已发现200多种,主要分类方法有Bush分类法(Ⅰ~Ⅳ)和Ambler分类法(A、B、C、D)。BushⅠ类为头孢菌素酶(C类),可水解头孢菌素类抗生素;BushⅡ类为质粒介导的酶,主要包括青霉素酶、经典的广谱酶、ESML、耐酶抑制剂的青霉素酶、羧苄青霉素酶、邻氯青霉素酶、头孢菌素酶及碳青霉烯酶等;BushⅢ类(C类):为金属酶,可水解大多数β-内酰胺抗生素及碳青霉烯类抗生素;BushⅣ类是洋葱假单胞菌产生的一种染色体介导的青霉素酶,它不但可以水解β-内酰胺类,而且耐棒酸。
超广谱β-内酰胺酶(ESBLs)是由细菌质粒介导的能水解氧亚氨基β-内酰胺抗生素,并可被β-内酰胺酶抑制剂如棒酸抑制的一类β-内酰胺酶。氧亚氨基β-内酰胺抗生素包括第三代头孢菌素如头孢他定等及单环类抗生素如氨曲南,也包括第四代头孢菌素如头孢吡肟。ESBLs也能水解各种青霉素。ESBLs主要由克雷伯菌属和大肠埃希菌,也可由其他肠杆科细菌、不动杆菌及铜绿假单孢菌产生。主要分为TEM型、SHV型、OXA型、CTX-M型及其他基因型。
质粒介导的AmpC β-内酰胺酶1989年首次分离出来,现已报到了20余种,常见于克雷伯菌、沙门菌、弗劳地枸橼酸杆菌、产气肠杆菌、奇异变形杆菌及大肠埃希菌,常携带大质粒,同时编码对其他类抗生素的耐药性,表现为对1~3代头孢菌素、头霉素、氨基苷类及抗假单胞菌青霉素(几乎所有的抗生素)均耐药,但对碳青霉烯类、四代头孢和氟喹诺酮类敏感。可用头霉素耐药作为筛选指标,并用头霉素3相试验和氯唑西林抑制试验证实。
耐酶抑制剂广谱酶:原因包括对酶抑制剂敏感的酶的大量产生,或产生了耐酶抑制剂的β-内酰胺酶。纸片法表型检测为阿莫西林和替卡西林耐药,对阿莫西林/克拉维酸和替卡西林/克拉维酸中介耐药,而对头胞菌素敏感。此法可检出87%单独产生或与TEM同时产生IRT的大肠埃希菌,但不能区分OXA和IRT。
2.氨基糖苷钝化酶氨基糖苷类钝化酶也主要是革兰阴性杆菌耐药机制。目前已有20种,分磷酸、乙酰及核苷转移酶等。
3.氯霉素乙基转换酶可将氯霉素转化为无活性的代谢产物,由质粒控制。主要由某些金葡菌、表葡菌及革兰阴性菌产生。
4.红霉素酯酶如质粒介导的大肠埃希菌酯酶可水解大环内酯类抗生素的内酯环,使其灭活。
(二)靶位点的改变
如核糖体亚基改变,为大环内酯类抗生素耐药的主要机制。改变DNA旋转酶靶位及细菌细胞膜的通透性常为氟喹诺酮类的耐药机制。青霉素结合蛋白的改变是革兰阳性菌耐β-内酰胺抗生素的最主要机制。
(三)渗透障碍
由于细菌细胞外膜通透性的改变,抗生素无法进入细胞内达到作用部位而发挥抗菌作用。其主要包括外膜渗透力下降及主动泵出。外膜是革兰阴性细菌所特有的,为双层脂质结构,是抗生素特别是疏水抗生素通过的屏障。亲水性抗生素通过外膜是借助外膜微孔蛋白的存在。抗生素分子越大、负电荷越多、亲水性越弱,其通过外膜的可能性越小。在某些情况下细菌的外膜微孔蛋白可减少或消失,外膜的通透性下降,使抗生素难以进入,该细菌及发生了耐药。主动泵出指某些细菌可将进入细菌细胞内的抗生素再排除,从而导致抗生素在细菌内的药物积累减少而产生耐药。主要见于四环素、大环内酯类抗生素及氟喹诺酮类抗生素。
(四)改变代谢途径
本种耐药机制较少。
三、抗菌药物的常见副作用
(一)神经系统损害
1.大剂量青霉素(4 200~8 000万U)、哌拉西林、泰能、异烟肼等可导致癫痫发作。
2.氯霉素、乙胺丁醇可致视神经炎。
3.链霉素等氨基苷类、万古霉素、红霉素(>4 g/d)可致听神经损害。
4.氨基苷类、多黏菌素、林可霉素、四环素类可致神经肌肉接头阻滞。
5.异烟肼、乙胺丁醇、甲硝唑可致周围神经病变。
(二)肾脏损害
常见肾毒性药物有氨基苷类、万古霉素、两性霉素B、多黏菌素B和E、头孢噻啶等。
(三)肝脏损害
四环素、异烟肼、利福平可直接损害肝脏,某些头孢类抗生素如头孢噻啶、头孢噻吩、氨苄西林、羟苄西林、苯唑西林、偶可致转氨酶升高,利福平、红霉素偶可致黄疸。
(四)血液系统
氯霉素可致再生障碍性贫血,青霉素类、头孢类、磺胺类、两性霉素B等也可偶致白细胞或血小板减少,或凝血功能异常。
(五)消化道反应
大环内酯类、氟喹诺酮类易发生恶心、呕吐。
(六)过敏反应
青霉素类最易发生过敏性休克,其他可见药物热、药疹、多形红斑等。
(七)伪膜性结肠炎
又叫抗菌药物相关性结肠炎,长期应用抗生素致菌群失调,难辨芽孢梭菌及其毒素致病。主要表现为严重水样便,恶臭有乳白或棕绿色伪膜。CCFA培养基大便培养可确诊。治疗:停用抗生素,口服万古霉素、灭滴灵或杆菌肽,维持内环境稳定。
四、临床常用抗生素
(一)β-内酰胺类抗生素
β-内酰胺类抗生素疗效高而毒性小,在抗菌药物中开发品种最多,是目前治疗感染性疾病的主要药物。包括青霉素类、头孢菌素类、碳青霉烯类、单环类、氧头孢烯类及β-内酰胺酶抑制剂。
1.青霉素类自1940年青霉素投入使用以来,该类抗生素以其疗效确切,可首选用于革兰阳性球菌所致的感染,对人体细胞毒性小且价格低廉而广泛应用于临床。目前,青霉素类抗生素已从抗阳性菌窄谱品种发展到广谱品种。
(1)第一代 主要为青霉素,抗革兰阳性球菌,对少数革兰阴性球菌如淋球菌、脑膜炎球菌亦有效。其优点为抗菌谱窄而强,毒性低;缺点为:不耐酸,不能口服,对β-内酰胺酶不稳定,对产酶菌无效。
(2)第二代 其特点为广谱、抗酸(可口服)、耐青霉素酶(主要用于金葡菌),主要包括苯唑西林、氨苄西林、阿莫西林、氟氯西林等。
其中又分为:①氨基青霉素类:耐青霉素酶,包括氨苄西林及阿莫西林,二者抗菌活性相似,氨苄西林对志贺氏菌属,流感嗜血杆菌效果好,而阿莫西林对粪链球菌、沙门菌效果好。②羧基类青霉素:包括羧苄西林、替卡西林、替莫西林。主要用于抗绿脓及吲哚阳性变形杆菌。③脲基类青霉素:包括哌拉西林、美洛西林、阿洛西林,抗绿脓杆菌及其他革兰阴性杆菌效果好。④脒基青霉素:主要为美西林。仅作用于肠杆菌科细菌的PBP-2,能抑制含β-内酰胺酶的大肠杆菌,与青霉素及其他β-内酰胺类有协同作用。
(3)第三代抗菌谱更广,多为复合制剂,如安灭菌(阿莫西林+棒酸)、优立新(氨苄西林+青霉烷砜)、特治星(哌拉西林+他唑巴坦)。
2.头孢菌素类 头孢菌素类是50年代开始应用的抗生素,为7-氨基头孢烷酸(7-ACA)的衍生物。头孢菌素比青霉素的β-内酰胺环张力小,故较青霉素稳定,并且具有抗菌谱广、杀菌力强和抗青霉素酶的双重特点,过敏反应少。目前,头孢菌素类抗生素的头孢烯类已从第一代发展到第四代,头孢烯类和氧头孢烯类已使头孢菌素从抗需氧发展到抗需氧与抗厌氧菌的双重广谱作用。其特点为抗菌谱广、耐酶、临床疗效高、毒性低;缺点为对肠球菌作用差,根据对β-内酰胺酶稳定性和抗菌作用分为4代。
(1)第一代 针对革兰阳性球菌,对肠球菌、绿脓杆菌、黏质沙雷菌无效,对大肠杆菌、克雷伯杆菌、变形杆菌多敏感。包括先锋霉素Ⅳ、Ⅴ、Ⅵ及头孢克洛。
(2)第二代 抗菌谱广,对革兰阳性、革兰阴性菌均有效,但抗革兰阳性菌作用不如一代头孢,抗革兰阴性菌作用不如二代头孢,病原菌不明时可作为经验用药。常用的为(西力欣)及头孢呋新脂(新菌灵)。
(3)第三代 对β-内酰胺酶更稳定,抗菌谱更广,对绝大多数革兰阴性菌有强大杀菌作用,脑脊液活性高,但对革兰阳性菌作用不如第一代,对肠球菌无效。主要包括头孢曲松、头孢他定、头孢哌酮、头孢噻肟、头孢唑肟、头孢磺啶、(莫敌)。其中头孢地嗪有免疫调节作用。
(4)第四代 针对超广谱β-内酰胺酶,对革兰阳性菌有一定抗菌活性,对革兰阴性菌作用相当或优于第三代,对β-内酰胺酶十分稳定。包括头孢正罗(cefpirome)、头孢吡肟(cefepime)、头孢克里定(cefclidin)。
盐酸头孢吡肟(马斯平)具有高度水溶性,能快速穿透细菌外膜带负电荷的微孔通道,对许多β-内酰胺酶具有低亲和力,其作用部位为许多主要的青霉素结合蛋白PBPs。其杀菌力强,抗菌谱广,对革兰阳性菌的抗菌活性优于第三代头孢菌素和亚胺培南;对革兰阳性菌包括产革兰阴性内酰胺酶菌株有明显的抗菌作用,对MRSA的MIC90为4 μg/ml,与头孢噻肟相似;对革兰阴性菌包括假单胞菌、埃希大肠杆菌等亦有很好的抗菌作用,对绿脓杆菌的MIC90为8 μg/ml,与头孢他啶相似;对厌氧菌包括类杆菌、产气夹膜梭状菌等也有很好的抗菌作用,但对脆弱类杆菌和难辨梭状菌无效。实验研究表明,头孢吡肟可应用于耐药机制复杂、治疗困难的细菌,如弗劳地枸橼酸杆菌、肠杆菌属及假单孢菌属所致的感染。
3.碳青霉烯类 碳青霉烯是一组新型β-内酰胺类抗生素,其结构不同于传统的β-内酰胺类产品如青霉素和青霉烯类,母核与其他青霉烷、青霉烯不同之处在于5元环上由碳代替了硫,且2,3位之间存在一个C=C双键,另外其6位羟乙基侧链为反式构象。研究证明,正是这个构型特殊的基团,使该类化合物对β-内酰胺酶具有高度的稳定性。与通常青霉烯的顺式构象显著不同。该类抗生素具有抗菌谱广的特点,对革兰阳性和革兰阴性菌、需氧菌、厌氧菌都有很强的抗菌活性,且对β-内酰胺酶稳定。已上市品种有亚胺培南/西司他汀、帕尼培南/倍他米隆及美罗培南,完成临床试验的有比阿培南。
(1)泰能(Tienam) 主要为亚胺培南(Imipenem),抗菌谱广,活性强,但在体内被肾近曲小管细胞刷状缘中的去氢肽酶-1灭活,需加西司他丁(Cilastatin),合剂称为泰能(Tienam),为目前临床应用抗菌素中抗菌作用最强的品种之一。
(2)美罗培南(Meropenem) 本品是继亚胺培南/西司他汀联合给药后在美国上市的第2个非肠道给药的半合成碳青霉烯类抗生素。是由日本住友制药公司与英国ICI制药公司开发的。目前已在意大利、瑞典、英国、德国、日本及美国上市。本品与亚胺培南不同,对DPH-Ⅰ稳定,故不需与酶抑制剂西司他汀合用。本品抗革兰阴性菌的能力是亚胺培南的4~64倍,对某些革兰阳性菌比亚胺培南弱1/2~1/3,对厌氧菌的作用是相似的。本品对腹部组织、胆汁、水疱液、炎症渗出物、炎症时的脑积液、妇科组织、呼吸道组织、泌尿道组织有良好的穿透作用,组织中水平往往等于或高于敏感菌的治疗水平。由于本品的广谱抗菌活性,因此在尚未确定致病菌前的治疗中本品可单独使用。
美罗培南适用于由溶血性链球菌、大肠杆菌、肺炎杆菌、绿脓杆菌、脆弱拟杆菌、多形拟杆菌和胃蛋白酶链球菌属引起的腹内感染(并发的阑尾炎和腹膜炎)及3月龄以上儿童由肺炎链球菌、嗜血流感杆菌(产生β-内酰胺酶和非β-内酰胺酶的菌株)、脑膜炎奈瑟菌和相关敏感菌株引起的细菌性脑膜炎。本品的适应证将扩展到其他领域。
4.单环β-内酰胺类抗生素 单环β-内酰胺类是以3-氨基单胺菌素酸(3-AMA)为母体的一类衍生物。该类抗生素是一类抗需氧革兰阴性阴性杆菌的窄谱抗生素,其特点是对革兰阳性需氧菌和绿脓杆菌有强大的抗菌作用,对革兰阳性菌和厌氧菌抗菌活性极低,对β-内酰胺酶稳定,毒性低,与青霉素类和头孢菌素类无交叉过敏反应。主要品种有氨曲南(Aztreonam)、卡芦莫南、吡拉莫南、替吉莫南、格洛莫南、肟莫南等。氨曲南是最早应用于临床的单环类β-内酰胺类抗生素,抗菌谱主要包括常见的细菌如大肠杆菌、克雷伯杆菌、沙雷杆菌、奇异变形杆菌、吲哚阳性变形杆菌、枸橼酸杆菌、流感嗜血杆菌、绿脓杆菌等及其他假单胞菌、某些肠杆菌属、淋球菌等。对产气杆菌、阴沟肠杆菌的作用高于头孢他啶,但低于庆大霉素;对绿脓杆菌的作用低于头孢他啶,与庆大霉素相近;对于质粒传导的β-内酰胺酶较第三代头孢菌素稳定。卡芦莫南的抗菌谱与氨曲南相似,对肟型酶更稳定,对肠杆菌和沙雷杆菌作用较强;吡拉莫南对绿脓杆菌、肠杆菌、不动杆菌有较强作用;替吉莫南是高效口服单环菌素;肟莫南是第二代单环菌素,抗菌活性和对酶的稳定性均很好,格洛莫南为其前体药物,是高效口服单环菌素。
5.氧头孢烯类 氧头孢烯是头孢菌素分子中硫原子被氧原子所取代,具有7-α-甲氧基的化合物,如拉氧头孢(moxalactam Latamoxef)、氟氧头孢(flomoxef)。拉氧头孢抗菌性能与第三代头孢菌素相近,对多种细菌有良好的抗菌作用,对大肠杆菌、流感杆菌、克雷伯杆菌、各型变形杆菌、肠杆菌属、枸橼酸杆菌属、沙雷杆菌等高度敏感,对厌氧菌(如拟杆菌)有良好的抗菌作用。本品耐β-内酰胺酶,微生物对本品很少发生耐药性。氟氧头孢抗菌性能与第四代头孢菌素相近,对MRSA、厌氧菌(包括拟杆菌)抗菌作用强,抗菌谱主要包括葡萄球菌、链球菌(肠球菌除外)、肺炎链球菌、消化链球菌、卡他球菌、大肠杆菌、克雷伯杆菌、变形杆菌、流感嗜血杆菌及拟杆菌等。
6.β-内酰胺酶抑制剂 目前用于临床的β-内酰胺酶抑制剂主要包括棒酸(克拉维酸,Clavulanic acid)、舒巴坦(青霉烷砜,sulbactam)、他唑巴坦(tazobactam,青霉烷砜的衍生物)。主要含酶抑制剂的抗生素为有以下几种。
(1)舒他西林(unasyn) 本品由美国辉瑞公司率先开发,1987年在日本以“优立新”的商品名首先上市。该品系氨卞西林与β-内酰胺酶抑制剂舒巴坦钠(青霉烷砜)缩合的酯类药物。它具有较氨卞西林单用抗菌谱广、抗菌活性强、口服易吸收、血药浓度高、半衰期长、尿中排泄量增多等特点。本品尤其对产生质粒性青霉素酶的葡萄球菌、大肠杆菌、克雷伯肺炎杆菌引起的呼吸系统、泌尿生殖系统、皮肤和软组织、消化系统、中枢神经系统、骨与关节感染、败血症或脓毒血症治疗均具有良好的疗效。我国临床应用的有进口品和国内生产的“优立新”、舒氨新、舒氨西林、凯兰欣、凯德林、舒安西林(别名舒他西他)等。
(2)奥格门丁(augmentin) 本品为阿莫西林与克拉维酸钾(棒酸钾)的复方制剂。它是英国比切姆公司在80年代初率先推出的第一个β-内酰胺酶抑制剂和半合成青霉素组成的复方制剂,我国目前临床应用的此种药品有进口品,如“安美汀”片剂和干糖浆,“阿莫克拉”滴剂、片剂和混悬液。国产品有“安灭菌”粉针与片剂,“安克片”,“阿摩克拉片”,“安奇”片和颗粒剂和棒酸钾与阿莫西林复方颗粒剂等。
(3)替曼丁(timentin) 替卡西林+棒酸复方制剂,该药对绿脓杆菌有高效,比羧苄西林强2~4倍。临床上替曼丁用于治疗败血症、肾盂肾炎、膀胱炎和呼吸、泌尿系统感染,也用于白血病及恶性肿瘤患者的继发感染,对伤寒也很有效。本品只能注射不能口服,其规格有静注粉针剂3.2 g(含棒酸200 mg,替卡西林3 g),1.6 g(含棒酸100 mg,替卡西林1.5 g)和800 mg(含棒酸50 mg,替卡西林750 mg)。其中棒酸是钾盐,替卡西林是钠盐,按1∶15的比例配伍而成。目前,我国临床应用的均为进口品,尚未见国产品上市。
(4)特治星(Tazocillin) 哌拉西林钠与他唑巴坦的复方制剂,两者比例8∶1。他唑巴坦是青霉烷砜类的一个新衍生物,是一个高效的β-内酰胺酶抑制剂。它抑制青霉素酶和头孢菌素酶比舒巴坦强10倍。哌拉西林钠与他唑巴坦有良好的药动学同步性,可使产酶性耐药菌由对哌拉西林耐药转为敏感,对金葡菌产生的青霉素酶和革兰阴性杆菌产生的β-内酰胺酶均有很强的抑制作用。此复合制剂可应用于绿脓杆菌、大肠杆菌和其他肠杆菌科细菌所致的败血症、肺部感染、胆道感染、腹腔感染、妇科感染、尿路感染等。国内已有生产,如海他欣等。
(5)哌拉西林钠与舒巴坦复合制 剂哌拉西林钠和舒巴坦的复合制剂。国内有进口原料分装产品上市,其商品名为“特灭菌”。规格为1.8 g(哌拉西林钠1 g,舒巴坦钠0.8 g)。
(6)舒普深(sulperazon) 头孢哌酮/舒巴坦的复合制剂,惟一的三代头孢菌素与酶抑制剂的复合制剂。头孢哌酮与舒巴坦在体内的血清浓度曲线是平行的,且随剂量增加而呈比例增加,使二者在体内保持协同作用。舒普深可从血液迅速渗透到组织和体液中达到治疗浓度,广泛分布于胆汁、尿液、肺组织、腹水、骨组织、烧伤组织渗液、脑脊液及子宫内膜等,只需低浓度的舒巴坦即可足以与头孢哌酮一起对常见致病菌呈现协同作用。舒普深对产生β-内酰胺酶细菌的MIC90值比头孢哌酮的MIC90值下降4倍以上,对不产生β-内酰胺酶细菌的MIC90值比头孢哌酮的MIC90值下降2倍以上。其抗菌活性超过哌拉西林钠/他唑巴坦,尤其在产TEM型超广谱β-内酰胺酶的细菌。其诱导细菌产生β-内酰胺酶的活性远远低于头孢唑林、头孢唑肟等常见抗生素,减少单独应用对细菌耐药的诱导,延缓了细菌耐药的出现。目前国内有多种产品上市。
(二)氨基糖苷类
其分为三类:第一类由链霉素属的培养滤液中提取,包括链霉素、巴龙霉素、核糖霉素、妥布霉素。第二类由小单孢菌属的滤液中提取,包括庆大霉素、西索米星、小诺霉素、阿司米星、达地米星。第三类为半合成氨基糖苷类,包括丁胺卡那霉素、地贝卡星、异帕米星、阿贝卡星。本类药品水溶性好,性质稳定,抗菌谱较广,与β-内酰胺类抗生素有协同作用,但单独使用很快产生耐药,胃肠吸收不良,仅供肌注或静脉用药。其主要副作用有神经肌肉阻滞,耳毒性,肾毒性,其他有:胃肠道症状、白细胞下降,血小板下降,血清谷氨酸丙酮酸转氨酶升高等。
(三)大环内酯类
1.特点 对革兰阳性细菌疗效好,对某些革兰阴性菌如脑膜炎球菌、淋球菌、流感杆菌、百日咳杆菌也有较强的抑制作用,对支原体、衣原体、军团菌、螺杆菌亦有效;且口服生物利用度好,组织浓度高,能渗透入细胞,对细胞内感染有效;对细菌生物膜(Biofilm)有抑制作用,可与其他抗生素合用治疗产生生物膜细菌所致的慢性感染。本类药物尚具有免疫调节作用,可用于治疗弥漫性泛细支气管炎。主要包括:①14环大环内酯类:如红霉素、地红霉素、罗红霉素、甲红霉素、氟红霉素。②15环大环内酯类:如阿齐霉素。③16环大环内酯类:如麦迪霉素、螺旋霉素、乙酰螺旋霉素、柱晶白霉素、交沙霉素、罗他霉素、美欧卡霉素。
2.几种常用药品的特点
(1)罗红霉素 半衰期长,2次/d用药即可,对敏感金葡菌、军团菌、淋球菌、沙眼衣原体的作用与红霉素相似,对弯曲杆菌、流感杆菌、卡他布兰汉菌作用强于红霉素。
(2)阿齐霉素 生物利用度好,组织穿透力强,细胞内浓度高,痰中浓度高于血中浓度,抗生素后续作用(PAE)长(流感杆菌、化脓性链球菌、肺炎链球菌PAE可达3~3.5 d)。适用于呼吸道感染,且对肺炎支原体、人形支原体、解脲支原体、沙眼衣原体、鹦鹉热衣原体、梅毒螺旋体、包柔螺旋体、溶组织阿米巴、鼠弓形虫均有明显作用,扩大了大环内酯类的治疗范围。可用于性病治疗。
(3)氟红霉素 对厌氧菌作用强于红霉素。
(4)地红霉素 作用弱于红霉素2~4倍,但对百日咳杆菌作用强于红霉素4倍,半衰期20 h,组织浓度较同期血浓度高20~40倍。
3.不良反应 除伪膜性肠炎外均非致命性。其他包括①胃肠道反应明显,16环轻微。②血管刺激:不能静脉注射,可稀释静脉点滴。③过敏反应:皮疹、发热、嗜酸粒细胞增加。④胆汁淤积性肝炎:停药可恢复。⑤暂时听力减退:可逆,药物对中枢听力通道作用。⑥伪膜性肠炎:难辨芽孢杆菌所致。⑦抑制肝脏代谢酶,使下述药物体内浓度升高,如地高辛、甲基强的松龙、氨茶碱、华法令、卡马西平。
4.常见药物用法、用量 红霉素:0.25~0.5 g,3次/d,或20~30 mg/(kg·d),分2次静脉滴注。螺旋霉素:2~3 g/d,2~4次/d。乙酰螺旋霉素:0.8~1.2 g/d,4次/d。交沙霉素:0.8~1.2 g/d,4次/d。罗红霉素:0.15 g,2次/d。阿齐霉素:0.5 g,1次/d。
(四)氟喹诺酮类
80年代以来,新的氟喹诺酮类抗生素迅速发展,主要品种有诺氟沙星(氟哌酸)、培氟沙星(培氟新,甲氟哌酸)、乙诺沙星(氟啶酸)、氧氟沙星(氟嗪酸,泰利必妥,奥复星)、环丙沙星等,新开发的品种主要有洛美沙星、氟罗沙星、芦氟沙星、左氧沙星、司帕沙星、加替沙星及莫西沙星等,新品种的主要特点为半衰期长,增强对阳性球菌及厌氧菌的抗菌作用。
1.抗菌特点 包括:①对肠杆菌科作用强,球菌(革兰阳性)作用差。②尿中浓度极高,治疗泌尿系感染的理想药物,无合并症的泌尿系统感染3 d即可,延长时间并不提高治愈率。③环丙及氧氟沙星对结核有效,并可进入细胞治疗细胞内感染,对军团菌、支原体、衣原体亦有一定作用。④在支气管上皮细胞内浓度高,适用于呼吸道感染,但不是首选,首选β-内酰胺类及大环内酯类。⑤多数肠道感染对本类药物敏感。⑥淋球菌敏感,可用于治疗淋球菌感染。
2.耐药情况 耐药增多,均为染色体介导。一为DNA旋转酶靶位的变化,二为细胞外膜渗透性的改变,自发突变耐药发生率低。
3.主要不良反应 包括:①胃肠道反应:较多见。②中枢神经系统反应:失眠、欣快、头痛、头晕、癫痫发作等。③过敏及皮肤反应:皮疹、红斑及光敏反应。④关节病:环丙沙星可致关节疼痛,停药可恢复,可影响软骨发育,不适用于孕妇及儿童。⑤肝肾功能损害。
4.相互作用 包括:①与氯霉素、利福平拮抗,与氨基糖苷类或β-内酰胺类合用无影响。②与非甾体抗炎药,如布洛芬(阿可匹林除外)合用可致癫痫。③抑制肝药酶,使茶碱浓度升高。(https://www.daowen.com)
(五)四环素类
已很少应用,常用的有四环素类为土霉素等,主要用于:①由衣原体、或解脲支原体引起的非特异性尿道炎如子宫颈炎、前列腺炎等;②早期霍乱的防治;③各种立克次氏体感染,如斑疹伤寒、Q热、恙虫病;④布鲁斯病;⑤其他:鼠疫、炭疽、回归热、野兔热、梅毒等。
(六)磺胺类
临床应用日益减少,复方新诺明(SMZ/TMP)及磺胺嘧啶钠仍在使用。SMZ/TMP为防治卡氏肺囊虫性肺炎的首选药物。主要副作用为肝肾毒性、药疹、骨髓抑制等。
(七)万古霉素
万古霉素为窄谱抗生素,对各种革兰阳性球菌及革兰阴性杆菌均具有强大的抗菌作用。葡萄球菌包括MRSA、MRSE均对万古霉素非常敏感,少有耐药菌株。肠球菌则有耐药菌株出现。革兰阴性杆菌对本品耐药。本品有明显的耳毒性及肾毒性,随着制造工艺的改进,本品的纯度已达93%以上,毒副作用明显降低。临床上主要用于革兰阳性球菌,尤其是MRSA及肠球菌引起的严重感染。国产的去甲万古霉素作用比万古霉素略强,但纯度明显低于万古霉素,副作用因而也较万古霉素发生率高。
(八)磷霉素
为广谱抗生素,对革兰阳性球菌及革兰阴性杆菌均有抗菌活性,但单用时作用不强。本品与其他类抗生素间无交叉耐药,可与β-内酰胺类、氨基糖苷类合用,有协同作用。本品无明显毒副作用,轻、中度感染时可单用,重度感染时则需与β-内酰胺类、氨基糖苷类等合用。
(九)林可霉素类
包括林可霉素及克林霉素两种,其中克林霉素的抗菌活性较林可霉素高4~8倍。本品为窄谱抗生素,其抗菌谱比红霉素略窄,主要针对革兰阳性球菌如肺炎球菌、溶血性链球菌等,肠球菌和所有的革兰阴性球菌及杆菌对本品耐药。各类厌氧菌及大多数放线菌对本品敏感。本品毒副作用轻,主要用于革兰阳性球菌和厌氧菌引起的感染。
(十)抗真菌抗生素
随着器官移植、肿瘤、艾滋病等免疫低下患者治疗过程中不断出现严重的真菌感染,寻找和开发新型高效广谱的抗真菌药物的需求也不断增长。近2年来,新的微生物来源的抗真菌抗生素得到了飞速发展。它们作用于真菌细胞的各个生物合成阶段,如真菌的细胞膜、细胞壁以及蛋白质合成等过程。
1.多烯类(polyenes)抗生素
(1)两性霉素B(amphotericin B,AMB)及其新制剂AMB是惟一可静脉注射临床使用的多烯类抗真菌抗生素。它能与真菌细胞膜中的麦角甾醇结合并导致氧化,具有杀真菌活性强、抗菌谱广等特点。但AMB有较强的肾毒性。用法:自0.1 mg/(kg·d)始,逐渐增至0.5~1 mg/(kg·d),每日或间日给药。在2~6 h内(20~30滴/min)避光滴注,疗程6~12周。其毒副作用较大,主要为肾毒性、胃肠道反应、血栓性静脉炎、寒战、高热和头痛等。最近开发上市及临床研究的AMB新制剂主要有3类:①AMB脂质体(AmBisome):是用脂质体将AMB包裹而成;②脂质复合体(lipidcomplex,AMLC):是脂类与AMB交织而成;③胶体分散剂(colloidaldispersion,ABCD,商品名Amphocil和Amphotec):是用硫酸胆固醇与等量的AMB制备而成。它们都是以脂类为介质制成的。所有这些制剂给药后均分布于体内网状内皮系统丰富的脏器(如肝脾),减少肾组织内药物积聚,降低肾毒性,因而可加大剂量,提高疗效。对曲霉菌、播散性念珠菌病、艾滋病合并隐球菌性脑膜炎等严重感染有较好的疗效。脂质AMB剂型成人每日用量为3~5 mg/kg,适用于深部真菌感染伴显著肾功能损害者、难治性侵袭性真菌感染或不能耐受AMB或经AMB普通制剂治疗失败者。
(2)制霉菌素脂质体(nyotranstatin,NYS) 制霉菌素能结合麦角甾醇,降低细胞膜稳定性,对多种真菌有活性,但在胃肠道不易吸收,且其毒性严重,临床应用受到很大限制。Aronex公司Johnson等研制成脂质体,商品名为Nytran,不仅大大地提高了疗效,而且降低了毒副作用,现已完成Ⅲ期临床。
2.吡咯类抗真菌药 本类抗真菌药的主要作用机理为抑制细胞色素P450依赖的14α-固醇去甲基酶,破坏了真菌细胞的完整结构。常用的有氟康唑及伊曲康唑,氟康唑在临床上广泛用于治疗各种念珠菌病和隐球菌病,其水溶性高、蛋白结合率低、半衰期长、体液分布广泛,并可通过血脑屏障。但对球孢子菌病、组织胞质菌病和着色芽生菌病则疗效较差。伊曲康唑尚可用于曲霉菌病、组织胞浆菌病和着色芽生菌病。氟康唑用法:成人每日1次,每次200~400 mg,口服或静脉给药,疗程宜长。氟康唑虽可通过血脑屏障,但抗真菌的效能并不高,应与其他高效及毒副作用大的抗真菌药物合用。氟康唑体内外抗念珠菌的作用远低于AMB,二者连用时效能反而降低,出现拮抗现象。氟康唑与5-氟胞嘧啶的连用则呈协同作用。
3.影响真菌核酸合成和功能的抗真菌药 常用的为灰黄霉素及5-氟胞嘧啶(5-Fu),主要干扰真菌的DNA合成。其抗真菌谱狭窄,主要对念珠菌、隐球菌和光滑球拟酵母菌有较强的抗菌活性。5-Fu口服后吸收迅速而完全,半衰期约为4 h,用量为每日0.5 mg/kg,主要副作用为胃肠道反应、肝功损害、药疹、白细胞或血小板下降等。多不单用,可与氟康唑合用,呈协同作用。
4.作用于真菌细胞壁 真菌细胞壁具有许多杀真菌活性的靶部位。参与真菌细胞壁合成的许多合成酶是真菌特有的,如β-1,3葡聚糖合成酶、聚乙酰氨基葡糖合成酶等。这是目前研究抗真菌药物的一个重要领域。脂肽类抗生素就是抑制β-1,3葡聚糖合成酶的一组药物,包括棘球白素、睫状真菌素等。多氧霉素D及尼可霉素(Z和X)则作用于几丁质合成酶而抑制真菌细胞壁合成。
5.作用于蛋白质合成的抗真菌抗生素 在蛋白合成过程中,真菌和哺乳动物细胞需要2种延长因子,即延长因子-1(EF-1)和延长因子-2(EF-2)参与多肽链的延伸。然而,真菌需要一种哺乳动物中不存在的延长因子-3(EF-3)。现已发现,它广泛存在于真菌细胞中,是一种相对分子质量(120~125)×103的蛋白。至今尚无EF-3抑制剂用于抗真菌的研究报道。Merck研究室发现,尽管哺乳动物中含有EF-2,但它可以作为抗真菌药的靶向目标。
五、合理选用抗生素的原则
(一)掌握各种抗生素的抗菌活性及其特点,包括抗菌谱、抗菌活性及药代动力学。
(二)确定病原菌
1.细菌培养及药敏实验:采用不同方法,采用不同标本,用不同培养基做病原学检查。
2.标本革兰染色涂片检菌。
3.免疫学检查。
(三)注意宿主因素对药物的影响
1.既往药物反应史 如过敏史。
2.年龄因素 老人、孕妇及婴幼儿用药注意副作用。
(四)注意药物毒性
如肾毒性、肝毒性、神经系统毒性、血液系统毒性、过敏性休克等。
(五)尽可能减少耐药性
1.严格掌握适应证,防止滥用明确的病毒感染或原因不明的发热均不应使用抗生素,抗生素的预防仅限于风湿热、流行性脑脊髓膜炎、白喉及腹腔污染性手术等。
2.合理的剂量与应用方法浓度达不到治疗范围,不但无效,反而易诱导耐药菌产生,防止长时间低浓度用药。
3.避免同一医院在某一时间内反复大量使用某几种抗菌药物,应有计划的在一段时间内减少或暂停使用该类抗生素以防止产生多种耐药菌。
(六)抗生素后效应理论与临床合理用药
1.抗生素后效应(Postantibiotic effects,PAE)的概念系指细菌与抗生素短暂接触,当药物清除后,细菌生长仍然受到持续抑制的效应,这是抗生素对其作用靶细菌特有的效应。
2.PAE产生机理尚未完全明确,可能是抗生素与细菌短暂接触后,抗生素与细菌靶位持续性结合,引起细菌非致死性损伤,从而使其靶位恢复正常功能及细菌恢复再生长时间延长;或是应用抗生素后促进白细胞效应(PALE)即抗生素与细菌接触后,菌体变形,易被吞噬细胞识别和吞噬,于是出现抗生素与白细胞协同杀菌效应,从而使细菌修复时间延长。
3.常见抗生素的PAE时间 一般作用于细菌细胞核糖体抑制蛋白质合成的药物如氨基糖苷类、大环内酯类、林可霉素类、氯霉素类、四环素类等有很明显的PAE。抑制DNA旋转酶的氟喹诺酮类药物对革兰阳性球菌和革兰阴性杆菌的PAE也较长。β-内酰胺类抗生素PAE值不尽相同,与药物同其作用靶位青霉素结合蛋白(PBP)的结合位点与亲和力有关。β-内酰胺类对革兰阳性球菌多有明显PAE,对革兰阴性杆菌PAE较小甚至呈负值。但碳青霉烯类药物对革兰阴性杆菌PAE很长;此外,头孢噻肟、阿莫西林、哌拉西林等因可使细菌产生球状体,其恢复正常形态和继续生长的时间较长,故也有较长的PAE。药物浓度对多数药物的PAE有明显的影响,尤其对氨基糖苷类药物、氟喹诺酮类等的PAE影响更为显著。药物与细菌接触时间也是PAE的重要影响因素。
4.对临床用药的指导作用
(1)评价抗菌药物药效学的指标,设计给药方案PAE可作为设计更合理给药方案的重要依据之一。以往认为,应用各种抗生素治疗需维持血药浓度在最低抑菌浓度以上才能发挥良好的抗菌作用,而PAE的提出向这种传统的给药模式提出了挑战。对于PAE较长的药物,即使经过4~5个半衰期已在体内清除,由于对细菌的抑制作用仍持续存在,故仍可适当延长给药间隔时间,减少给药次数,这样既保证疗效又降低不良反应。如氨基糖苷类峰浓度作用于细菌后,虽然其浓度逐渐下降至低于MIC浓度,但由于PAE长,持续抑制细菌生长,故目前主张每日1次给药即可,可减少用药量,降低药物毒性。阿齐霉素PAE较长,每日1次给药即可。
(2)联合用药的评价 以往对联合用药方案常通过测定联合药敏,计算抑菌指数(FIC)来评价其合理性,目前也可通过检测PAE来评价。评价标准:两药联合后PAE值比各药单独的PAE之和延长1 h以上为协同作用,相近为相加作用;与单药PAE较大值相近为无关作用;比单药PAE较小值还小为拮抗作用。
(七)中性粒细胞减少肿瘤患者抗生素用药原则
在有高度危险因素的患者,静脉用药可选择马斯平单用或加氨基糖苷类,或与万古霉素联用。
六、抗生素的联合应用
(一)联合目的
扩大抗菌谱、产生协同作用,增强抗菌能力,延缓耐药的产生。
(二)协同作用的机制
1.β-内酰胺酶抑制剂+β-内酰胺类抗生素:可防止抗生素被水解,提高临床效果。
2.β-内酰胺类抗生素抑制细菌细胞壁合成,可以增强氨基糖苷类向细菌内透入,增强抗菌活性。
3.磺胺与TMP合用可序贯抑制细菌生化代谢过程中的不同酶,增加疗效。
4.双重抑制细菌细胞壁的合成,如美西林作用于细胞壁PBP2,而β-内酰胺类其他品种则作用于其他的PBP,合用增加疗效。
5.氟喹诺酮类抗生素可与其他类抗生素合用,多有相加或协同作用。
6.大环内酯类可与其他抗生素合用治疗产生生物膜细菌所致的慢性感染。
(三)联合用药的适应证
1.肠球菌感染 青霉素或氨苄西林+庆大或妥布霉素联用;现多用万古霉素。
2.绿脓杆菌感染 抗绿脓杆菌的青霉素或三代头孢菌素+氨基糖苷类或环丙沙星。
3.金葡菌感染耐酶青霉素+庆大霉素,MRSA则选万古霉素。
4.免疫功能低下的患者(肿瘤、血液病等)合并感染常需联合用药。
5.多种细菌混合感染。
6.抗结核治疗。
7.重症感染在取得病原资料之前。
(四)联合用药的弊端
1.配伍不当可产生拮抗 如①抑菌抗生素(红霉素、四环素、氯霉素)不宜与β-内酰胺类抗生素联合应用,前者可能降低后者的抗菌活性。②红霉素、林可霉素类、氯霉素类的作用机制均为与细菌核糖体50 S亚基结合,同时应用可竞争靶位而产生拮抗作用。③抑菌类抗生素亦不宜与氨基苷类合用,因为此举可能妨碍后者主动转运进入菌体。④某些抗生素如头孢西丁、头孢孟多可诱导产生β-内酰胺酶,尤其在治疗肠杆菌属、沙雷菌、绿脓杆菌时,所以与其他β-内酰胺类合用可降低后者活性。
2.容易出现二重感染。
3.增加过敏反应和毒性反应。
4.增加医疗费用。
七、厌氧菌感染的特点及治疗
(一)厌氧菌特点
包括①种类多。②寄生期长。③数量多:人体四大细菌库皮肤、会阴、肠道、口腔,均以厌氧菌为主。正常成人大便350 g/d,一半为细菌,其中99%~99.9%为厌氧菌。④分布广。⑤多为有益菌。⑥与人体健康关系密切:新生儿出生2~4 h双岐杆菌、乳酸杆菌在人体定居,叫原藉菌群,后来的叫外藉菌群。⑦吸入感染以厌氧菌为主。⑧细菌毒力低。
(二)发病机理
正常情况下一般不发生厌氧菌感染,多见于机体抵抗力低,或局部氧化还原电势低,如阻塞性肺炎、缺氧等情况下,易与需氧菌混合感染。
(三)厌氧菌感染的诊断
厌氧菌感染的临床线索:
①腐臭的分泌物(大肠杆菌为葱臭);②有坏死物及假膜生成;③反复需氧培养为阴性;④与恶变、外伤、缺血、缺氧有关;⑤反复应用氨基苷类抗生素;⑥吸入性肺炎。厌氧菌感染的细菌学线索:①常规需氧培养“阴性”的无菌脓液;②常规培养阴性而涂片镜检见革兰染色形态一致的大量细菌;③常规培养物腐败恶臭时;④在普通培养基深层有菌落生长;⑤能在有氨基苷类的培养基上生长(促进厌氧菌生长);⑥厌氧菌培养可确诊。
(四)厌氧菌感染的治疗
可选用大剂量青霉素、洁霉素、头孢菌素或甲硝唑、替硝唑等治疗。甲硝唑治疗厌氧菌感染有以下独特的优越性:①无毒—有不良反应而非毒性;②副作用小;③可多方式给药;④给药后血药浓度可迅速达有效浓度;⑤可透过血脑屏障;⑥多途径给药在各种组织可达有效浓度;⑦与抗生素无配伍禁忌;⑧不易产生二重感染及菌群失调;⑨很少耐药;⑩抗厌氧菌最有效的药物。
八、肾功不良时用药
(一)第一类
肾功不良时不需或仅稍减量的药物:①青霉素类:氯唑西林、苯唑西林、哌拉西林。②头孢菌素类:头孢噻肟、头孢哌酮、头孢他啶、头孢三嗪。③四环素类:强力霉素,二甲胺四环素。④大环内酯类:红霉素、克林霉素。⑤抗结核药:异烟肼、利福平。⑥其他:氯霉素、甲硝唑、酮康唑。
(二)第二类
仅严重肾功能不良时须减量的药物:①青霉素类:青霉素、氨苄西林、阿莫西林、阿洛西林。②头孢菌素类:先锋霉素Ⅴ、Ⅵ,头孢西丁、头孢呋新等。③其他:林可霉素、磺胺类。
(三)第三类
对肾脏有毒性作用;肾功能不良时须明显减量和监测血药浓度的药物:①青霉素类:羧苄西林。②氨基苷类:庆大霉素、妥布霉素等。③其他:多黏菌素B、万古霉素、乙胺丁醇。
(四)第四类
肾功不良时禁用,如杆菌肽、四环素、呋喃坦啶、萘啶酸。
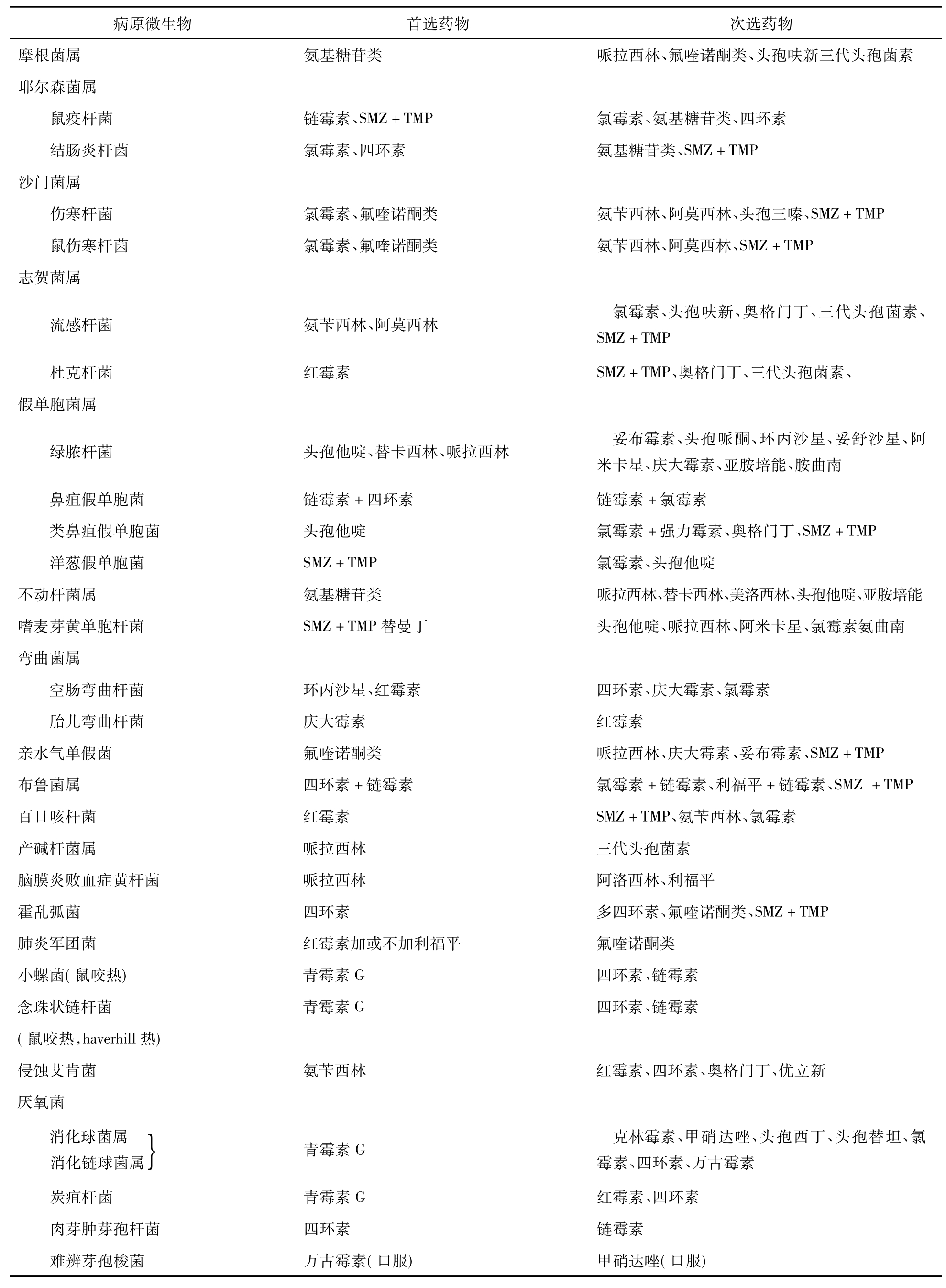
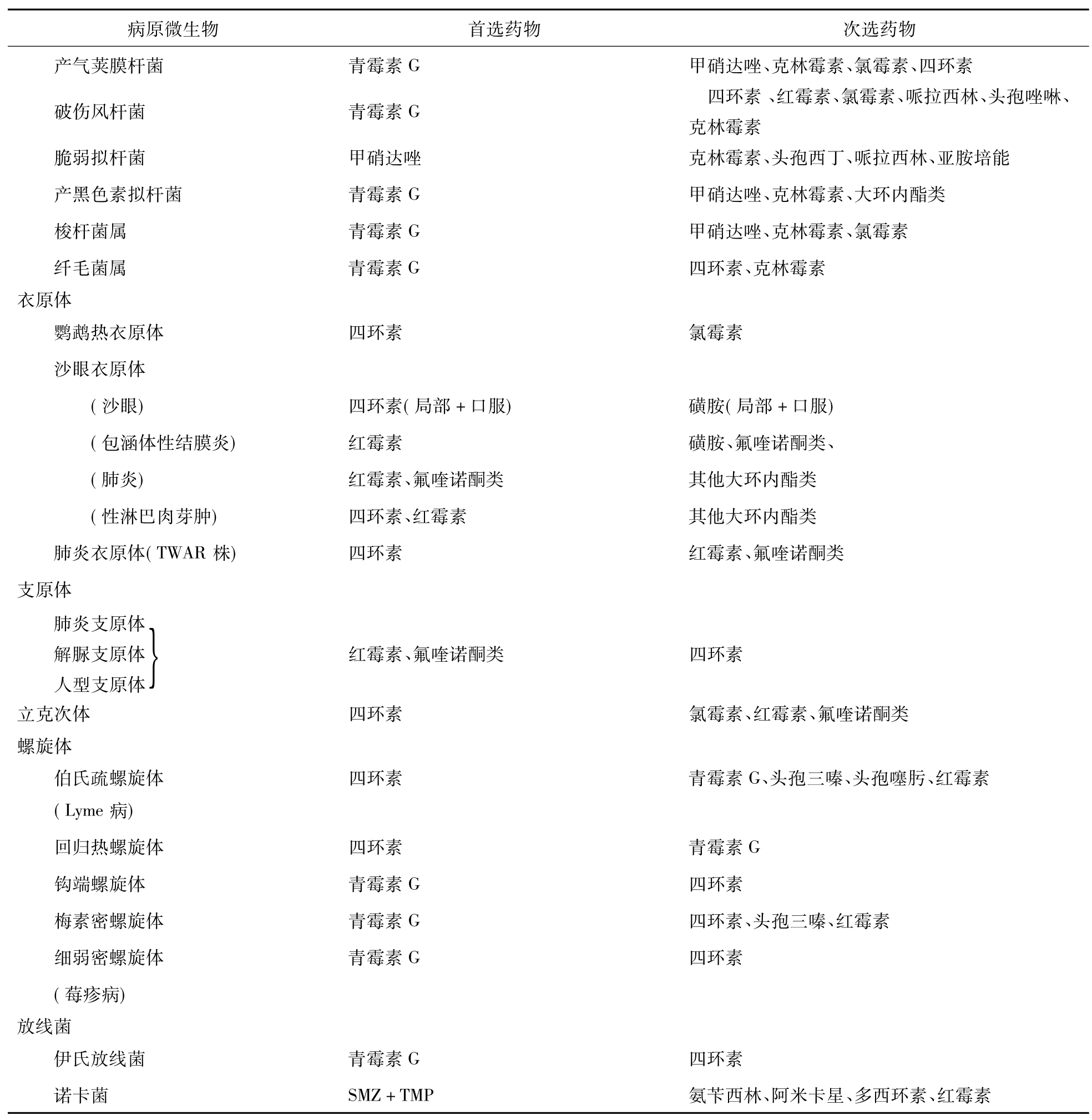
九、常用抗菌药物的选用
见表4-34-2。
表4-34-2 抗菌药物的选用

(续 表)
(续 表)
(张黎明)
