上肢肌肉渐进性疲劳过程中大脑皮层脑源特征分析
引言:目前研究脑源定位的技术方法很多,例如,fMRI技术和PET技术,但是,这些技术各有利弊。PET技术首先需要在体内注入少量的放射性物质,然后再通过断层扫面技术测量大脑各个部位放射量,进而推断不同脑区的活动。fMRI的空间分辨率较高,但是时间分辨率较低,其时间分辨率较低主要受神经活动所产生的生理变化过程需要一定反应时间的限制。因此,fMRI的时间分辨率是其在被使用时受限的一个方面,而且fMRI和PET这两种技术测试的费用都非常昂贵,不便于一般学者对科学研究的开展。
EEG记录具有较高的时间分辨率,可以利用记录的EEG数据来推断神经活动的发生源。sLORETA技术可以利用得到的EEG数据通过逆运算(inverse solution)来逆推求解推断大脑皮质内神经元活动发生源。尤其在一些运动实验设计中,由于较大的运动幅度或者强烈的肌肉收缩,无法使用fMRI和PET技术时,sLORETA技术就成为一种探测脑内神经元活动发生源非常好的技术手段,已经有文章从理论上证明,sLORETA具有零误差的特点,而且sLORETA技术已经广泛地应用于探讨各种神经中枢机制的研究中。最近,该技术也应用于与运动相关的脑内神经元活动发生源分析的研究中。sLORETA技术是一种电流密度分布模型法,而且在众多电流密度推算法中,sLORETA技术已经被证明比其他方法具有更优的源位置锁定能力。
目前,有关人体肌肉疲劳状态下执行动作时大脑激活源特征的研究较少,尽管有一些学者用神经影像学技术研究人类肌肉疲劳过程中大脑皮层不同区域的激活变化。例如,fMRI和PET技术。但是由于血流动力学引起较低的时间分辨率,很难揭示在大脑不同区域的运动准备或者运动执行时精确的时间组织模式。尽管这些研究揭示了在整个疲劳运动任务过程中,大脑皮层的相关区域的激活水平具有疲劳依赖性,也就是说随着疲劳的发生发展,大脑皮层相关区域的激活水平发生了变化,但是,并没有揭示机体在发生疲劳时在某一个特殊时刻,大脑激活源有什么特点,原因可能是以上提到的这些技术本质上时间分辨率较低引起的。而头皮脑电具有较高的时间分辨率能够探测到毫秒级的脑电活动,但是,这些头皮脑电记录的空间分辨率并不高。为了解决这个问题,学者们使用逆运算方法解决这个难题,通过对脑电信号进行逆运算既可以保证头皮脑电信号的时间分辨率又可以保证较高的空间分辨率。本部分在实验一得到的MRCPs电位的基础上,使用sLORETA分析技术对执行动作的MRCPs脑激活源进行分析,以期待发现肌肉疲劳机体运动时,大脑激活源的变化特征。这对于了解人体神经肌肉控制的中枢机制具有重要的理论与实践意义。
4.1 研究对象与方法
4.1.1 研究对象
本研究以疲劳组10名受试者[年龄(23.1±1.2)岁,身高(1.76±0.14)m,体重(71.4±6.9)kg]为研究对象,受试者身体健康,口头报告全部为右利手。受试者在实验前身体没有剧烈运动,上肢肌肉没有疲劳症状。这10名受试者全部来自实验一的疲劳组受试者。
4.1.2 研究方法
(1)实验方案
本部分研究的实验方案与本节第一个实验研究中的实验方案相同,只是后期的实验数据处理以MRCPs为基础进行sLORETA分析,具体实验方案见实验一。
(2)脑电信号记录与处理
sLORETA分析建立在疲劳实验中得到的MRCPs数据基础之上,所以对脑电信号的具体处理方法见实验一,此处不再赘述。在本研究实验的后期由于有个别受试者的脑电帽上出现了坏电极,而在sLORETA分析时要求每一个电极位置记录到的信号都是无干扰的EEG信号,不能有任何伪迹干扰和基线飘移两种现象,所以为了统一,我们去掉了个别人中有伪迹的电极,最后剩下49个电极没有任何伪迹干扰(在sLORETA软件分析中要求至少19个电极才能确定脑源),将这些头皮电极作为sLORETA分析时的头皮电极文件,这些头皮电极分布依然符合10/10电极分布系统,我们只是去掉了部分受到干扰的电极,以免影响sLORETA脑源分析的结果。
为了观察MRCPs电位在执行动作瞬间的脑源特征,我们选取了MRCPs电位0~150ms时间窗内的平均电位幅值,对这段时间窗内的脑电信号进行sLORETA分析,这个时间窗口基本能覆盖所有研究对象执行动作瞬间,其中包含了MRCPs的峰值负电位。
(3)sLORETA脑源分析法
鉴于脑成像技术在时间分辨率上的限制,因此,很难探测到人体在运动过程中只有毫秒级的运动相关电位的脑源情况。sLORETA是一种功能性脑断层扫描成像技术,属于一种标准化线性反解,通过头皮EEG数据将脑内神经元活动的发生源进行三维分布模型化。已经有学者使用sLORETA技术确定头皮EEG的神经活动发生源,它是利用原始的EEG信号进行分析,按照头模型进行转化,计算出局部的标准化电流密度。sLORETA是一种取决于生物电发生器数学模型和脑容积导体基础之上,使用边界元法分析法的源锁定技术。它所需要的EEG数据需要建立在10/5电极系统基础之上,记录到的EEG信号经过数字化处理后,投射到由加拿大蒙特利尔神经科学研究所(Montreal Neurological Institute,MNI)提供的152人平均的MRI脑图谱上,简称MNI152,在一个3层球形头模型内计算sLORETA的解。这3层头模型结构包括头皮、颅骨以及颅内脑成分,其中颅内的脑成分被数字化处理成由6239个立体像素组成的三维立体结构,每个像素之间的最小分辨率为5mm。EEG数据经过sLORETA分析逆运算后,模型脑内被激活区域内的每一个立体像素会被赋予一个sLORETA值,这个sLORETA值就是标准化电流密度值,其值越大,说明激活区域的电流密度越大,能够代表脑源激活强度;sLORETA值为0时,说明该立体像素对应的位置没有被激活。同时,这sLORETA值还可以分解为XYZ3个方向的分量。由于每一个立体像素对应着一个三维XYZ坐标值,因此,可以将这个坐标值发送给Talairach Daemon系统,而Talairach Daemon系统的脑图谱中的每一个坐标位置与布罗德曼分区一一对应,最终可以获得到大脑皮质特定区域的激活情况。
尽管目前还有一些其他的方法能够确定脑源活动,例如BESA、ST-MAP,但是与这些方法相比较,sLORETA最能提供令人满意的结果。
在本研究中数据分析具体步骤如下:
①将Neuroscan 4.5软件中的头皮电极位置文件以.txt文件形式导出,注意在本研究中只选取了没有伪迹干扰的49个电极位置,它们分别覆盖了额叶、顶叶、颞叶和枕叶。
②将每一个人49个电极位置的MRCPs电位幅值从Neuroscan 4.5软件中以.asc文件形式导出,选取其中0~150ms的时间窗内的平均值作为sLORETA分析的对象。
③将含有49个电极位置标签名称的.txt文件导入到sLORETA软件中,将头皮电极位置与MRI版本的Talairach脑图谱模型进行匹配,生成三维电极坐标文件。图4-29为脑图谱的坐标原点位置,左右方向为X轴(左为负右为正)、前后方向为Y轴(前为负后为正)、上下方向为Z轴(上为正下为负),图4-30为头皮电极C1在MNI152头型模板上的位置。
④电极匹配完成后,用每一个头皮电极对应的Talairach坐标来计算sLORETA转化矩阵,生成的矩阵文件用于计算标准化电流密度。由于sLORETA软件中显示的都是MNI坐标,而不是Talairach坐标,而目前定量的神经解剖学位置都是建立在Talairach坐标系统之上,这些神经解剖学位置可以借助Talairach Daemon系统得到,因此,在sLORETA计算中,按照Brett提出的方法将MNI坐标“校正”转化为Talairach坐标,在本研究中,用X(MNI)、Y(MNI)、Z(MNI)表示在MNI152模板上的三维坐标。用X(TAL)、Y(TAL)、Z(TAL)表示在Talairach系统中的三维坐标,将两个坐标系的坐标都给予介绍是为了研究者在同类的研究中能够将其作为比较。
图4-29 在MNI152 T2头模上的原点位置——前联合点
L:左半球;R:右半球;A:前侧;P:后侧;X:X轴;Y:Y轴;Z:Z轴
图4-30 在MNI152脑模板上头皮电极C1的位置
⑤将每一个人的含有49个电极位置的MRCPs电位幅值文件调入到sLORETA软件中,同时将sLORETA转化矩阵文件调入到sLORETA软件中,从而求得大脑内的某些区域的标准化电流密度。
(4)统计学分析
在sLORETA分析中涉及脑功能性成像的统计学分析,采用常规的统计学方法不能解决图像中像素的统计学差异问题。要使用专门针对脑功能成像的统计方法。在sLORETA软件中内嵌一种统计学非参数图谱(statistical non-parametric mapping,SnPM)分析法。统计学显著性使用非参考数随机化检验来确定。为了校正多重比较带来的误差、使用非参数单一阈值检验法,在该检验方法中首先定义一个临界阈值,如果某一立体像素所得的统计量在某个显著水平下一旦超过该阈值,说明应该拒绝无效假设(也就是说在该像素位置两者之间的比较没有统计学差异),否则接受无效假设,认为在两种条件下在该像素位置没有统计学差异。在本研究我们以P=0.05为显著标准,如果有一个像素的统计量在P=0.05水平下超过了临界阈值,那么说明两者在这个像素位置上有显著性差异。在本研究中这个临界值是通过5000次随机化排列检验得到,随机化处理过程可以在sLORETA软件中完成。在本研究中鉴于MRCPs属于ERP数据,而且数据符合正态分布,所以我们选取t值作为统计量,此处的t值是两组数据的差值。
最后,经过统计学非参数图谱统计分析后得到的是一个由t值组成的脑图谱,即脑图谱中每一个立体像素对应着一个t值,而不再是sLORETA标准化电流密度值。在脑图谱中不同的t值会对应着不同的颜色尺度,具有统计学差异的立体像素会对应着相比比较深的颜色。由立体像素组成的t值呈现在脑空间分布图谱中,这就构成了统计学非参数图谱。而具有统计学差异的立体像素与布罗德曼分区相对应,这样可以跟踪到具体的神经解剖学位置。
另外,我们对受试者在不同运动模块时的布罗德曼分区内被激活的立体像素个数以及标准化电流密度强度进行了配对样本t检验,显著性标准为0.05,数据用Mean±SD表示。
4.2 结果
4.2.1 运动初期和运动后期sLORETA电流密度分布
从运动初期模块的sLORETA标准化电流密度脑三维分布可以看出,在右手手指执行次最大等长收缩运动瞬间,大脑左右两个半球的额中央区皮质被对称激活,但是,运动对侧大脑半球(左半球)激活范围和激活强度要比同侧大脑半球高(图4-31)。从图4-31能够看出,在执行动作时,除了额叶的额上回BA6强烈激活外,中央后回和前额叶的额上回与额内侧回也有一定程度的激活。但是,在运动后期模块,从sLORETA标准化电流密度脑三维分布(图4-31)可以看出相应位置的激活强度明显变大,不仅对侧大脑半球额上回皮质激活强度增强,而且同侧大脑半球额上回皮质激活强度也增强。同时,研究发现,对侧大脑半球的前额叶激活程度减弱而同侧半球的前额叶激活程度增强。
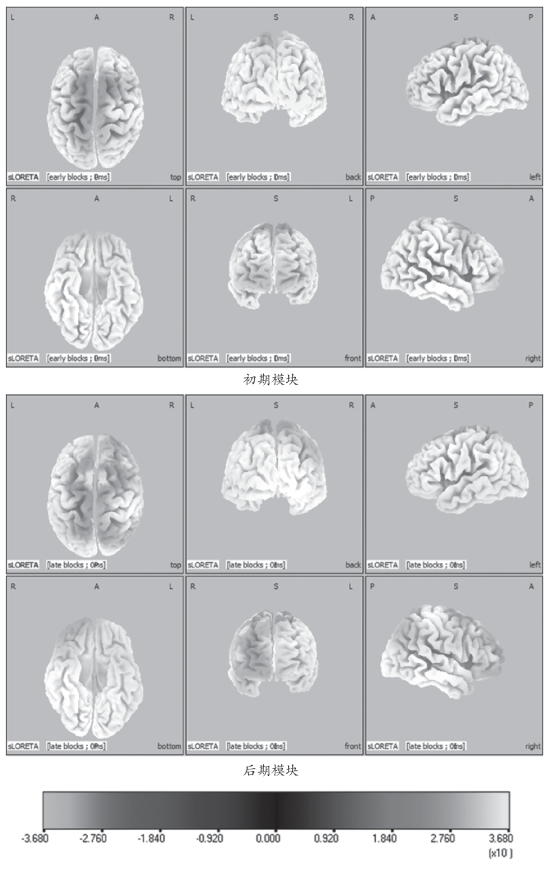
图4-31 在初期和后期模块下10名受试者平均标准化电流密度三维分布图
L:左侧半球(left hemisphere);R:右侧半球(right hemisphere);A:前侧(anterior);P:后侧(posterior);S:上方(superior)
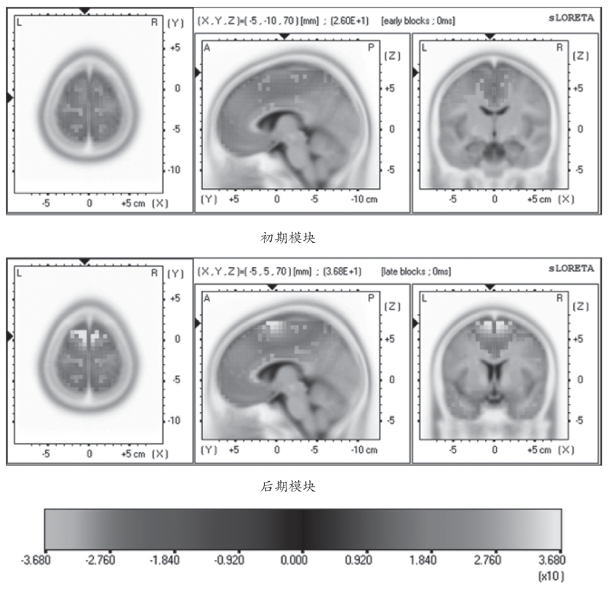
图4-32 初期和后期模块时最大sLORETA值在不同平面的脑图谱
图4-32为10名受试者执行动作时初期模块的平均最大标准化电流密度的分布情况,平均最大标准化电流密度值为26.0,在MNI152模板上的三维坐标位置为X(MNI)=-5mm、Y(MNI)=-10mm、Z(MNI)=70mm(图4-32),按照Talairach模板该位置的三维坐标为X(TAL)=-5mm、Y(TAL)=-6mm、Z(TAL)=65mm,该位置对应的布罗德曼分区位于额叶额上回的BA6。而且从该图谱的额状面(XZ平面)可以看出,在运动初期模块运动对侧大脑半球(左侧)的激活强度和范围要大于同侧大脑半球(右侧)。另外,从额状面图谱还可以看出,在运动初期在执行动作时扣带回皮质区域有一些像素被激活,而且运动对侧大脑半球激活大于运动同侧的大脑半球。而对于运动后期模块来说,平均最大标准化电流密度为36.8,其对应的位置在MNI152模板上的三维坐标为X(MNI)=-5mm、Y(MNI)=5mm、Z(MNI)=70mm,按照Talairach模板该位置的三维坐标为X(TAL)=-5mm、Y(TAL)=8mm、Z(TAL)=64mm,该位置对应的布罗德曼分区依然位于额叶额上回的BA6区,但是,脑源的激活强度明显变大了。从最大激活皮质的位置坐标来看,随着疲劳的发生,最大激活点有向前移动的趋势。同时,从运动疲劳后期的脑图谱的额状面(XZ平面)来看,与运动初期模块相比,运动同侧的大脑半球相关区域皮质激活程度明显增强,说明随着疲劳发生,脑激区域有向运动同侧大脑半球移动的趋势,而且还有向深部移动的趋势。
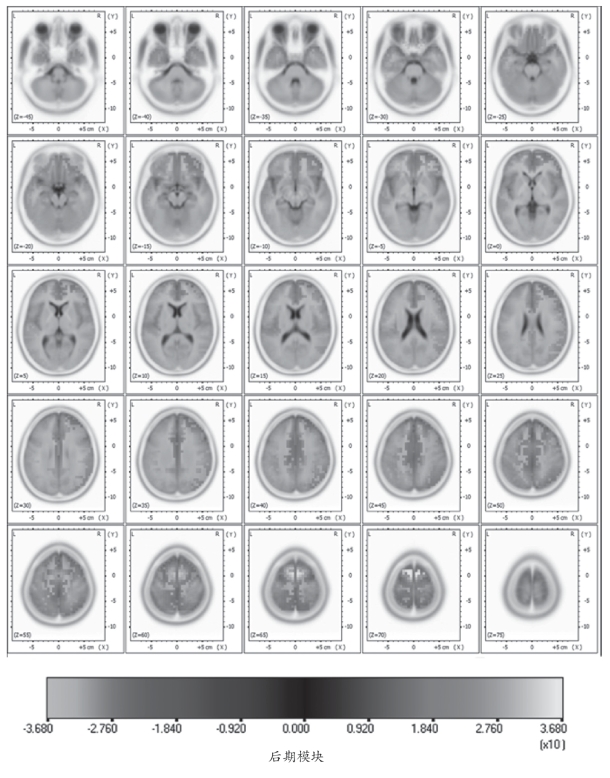
在运动初期模块中从Z轴不同位置的水平脑图谱中可以看出前额区以及扣带回区皮质的激活情况,在图4-33中,很明显可以看出双侧前额皮质区激活比较对称,Z=40mm位置的水平脑平面位置扣带回区皮质开始激活。而在运动疲劳后期模块中,前额区皮质激活主要在肢体运动的同侧半球,而相对来说,运动对侧半球的前额区皮质激活程度随疲劳的发生减弱了。而且在图4-34中,能够明显地看出Z=35mm位置的水平脑图谱中扣带回区皮质开始激活,并且激活强度也要高于运动初期。
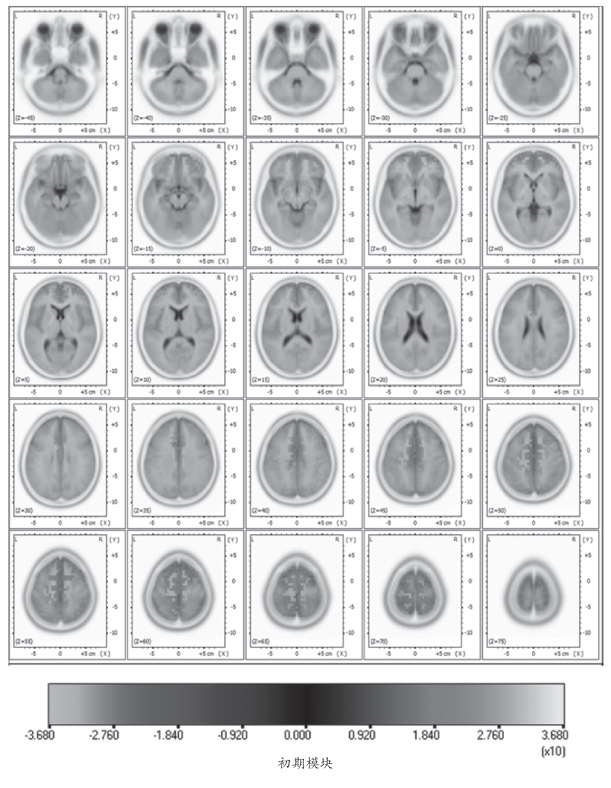
图4-33 10名受试者运动初期模块不同位置水平切面sLORETA值分布的脑图谱
4.2.2 疲劳运动任务中不同BA激活区域及标准化电流密度值变化
 (https://www.daowen.com)
(https://www.daowen.com)
图4-34 10名受试者运动后期模块不同位置水平切面sLORETA值分布的脑图谱
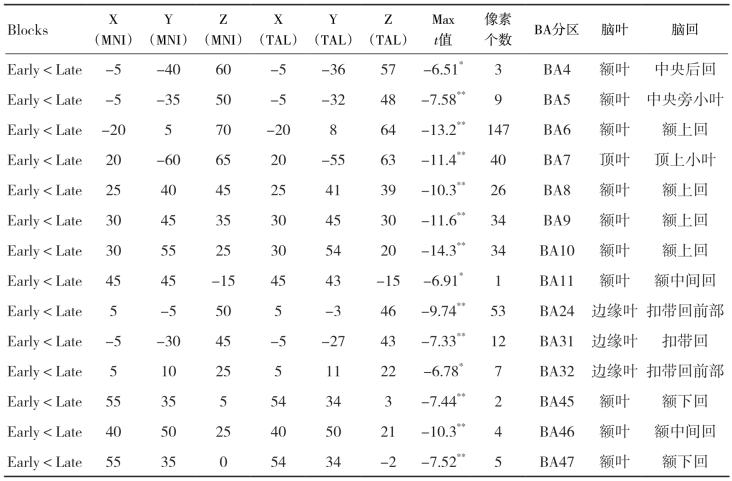
从表4-17的数据中可以看出,手指执行等长收缩时激活的大脑区域涉及BA2、BA3、BA4、BA5、BA6、BA7、BA8、BA9、BA10、BA11、BA23、BA24、BA31、BA32、BA40、BA45、BA46、BA47区内的皮质区域,该表中列出的是标准化电流密度阈值为10.0以上的立体像素的数目。从数据中我们能够看出在运动初期,手指指屈肌等长收缩时激活的立体像素位置主要集中于额叶的额上回和额内侧回的BA6区,其次位于BA24区的边缘系统的前部扣带回皮质以及位于BA10区的额上回和额中间回皮质区域。但是,随着上肢前臂肌肉收缩过程中疲劳程度加深,相关皮质区域内激活像素的数目显著增加(表4-17)。
从手指指屈肌执行等长收缩运动时不同脑区sLORETA标准化电流密度值来看,BA6区的电流密度最高,其次是扣带回前部皮质区域。位于额区、顶区以及边缘叶扣带回的大部分皮质在运动后期模块时,其sLORETA标准化电流密度要显著要高于运动初期模块(表4-18)。
表4-17 手指执行等长收缩动作时大脑sLORETA立体像素激活数目以及对应的BA分区
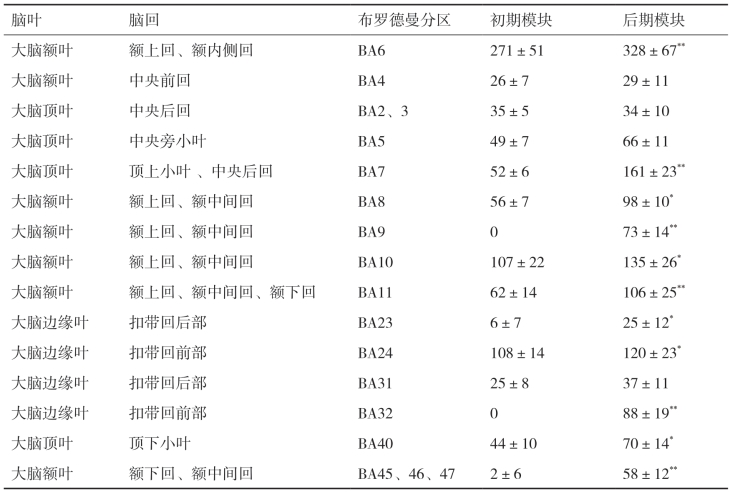
*表示与运动初期模块相比,P<0.05;**P<0.01
表4-18 手指执行等长收缩运动时不同脑区sLORETA标准化电流密度
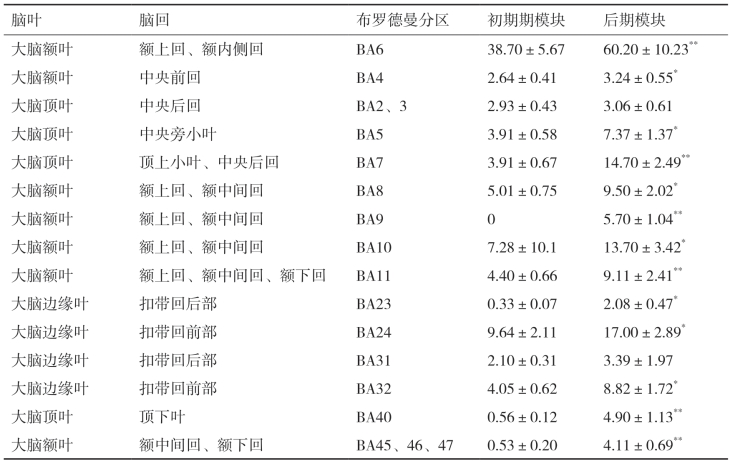
*表示与运动初期相比,P<0.05,**表示与运动初期相比,P<0.01
4.2.3 运动初期与运动后期模块的统计学非参数图谱
由表19的数据可知,在BA6区最大显著性差异发生在X(MNI)=-20mm、Y(MNI)=5mm、Z(MNI)=70mm位置,最大统计量t(9)=-13.2,极端概率P<0.01,而在0.05和0.01水平下阈值分别为t(0.05)critical=-6.51、t(0.01)critical=-7.12,对于BA6区来说,围绕其最大差异值附近共有147个像素具有显著性差异,其像素对应的P<0.05,主要位于额上回和额中间回。同时结合统计学三维脑图谱,在BA6区这些显著性差异发生在运动侧肢体的同侧大脑半球和对侧大脑半球。对于运动对侧大脑半球来说,激活强度显著增加,同时同侧大脑半球BA6区激活强度也显著增强(图4-35)。除了BA6区外,BA24区扣带回前部皮质区最大统计量t(9)=-9.74,极端概率P<0.01,最大差异位置三维坐标为X(MNI)=5mm、Y(MNI)=-5mm、Z(MNI)=50mm,在其周围共有54个像素具有统计学差异,P<0.05。另外,在前额叶和顶叶皮质区域也有大量的像素对应的标准化电流密度值存在统计学差异(表4-19),表现为随肌肉疲劳程度加深,这些像素对应的标准化电流值显著增加,其中前额区皮质表现出特异性变化,即运动对侧前额区皮质的激活程度随着肌肉疲劳程度加深并没有明显变化,甚至有些皮质区域的激活程度降低(图4-36),而运动同侧的前额区(BA8、BA9、BA10)的部分皮质激活程度显著增强(表4-19)。另外,初级运动皮质区BA4内有三个像素对应的标准化电流强度随着疲劳的加深而显著增加(表4-19)。
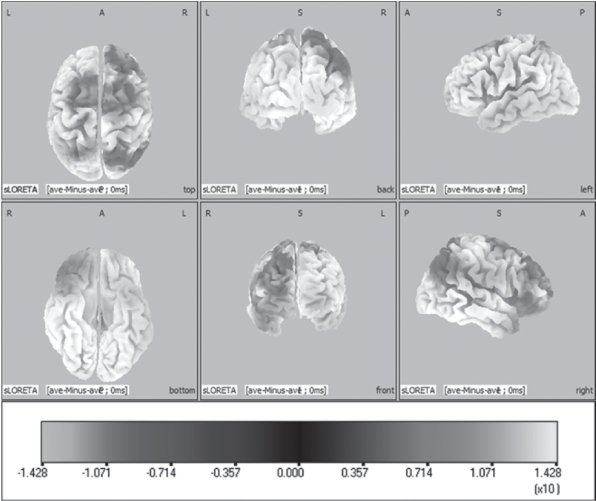
图4-35 10名受试者前后两个运动模块统计学非参数三维脑图谱统
蓝色表示初期模块小于后期模块,红黄色表示初期模块大于后期模块,以下相同
表4-19 有显著性差异的像素坐标以及神经解剖学位置
*P<0.05,**P<0.01;X(MNI)表示MNI152坐标系,X(TAL)表示Talairach坐标系
图4-36为运动前后2个模块最大标准化电流密度差异在3个平面上的脑图谱,最大差异位置发生在BA10区内,其坐标位置为X(MNI)=30mm、Y(MNI)=55mm、Z(MNI)=25mm(图4-36),按照Talairach模板该位置的三维坐标为X(TAL)=30mm、Y(TAL)=54mm、Z(TAL)=20mm。可见这个最大差异位置在大脑的前部,运动同侧大脑半球同时偏向大脑的下部。
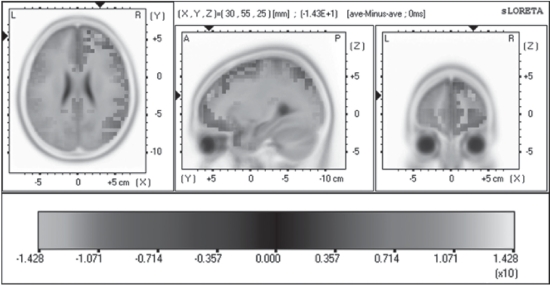
图4-36 10名受试者在前后两个运动模块最大电流密度差异位置的统计学非参数脑图谱
图4-37为受试者在前后2个运动模块在不同Z轴不同位置的水平面的统计学非参数脑图谱,在大脑半球两侧都出现了显著性差异,但主要出现在运动同侧大脑半球。

图4-37 10名受试者在前后两个运动模块不同水平面的统计学非参数脑图谱
4.3 分析
本研究结果显示,在上肢肌肉等长收缩至疲劳过程中,大脑激活模式发生了一定变化。在运动疲劳初始模块中,执行运动时激活的大脑皮质主要位于大脑的额区和顶区,同时扣带回皮质区域也有一定程度的参与。随着上肢肌肉运动疲劳的加深,相关区域内激活的大脑皮质面积显著变大,同时,这些区域内总的标准化电流密度也显著增加。进一步研究发现,在皮质激活面积以及电流强度的增加的基础之上,激活部位有向运动同侧(大脑右半球)、大脑前部以及向下扣带回位置移动的趋势。
4.3.1 屈指动作中脑源激活区域变化分析
目前有关受试者手指屈指肌群以次最大随意等长收缩至疲劳过程中脑源变化特征的研究较少。在本研究中,手指执行等长收缩动作时,激活的脑区有BA2、BA3、BA4、BA5、BA6、BA7、BA8、BA9、BA10、BA11、BA23、BA24、BA31、BA32、BA40、BA45、BA46、BA47,这些分区主要覆盖前额叶、额区辅助运动区皮质、运动初级运动皮质区、顶叶感觉皮质区以及扣带回皮质区。额叶前中央回的BA 4主要覆盖初级运动皮质区,包含“运动小人(motor homunculus)”控制肢体运动,前面与BA6相连,后面与初级躯体感觉皮质区BA1、BA2、BA3相连,这些躯体初级感觉皮质接受对侧躯体感觉输入;BA5覆盖次级躯体感觉皮质区,位于顶叶前梨状皮质区,与BA7形成体感联合皮质。BA7位于顶后皮质区,体感皮层后方,视觉皮层上方,将视觉和运动信息联合起来,具有视觉-运动协调功能。BA6位于额叶中央前回前端,与复杂的肢体运动有关,一部分与BA8共同构成前运动皮层,一部分形成辅助运动区,控制身体近端和躯干肌肉;BA8覆盖前运动皮质区,与运动规划有关。BA9、BA10、BA11共同构成前额叶皮质,执行认知功能,包括信息的记忆和回忆,运动前策划也与机体情绪有关;BA40覆盖次级体感皮质区;BA45、BA46、BA47主要覆盖前额区皮质,有研究表明前额区皮质与工作记忆有关;而BA23、BA24、BA31、BA32覆盖扣带回皮质。
Yang等发现对于随意等长屈指动作来说,大脑皮质激活的脑源区域主要涉及BA1、BA2、BA3、BA4和BA6区,在本研究中手指执行等长收缩瞬间其激活的脑区与Yang等的研究结果相近。在我们分析的脑源特征来看,手指运动激活了相关运动皮质区(BA4、BA6、BA8)。SMA具有高级运动控制功能。例如,双手协调动作、内触发运动以及视觉引导的运动,而前运动区被认为主要参与在视觉线索基础之上的动作选择。在本研究中,受试者需要在肌力曲线的视觉反馈作用下,在固定的时间间歇下,精确地控制力量水平,而且要求控制输出力持续一段时间。因此,不仅动员了BA4初级运动区皮质还动员了大量的BA6辅助运动区和BA8区的前运动区。运动皮质区对运动的控制主要体现在它们对皮层脊髓束的控制功能,皮层脊髓束是控制肢体肌肉随意运动的最根本途径,皮层脊髓束中有1/3是由初级运动皮质控制的。另外,1/3是有运动前区和辅助运动区控制,其余1/3是由感觉皮质区控制的。从脑源分析的结果来看,我们不能否认选取的0~150ms的时间窗内,除了包含大脑中枢运动执行命令外,还会包含一定的运动过程中的躯体感觉成分,在这段时间内,初级感觉皮质区(BA2和BA3)和次级感觉皮质区(BA5和BA7)都被激活了,这说明:在运动执行的这段时间内有感觉传入成分传入到体感皮层。初级感觉皮质区被认为在随意运动控制过程中主要参与握力力量控制以及提供感觉信息给初级运动皮质区。而运动皮质区主要负责支配肢体肌肉收缩是机体产生运动。
但是,在本研究中,运动执行时被激活的皮质区域要比Yang等报道的皮质区域更广泛。这可能与实验设计不同有关,本研究的实验设计要求受试者在肌力曲线视觉反馈下维持特定的输出力量水平,而且严格要求每次收缩的时间间隔以及每次收缩持续的时间,这个过程需要受试者具有一定的工作记忆能力,为了保证每一次收缩力量都能够达到标准目标力水平,并且保证每次收缩具有准确的间隔时间,这需要受试者将前一次的收缩效果记忆住,将其作为参考调整下一次收缩,如此循环进行,因此,需要动员工作记忆功能。而前额区皮质一个主要功能是工作记忆,所以,前额区广泛皮质区会参与运动任务之中。
同时,Hilty等发现,受试者在运动疲劳后BA11区的活动水平显著增强。他们使用sLORETA脑功能成像技术对受试者以60%VO2peak运动强度蹬自行车运动诱发力竭过程中脑源发生的变化进行了研究。实验结果发现,受试者力竭运动后在BA11区α波和β波功率显著增加,这似乎与本研究的结果一致。在本研究中,随着机体疲劳程度加深,BA11区激活程度显著变强,但是,与其他皮质区相比具有显著差异激活的像素数目较少,这可能与我们实验设计中涉及的疲劳程度有关。在Hilty等的研究中是大肌肉群参与的力竭运动,而我们的实验是小肌肉群参与的中等程度疲劳。而且前后2个运动模块相比在BA11区只有一个像素位置对应的电流密度具有显著性差异,其原因可能是由于前后2个模块的疲劳程度差异不是非常大。而在Hilty等的研究中,将运动疲劳后即刻与运动前安静状态相比,这种疲劳差异非常大。所以他们发现BA11区的变化非常明显。总之,从这些实验结果可以推断:出BA11区可能与机体疲劳有关。
除了以上这些皮质被激活外,本研究中发现,扣带回皮质也被显著激活。扣带回皮层是大脑边缘系统的主要组成部分,传统的研究观点认为,它作为重要的神经部位参与情绪调节。目前越来越多的神经生理学和神经心理学研究者认为,扣带回皮层参与多方面的生理心理功能,不仅参与情绪调节,还与感知觉、躯体运动、注意、记忆以及其他高级认知过程有关。扣带回皮层又可以根据细胞形态特征分成各个不同区,每一个分区与大脑其他部位构成不同的神经通路,因此,推断扣带回皮层有多种功能。扣带回是大脑边缘系统的重要组成部分,大量的临床实验资料表明,扣带回主要分成两个部分:扣带回前部和扣带回后部,它们是边缘系统功能不同的两个区域。扣带回前部参与许多躯体和内脏的运动功能以及痛觉反应,而扣带回后部与立体定位及记忆作用有关。
我们在日常生活中的行为运动属于随意运动,这些运动多是有目的的行为动作。有一项对抓握和指点两种简单动作的PET研究发现,在动作执行时大脑皮层及皮层下多个结构构成的神经网络区域活动水平增高,这些皮层部位涉及对侧运动区、前运动区、辅助运动区、扣带回皮质、上顶叶和背侧顶叶皮质,这个研究结果得到的激活区域与我们研究非常相似,他们指出扣带回参与简单的随意抓握运动,认为扣带回与运动有关。另外,还有一项PET研究发现,人类的眼动、手动以及言语运动伴随着扣带回皮质不同区域的激活。临床上对帕金森患者的研究从另一个方面说明了扣带回皮质参与随意运动,在自由选择运动方向的运动任务中,帕金森患者扣带回前部皮质激活比正常人异常。另外,在完成较复杂的运动任务时,发现帕金森患者辅助运动区和扣带回前部皮质激活程度要比正常人高,这可能是帕金森患者在完成复杂运动时由于脑内黑质-纹状体-皮层环路运动功能缺陷而动员辅助运动区和扣带回前部皮质代偿的神经机制。这些研究说明:扣带回皮质参与随意运动的调节。所以,在本研究随意屈指运动中,我们观察到扣带回皮质区域被激活。
另外,在运动结束后,我们与受试者座谈后发现,尽管我们对握力计手柄增加了软垫,但是,长时间的重复性收缩还是使受试者的大拇指指腹挤压处以及手指尖处产生了一定的痛觉。有研究表明:扣带回皮层前部参与痛觉形成。所以在本研究中,随着手指运动次数的增多以及肌肉疲劳程度加深,扣带回皮层激活程度加深,可能一部分原因是由运动过程中手指疼痛引起的。同时,我们发现,受试者在运动结束时伴随着一种或高或低的痛苦情绪,这也间接表明扣带回皮层参与情绪调节。
在本研究设计中,要求受试者在完成手指的随意收缩有一定的要求,即要求受试者每次收缩持续6s,每次收缩之间间隔4s,而且通过肌力输出曲线的视觉反馈保证每次输出力量水平都要维持在30%MVC,这就要求受试者在完成每一次的时候需要动用记忆功能,需要记忆上一次收缩情况,然后用于调整下一次收缩,从而保证每一次收缩都能够达到标准,而且在运动后期疲劳加深的情况下对注意力和记忆力的要求越来越高。目前关于工作记忆神经机制的研究比较明确,研究表明,大脑前额叶皮层在工作记忆中起关键作用。前额叶皮层背外侧部(dorsolateral prefrontal cortex,DLPFC)BA46区可能是工作记忆执行中心。另外,神经解剖学证据表明:DLPFC与扣带回前部皮质具有密切的神经联系,这说明扣带回前部皮质可能参与到工作记忆中。这也可能是引起扣带回皮层激活的一个原因。
4.3.2 疲劳运动任务过程中脑源激活区域和标准化电流密度变化分析
本研究发现,随着肌肉疲劳程度加深,大脑皮激活区域以及激活强度都显著增大,其中,激活区域的变化有向运动同侧大脑半球、大脑前部以及大脑深部移动的趋势。这种现象可能解释了大脑在维持机体长时间运动发生疲劳时的中枢策略。在次最大随意收缩运动中,随着外周肌肉输出力量水平不足,大脑可能会通过激活更大的相关皮质区域以及提高相关皮质区域的激活强度来激活脊髓运动神经元池内更多的运动神经元或增强它们神经冲动同步化能力,这从实验一中肌肉的RMS变化中已经得到证实。
而且通过三维统计学脑图谱可见,运动初期和运动后期模块的差异位置主要发生在运动同侧大脑半球,以及更多地发生在大脑前部和深部位置。其原因可能是当大脑皮层一群激活的神经元发生“疲劳”时,另外一群神经元可能已经接替这部分已经疲劳的神经的功能,以至于下传导运动神经元池的命令能够维持而不发生显著下降。这种神经元疲劳可能与神经细胞本身固有的对连续刺激的反应有关,或者对其他输入源的刺激产生的适应性有关,例如,感觉输入反馈信息。
目前据我们所掌握的资料,肌肉疲劳过程中,有关大脑皮层信号量化研究非常有限,并且只有3项研究涉及肌肉疲劳时大脑皮层神经元功能变化,但是,这些学者使用的是最大随意收缩任务来诱发机体局部肌肉疲劳,同时由于技术限制,这些研究都没能确定肌肉疲劳时脑源位置是否发生了移动。有一些研究已经报道了在肌肉进行长时间的次最大随意收缩诱发疲劳时,为了弥补肌肉疲劳,会轮流激活运动神经元,例如,Westgaard与De Luca让受试者以大约5%MVC的强度进行一个持续10min的肩关节静力性外展动作诱发肌肉疲劳的实验,结果发现,在实验即将结束时,其斜方肌中低阈值的运动单位失活,而高阈值的运动单位将其取代而被激活,但是这种现象在肌肉收缩开始的前几分钟并不明显,因为安静的运动单位在“休息”一段时间后可以被重新激活,因而在运动开始的时候并没有动员高阈值的运动单位。作者推测,运动单位通过“替代方式”可以保护运动单位免遭过度疲劳的发生。但是这仅仅是一种推测,并没有从大脑运动相关皮层区域获得相关数据支持该论断。在另一项研究中,Sogaard记录了人体肘关节以10%MVC强度进行静力性和动力性屈曲动作时单个运动单位的工作情况,结果他发现,大部分运动单位是“集中式”激活的。这种现象解释为运动单位是轮流工作的,因为在记录运动单位的电活动时发现当一个运动单位被募集并且增加它的放电率时,另一个运动单位显示为发放率降低,然后最终停止其电活动。
这种运动神经元轮换工作的特征也在外周肌肉的工作特点以及动作的运动学特征方面得到了验证。有研究发现,在跳跃运动中,当下肢踝关节肌肉疲劳时,与踝关节处的肌肉相比,机体会更多地依赖膝关节周围的肌肉来完成这个动作。另外,在重复性地举重动作中,受试者为了弥补疲劳机体会减弱膝关节和髋关节伸肌的张力,同时增加躯干附近肌群的激活程度。Côté等比较了锯切动作时疲劳和非疲劳个体动作特征的差别,结果发现,当肌肉疲劳时伴随着锯切力下降肘关节的动作幅度变小,但是,整个锯切动作轨迹的基本特征,例如,动作方向、动作范围以及动作持续时间依然保持不变。这些基本特征之所以能够保持不变,后来发现是通过增加腕关节、肩关节和躯干的运动幅度来维持,这表明,这些关节的部分肌肉接管了之前肘关节处肌肉的功能。因此,即使在肘关节处发生了肌肉疲劳,人体系统会利用自身运动装置的“冗余性”来维持末端关节的正确轨迹。这些整体运动行为的变化可能由于运动过程中高级中枢大脑皮质感觉运动区的激活源发生移动引起的。
随着肌肉疲劳程度的加深大脑相关皮质激活区域表现更多地在运动同侧大脑半球以及大脑前部和深部,这个现象与Liu等fMRI的研究结果相近,他们的fMRI数据显示,受试者右侧上肢肌肉疲劳过程大脑会发生急性适应,表现为运动同侧的感觉运动区、前额区以及扣带回皮质的激活水平升高。同侧感觉运动皮质参与肢体运动已经被报道过,并且有些学者认为该区域激活水平升高可能与补偿肌肉疲劳有关,或者与疲劳过程中对侧感觉运动区域皮层受损有关。前额区在运动控制中的作用已经在前文中有所描述,随着肌肉疲劳加深加重,机体运动对侧半球前额区激活减弱而运动同侧半球前额区皮质激活增强,可能是为了避免对侧运动对侧半球前额区皮质损伤。而大脑深部位置激活增强可能与在疲劳过程中扣带回皮质激活增强有关,扣带回皮质在随意运动控制、情绪调节、注意力以及痛觉中的作用在前文已经介绍。运动结束后,我们对受试者做了访问,发现受试者随着肌肉疲劳加深加重对这种多次重复运动有一定的厌烦情绪,同时受试者反映其大拇指指腹与握力计手柄挤压处以及手指尖在运动结束后有疼痛感,这些可能是使扣带回皮质激活增强的原因。
本研究发现,随着疲劳程度加深,无论是最大标准化电流密度值还是相关皮质区域内的标准化电流密度值的总和都增加,标准化电流密度值可以代表大脑皮层的激活水平,像素对应的标准化电流密度值越高说明该位置皮层激活水平越高。本研究结果与Liu等的研究结果不一致,在他们的实验中,受试者执行的是手指最大随意收缩,而fMRI数据表明:个体在肌肉疲劳过程中初级运动皮质区、次级运动皮质区以及与运动相关的皮质区域的激活水平并没有随着肌肉疲劳而发生显著变化。相同的脑电数据用MRCPs来分析时,随着疲劳发生,其幅值也没有发生显著变化。我们分析其原因可能是由于运动诱发疲劳的方案不同引起的,Liu等使用的是最大随意收缩诱发肌肉疲劳,而在最大随意收缩诱发疲劳过程中,受试者可能已经使大脑皮质相关区域的激活程度达到了最大限度,中枢为了维持整体激活水平,使其激活中心发生移动进而来维持运动神经元激活水平。而本研究中,使用前臂30% MVC等长收缩诱发疲劳,属于小强度运动,因此在上肢肌肉收缩运动至疲劳过程中可能并没有达到大脑的最大激活水平,所以受试者的大脑中枢有可能从激活强和移动激活源策略两个方面共同弥补机体输出力量的不足。另外,Liu等使用的是单偶极子模型来评估皮层整体疲劳状况,所以其结果也有待探讨。一般来说,运用偶极子模型之前要对偶极子的个数和方向进行预测,但是作者为了评价大脑整体激活水平,只采用了单偶机子模型。
从大脑皮质中枢激活源位置变化也可以说明为什么在运动后期时,肌力维持阶段其力量变异较大。随着肌肉疲劳的发生,大脑中枢为了能够维持目标力量水平,一方面大脑皮质相关区域的激活水平增加,另一方面为了避免中枢神经细胞过度疲劳,此时中枢可能启动了激活源转移策略,让其他部分的神经元轮换工作,而这种大脑皮质相关区域神经元激活变化过程中可能导致了对外周输出力控制不精准的现象。
4.4 结论
本部分研究使用标准化低分辨率脑磁断层扫描分析技术研究受试者手指执行次最大随意收缩诱发上肢肌肉疲劳的过程中,大脑皮质相关区域激活源的变化。在运动过程中,激活的大脑皮层区域涉及额区的额上回、额内侧回、额中间回、额下回,大脑顶叶皮质以及扣带回皮质。随着肌肉疲劳程度加深加重,位于这些皮质区域内的像素对应的标准化电流密度强度显著增加,同时,位于这些皮质区域内被激活的立体像素的数目也显著增加。另外,研究发现随着肌肉疲劳程度加深,大脑皮质激活区域有向运动同侧大脑半球(右侧)、大脑前部以及大脑深部移动的特征。在肌肉疲劳过程中机体为了维持恒定的目标力量水平,大脑皮层通过提高相关皮质区的激活强度以及扩大大脑皮质的激活面积来弥补由于疲劳引起的力量下降。
