2.2.1 材料与方法
1.材料与试剂
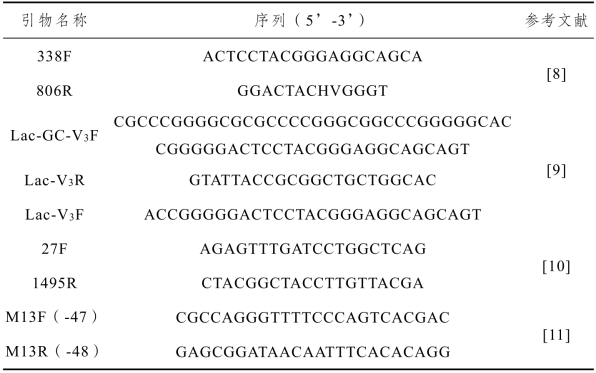
酸萝卜采集自恩施土家族苗族自治州舞阳坝菜市场。聚丙烯酰胺、N,N-亚甲基二丙烯酰胺、尿素、过硫酸铵、冰醋酸、甲醛、硝酸银和十六烷基三甲基溴化铵(Cetyltrimethyl Ammonium Bromide:CTAB)均为分析纯:购于国药集团化学试剂有限公司;MRS合成培养基:购于青岛海博生物技术有限公司;10×PCR Buffer、脱氧核糖核苷三磷酸(deoxy-ribonucleotide triphosphate:dNTP)、DNA聚合酶、蛋白酶K、溶菌酶、pMD18-T vector和SolutionI均为生物试剂:购于宝生物工程(大连)有限公司;Loading buffer、DL500和DL2000 DNA Marker:购于宝日医生物技术(北京)有限公司;2×PCR mix:购于南京诺唯赞生物科技有限公司;Axygen清洁试剂盒:购于北京科博汇智生物科技发展有限公司;QIAGEN DNeasy mericon Food Kit提取试剂盒:购于德国QIAGEN公司;引物:由武汉天一辉远生物科技有限公司合成,信息如表2-4所示。
表2-4 各引物名字及序列信息
2.仪器与设备
HBM-400B拍击式无菌均质器:天津市恒奥科技发展有限公司;ND-2000C微量紫外分光光度计:美国Nano Drop公司;VeritiTM96孔梯度PCR扩增仪:美国AB公司;DYY-12水平电泳仪:北京市六一仪器厂;DCodeTM System:美国Bio Red公司;Bio-5000 plus扫描仪:上海中晶科技有限公司;5810R台式高速冷冻离心机:德国Eppendorf公司;HR40-IIB2生物安全柜:青岛海尔特种电器有限公司;DG250厌氧工作站:英国DWS公司;ECLIPSE Ci生物显微镜:日本Nikon公司;UV PCDS8000凝胶成像分析系统:美国BIO-RAD公司。
3.方 法
(1)宏基因组DNA提取及检测
取25 g酸萝卜使用灭菌的刀和砧板将其切碎后,进一步使用拍击式无菌均质器拍击2 min,拍击液300 r/min离心10 min后,取上清液10 000 r/min离心10 min,沉淀备用。使用QIAGEN DNeasy mericon Food Kit提取试剂盒按照约束步骤提取样品宏基因组DNA,用微量紫外分光光度计检测提取DNA的OD260/OD280及浓度。
(2)细菌Miseq高通量测序分析
① 细菌PCR扩增及测序以提取的DNA为模板进行PCR扩增,扩增体系为20 μL,其中:10×PCR Buffer 5 μL,dNTP mix(2.5 mmol/L)4 μL,引物338F/806R各1 μL,rTaq酶(5 U/μL)0.4 μL,DNA模板1 μL,其余部分使用无菌水补齐[12]。体系混匀后置于PCR扩增仪进行扩增,扩增条件为95 °C预变性3 min;95 °C变性30s,55 °C退火30s,72 °C延伸45s,此流程循环30次然后72 °C完全延伸10 min,最终维持在4 °C。将检测合格的扩增产物寄至上海美吉生物医药科技有限公司,使用Miseq PE300高通量测序平台进行测序。(https://www.daowen.com)
② 序列质量控制及分析参照沈馨的方法删除拼接后不满足质控条件的序列[13],再根据核酸标签(barcod)将序列归类至各样品以便后续分析。然后参照Caporaso J G[14]和Edgar R C[15]等的方法以100%和97%相似度划分操作分类单元(Operational Taxonomic Units,OTU),最后从各OTU中挑选代表性序列利用Greengenes(Release 13.8)[16]和RDP(Ribosomal Database Project,Release 11.5)[17]数据库进行同源性比对,明确各OTU在微生物分类水平上地位。
(3)乳酸菌DGGE指纹图谱分析
① PCR扩增及检测使用无菌超纯水将各样品宏基因组DNA浓度稀释至50 ng/μL作为PCR扩增模板。PCR扩增体系为:10×PCR Buffer(含Mg2+)2.5 μL,2.5 mmol/L dNTP mix 2 μL,10 μmol/L的正向和反向引物各0.5 μL,5U/μL rTaq 0.2 μL,DNA模板0.5 μL,18.8 μL无菌超纯水,扩增引物为Lac-GC-V3F和Lac-V3R。PCR扩增程序为:94 °C预变性5 min;(94 °C变性30s;58 °C退火1 min;72 °C延伸90s),30个循环;然后72 °C完全延伸10 min,4 °C备用[18]。用1.0%的琼脂糖凝胶检测扩增效果。
② DGGE检测检测条件:加样量为10 μL,细菌和乳酸菌变性剂范围均为35%~52%,缓冲溶液为0.5×TAE;60 °C先120 V电泳76 min然后80 V维持13h。结束电泳冷却至室温并采用银染法染色[19]。
③ 条带回收及测序挑选优势条带用无菌刀切下置于1.5 mL无菌EP管中添加50 μL无菌超纯水并用枪头捣碎,4 °C静置过夜。PCR扩增体系为:2×PCR mix 12.5 μL,无GC夹子的引物各0.5 μL,DNA模板2 μL,无菌超纯水9.5 μL;扩增条件与①相同。采用试剂和对扩增产物进行清洁,连接转化大肠杆菌Top10,并将阳性克隆寄至南京金斯瑞生物科技有限公司进行测序。
(4)乳酸菌菌株的分离鉴定
① 乳酸菌分离纯化采用稀释涂布平板法将样品稀释液涂布于含1.0%碳酸钙的MRS琼脂培养基上,平板倒置于厌氧工作站中37 °C厌氧培养48h后挑选周围有透明圈的单菌落进行纯化与保藏。
② 乳酸菌DNA提取与鉴定采用CTAB法提取纯化菌株DNA[20],然后以提取的DNA为模板进行PCR扩增,PCR扩增所需引物为27F和1495R,其余条件均与(3)相同。
4.数据处理
采用多元统计学手段对高通量测序结果进行分析,门和属水平的细菌多样性分析图使用OriginPro 2017软件绘制,核心优势OTU相对含量热图由Matlab 2016b绘制而成。使用BioEdit 7.0.9和DNAMAN 6.0将乳酸菌菌株鉴定返回的序列去除正反引物后上传至BLAST(Basic Local Alignment Search Tool)中进行同源性比对,将分析的序列与比对的模式株序列置于MEGA7.0中构建系统发育树。
