中美在疫苗招采、配送及监管上的比较分析
随着全球新兴市场不断出现,进出口疫苗的数量不断增加,疫苗监管信息和经验的分享极为重要,对我国的免疫接种工作有一定的指导意义。美国是疫苗安全管理起步最早的国家,于1902年7月1日颁布了《生物制品管制法案》,这是保障疫苗安全性的重要开端。经历了一些重大疫苗安全事件后,美国立法部门不断加强对疫苗的监管,颁布了一系列法律法规来保障疫苗的安全性和有效性。
1.体系背景
1.1 免疫规划背景
美国免疫规划不实行强制接种,主要是推荐接种,美国疾病控制与预防中心(CDC)网站上详细列出推荐接种的疫苗。1993年美国综合预算调整法案创立了儿童免疫接种项目(The Vaccines for Children,VFC),于1994年开始实施。VFC在全国范围内为某些儿童建立了疫苗直接购买和运送系统,目标是确保所有儿童不会因为没有钱购买疫苗而感染疫苗可预防的疾病。美国免疫实施咨询委员会(Advisory Committee on Immunization Practices,ACIP)负责决定纳入VFC的疫苗种类。迄今为止,ACIP为所有免疫程序表中的疫苗制定了推荐意见,美国近半数儿童可以免费接种这些疫苗。2010年美国《可负担的保健法案》获得通过,要求民营健康保险应多覆盖ACIP推荐的疫苗种类,既包括成人疫苗,也包括儿童疫苗。成人疫苗由民营保险和联邦医疗保险项目覆盖。
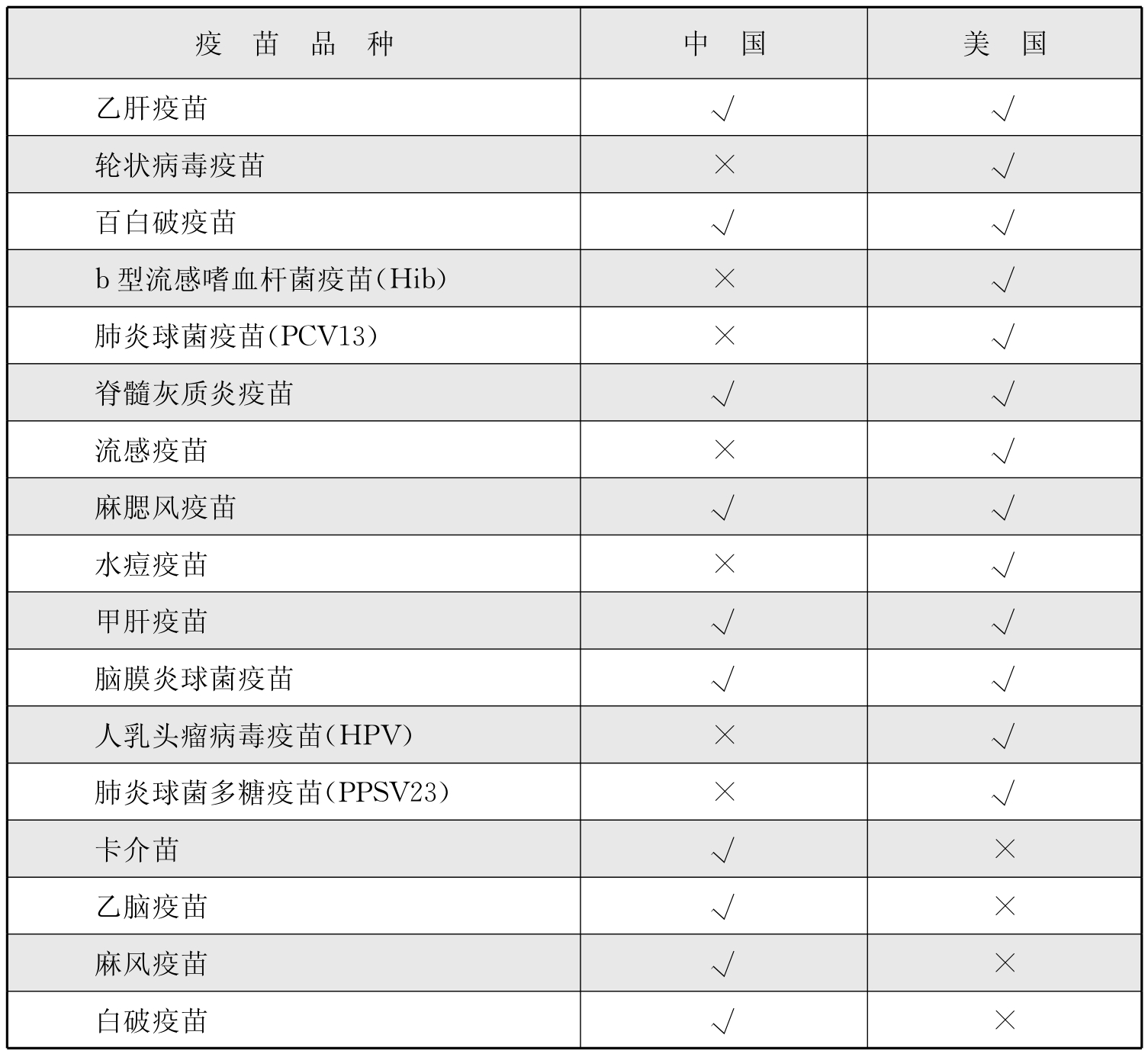
自1978年以来,中国开始实行有计划的预防接种,即计划免疫制度,并在儿童中实施了预防接种证书制度。儿童在入学前,学校需要查验他们的接种证书,以确保没有漏打的疫苗。其中,一类疫苗为政府免费向公民提供。纳入美国国家免疫规划推荐疫苗与中国一类疫苗的具体品种对比见表5-3-1(不包括成人疫苗)。
表5-3-1 美国国家免疫规划与中国一类疫苗品种对比
1.2 免疫接种相关组织
美国食品药品监督管理局(Food and Drug Administration,FDA)负责对疫苗研发者提供生产许可。FDA下属的生物制品评价和研究中心(Center for Biologics Evaluation and Research,CBER)是负责保证美国上市疫苗的安全性、纯度和有效性的国家监督机构。对疫苗相关申请的审评,由CBER的疫苗研究和审查办公室、执法和生物制品质量办公室及生物统计和流行病学办公室共同完成。疫苗的研发过程极其复杂,从生产原料的检验到上市后的批签发和检定,疫苗生命周期的每一阶段均在CBER的严格监督之下。疫苗上市后,CBER继续监督疫苗的生产和效果,以保证其持续安全有效。此外,CDC负责疾病的流行病学监测、免疫规划支持和其他事务,其下属的免疫实施咨询委员会(Advisory Committee on Immunization Practices,ACIP)对疫苗使用提供咨询建议。国家免疫计划办公室(National Vaccine Program Office,NCPO)主任通过公共卫生署(Public Health Service,PHS)和其他政府机构协调疫苗工作。美国国立卫生院(National Institutes of Health,NIH)负责进行各种类型的生物医学研究并提供资金。卫生资源和服务部(Health Resource and Services Administration,HRSA)负责管理国家疫苗伤害补偿计划和其他事务。
我国免疫接种的相关工作由国务院卫生主管部门总体负责,各行政区划内具体的接种安排由各级疾病预防控制机构分别负责。同时,各级卫生健康委员会和药品监督管理部门共同负责本行政区域内疫苗质量和流通的监督管理工作。在专家咨询制度上,我国于1982年成立了卫生部医学科学委员会计划免疫专题委员会和6个区域性的计划免疫协作委员会,至今共经过3次演变,并于2017年10月成立国家免疫规划专家咨询委员会。同年12月,国家卫生计生委授权中国疾病预防控制中心组建了国家免疫规划技术工作组。
美国免疫接种不带有政府强制性,而我国公民需按照规定接种所有一类疫苗。两国均根据地区和人群流行病学特征确定了国家免疫规划疫苗品种。在负责免疫接种的组织架构上,两国均建立了适宜的行政组织和监管机构,但我国疫苗监管起步较美国晚,相关组织架构完善程度不如美国。
2.招采模式
2.1 招采流程
美国疫苗采购分两块,VFC项目疫苗由国家CDC和疫苗制造商谈判、签订统一的联邦疫苗采购合同,以财政拨款的形式将资金提供给各州和地方的卫生机构,为州和地方卫生机构提供疫苗可预防疾病的监测和技术援助,并开展疫苗安全活动。其他儿童、成人疫苗可以由免疫提供者直接从疫苗供应商、第三方经销商和疫苗采购小组处购买疫苗。
在我国,疫苗主要采用CDC统一管理的模式。自2016年修订《疫苗流通和预防接种管理条例》后,两类疫苗均通过省级层面采购,接种单位不得向疫苗生产企业直接购买疫苗。一类疫苗首先由省级CDC根据本地区传染病预防控制需要,结合国家免疫规划,制定一类疫苗购买计划;由国家负责采购的部门统一招标,与中标的企业签订采购合同,由疫苗生产企业按照合同向省CDC供应一类疫苗。二类疫苗通过省级CDC组织各县(市、区)在省级公共资源交易中心平台上进行集中采购,具体采购方案在不同省区市之间存在差别,但总体框架一致。
2.2 疫苗生产企业
疫苗行业的市场集中度非常高,全球前五大疫苗生产商默克、赛诺菲巴斯德、葛兰素史克、辉瑞和诺华占据85%以上的全球疫苗市场份额。美国CDC网站上显示,其疫苗主要采购自这五大公司。相比之下,中国生物科学技术集团作为我国最大的疫苗生产企业,只占全球疫苗市场份额的2%,在疫苗种类、研发、技术和国际认可度等方面,与国外公司仍存在较大差距。我国疫苗生产企业虽数量庞大,但普遍规模较小,产业素质也有待提高。
美国VFC项目疫苗与我国一类疫苗类似,均由国家统一招标采购,以尽可能获得低价;对于其他儿童、成人疫苗,美国直接由免疫提供者自行订购,而我国二类疫苗目前采取省CDC组织、在省公共资源交易平台采购的方式进行采购。在疫苗的选择方面,美国的疫苗市场准入门槛远高于中国,只有经FDA批准上市的疫苗才可以进行州际运输流通,FDA至少每2年检查1次,确定疫苗生产工艺是否符合规定,达不到产品质量标准或不符合CGMPs的生产厂商将视其潜在危害程度暂停或取消其上市许可。
3.疫苗运输
3.1 配送模式
疫苗从生产到接种的全过程始终需要处于冷藏设施设备规定的温度(2~8℃)中。储存和处理不当,都有可能减弱疫苗效价,导致接种者产生不完全的免疫反应,因此对疫苗运输和储存必须加以规范。目前,疫苗运输主要分两种模式:内部供应链和外包供应链。内部供应链模式指疫苗采购和流通的整个过程由政府部门管理,疫苗从生产企业配送到省级CDC,再依次到各级CDC,最后到接种单位。外包供应链模式指政府部门委托第三方具备资质的冷链物流公司进行疫苗配送,可降低整体运输成本,提升疫苗配送时效,温度控制更严格,更易增加疫苗的存储量和配送量。
美国将疫苗配送外包给第三方冷链物流公司,直接配送到接种单位,市场更加专业化,同时也节约了流通成本,减少了疫苗在运输过程中的损耗,提高了供应的可靠性。美国FDA要求疫苗生产厂商除了要对产品本身问题承担责任外,也要承担冷链运输中的管理职责,确保产品不会在运输过程中变质,对整个产品运输过程中环境的温度控制、温度变化监测提出了很高的要求。FDA要求疫苗应确保在上班时间交货,且装运与到货时间间隔不应大于48小时,一旦运达,应立即按照推荐的温度存储疫苗。在收货时,应检查疫苗包装目录和装箱单,检查所附的冷藏室和冷冻室温度标识,确保运输温度为2~8℃,并对装运时间予以检查。
我国疫苗配送模式目前各省情况不一致。如江苏和广东等地,所有免疫规划疫苗均由市级CDC通过自身配备的冷链统一分发到各接种单位。北京、上海和天津等地区,已经出现由第三方冷链公司进行疫苗运输的方式:由省级CDC与疫苗生产商签订采购合同,疫苗生产商将疫苗冷链运输至指定的第三方冷链物流公司的冷藏库;第三方冷链公司再根据省级CDC制定的分发计划,按时将疫苗冷链配送至相应接种单位。如上海市从2017年开始,一、二类疫苗均由国药控股上海生物疫苗有限公司物流中心统一配送,配送频率为每月2次,特殊疫情时期可免费加送。
3.2 冷链设施(https://www.daowen.com)
美国疫苗冷链物流技术的发展已经相当成熟,在药品运输过程中,不仅有自动温度控制设备,还采用自动温度检测设备和报警设备,实时记录、监控冷藏箱内的变化,保证药品不会发生质变。美国疫苗冷链物流技术主要采用的是无线射频识别技术(RFID)温度标签、导航卫星测时与测距全球定位系统(GPS)技术和无线通信技术温度传感技术的结合。美国疫苗厂商在生产出疫苗后就使用RFID技术,药品出库时在冷藏箱中放置带有温度传感器的RFID标签,把货物信息包括药品温度实时地储存在RFID芯片中。同时,每台运输车安装GPS无线传输系统终端。冷藏车辆运输全程中,车厢内的RFID温度标签将车厢内温度的变化数据信息,定时或实时通过GPS网络传送到企业的冷链信息管理系统平台。一旦运输存储途中温度出现异常,企业终端的信息系统就会自动报警。货物到达后,通过手持型读写器可批量读取货物及温度信息,实现了全程的温度信息瞬间获取,降低了人工成本及出错率。
2010年中国制冷协会统计,我国冷藏保温汽车的社会拥有量为4万余辆,而美国拥有20余万辆;我国冷藏库容量约3 800万立方米,而美国在2003年就达到了8 848万立方米。由于成本高昂,RFID技术与GPS技术还未在我国疫苗冷链运输中广泛使用。但近年来,少部分实力比较雄厚的疫苗生产厂商开始引进和使用RFID全程冷链管理系统,如上海市疫苗配送企业已经可以实现实时监测温度和报警。
我国由于幅员辽阔、人口密度和交通条件等因素,目前尚无法做到疫苗统一配送。另外,由于各省市经济发展不均衡、地理环境条件差异大,疫苗有效供应尚未得到充分保证,部分地区疫苗断供的情况时有发生。再者,我国冷链物流基础设施与美国相比仍存在较大差距,疫苗冷链物流体系尚未形成,仍处于落后的状态,在基础设施、冷链质量控制标准及现代信息技术运用等方面都存在较大的欠缺。
4.监管体系
4.1 监管法律体系的建设
美国建立了严格和完善的药品审批制度,FDA在疫苗管理方面具有很高的权威,负责对疫苗研发者提供生产许可。疫苗研发机构如要开展新疫苗研究,首先需要向FDA提交申请,申请内容包括疫苗安全信息、质量控制方法、临床试验方案等多个方面。疫苗研发机构须经过FDA审核批准后,才能研制新疫苗。CBER是负责保证美国上市疫苗的安全性、纯度和有效性的国家监督机构。
1902年,美国颁布了《生物制品控制法》,以确保疫苗的安全性、纯度和效价。随着时间的推移,美国立法部门不断加强对疫苗和其他生物制品的监管。美国国会重新编纂了1902年版《生物制品管制法案》,并将其纳入1944年颁布的《美国公共卫生服务法案》。2007年版《食品药品管理修正法案》进一步保障了疫苗的安全性和有效性。此外,FDA定期发布各种关于生物制品生产和临床评价的指南和指导文件,这些由FDA发布的文件虽然没有法律效力,但可提供有用和及时的建议,一些FDA法规和指导文件对审批疫苗上市产生直接影响。
目前,我国疫苗监管相关法律尚不完善,主要依据2001年出台的《中华人民共和国药品管理法》,以《疫苗流通和预防接种管理条例》《预防接种工作规范》《疫苗储存和运输管理规范》《疫苗用生物制品生产供应管理办法》《预防接种异常反应鉴定办法》等规范作为补充。《中华人民共和国药品管理法》没有对疫苗监管做出详细规定,只是在结尾处对疫苗监管做出一个授权性的规定——国家对预防性生物制品流通实行专项管理,具体办法由国务院另行制定。因此,2019年之前我国疫苗监管法律体系的框架基础是由国务院制定的《疫苗流通和预防接种管理条例》。但是,其法律效力远远小于全国人大所制定的法律的效力,这也是导致我国疫苗的安全监管在法律上一直“无法可依”的原因。
4.2 不良事件监测系统
美国通过被动监测和主动监测相结合的开放报告系统,对疫苗上市后的安全性开展广泛、高效的监测。该系统通过“疫苗不良事件报告系统(Vaccine Adverse Events Reporting System,VAERS)”“疫苗安全性数据链(The Vaccine Safety Datalink,VSD)”和“哨点项目”,“三管齐下”实现了对疫苗不良反应进行广泛、公开的信息收集和高效、及时的反馈和应对。1955年Cutter事件促使美国建立疫苗不良反应监测体系,其中VAERS是根据1986年《国家儿童疫苗伤害法案》(National Childhood Vaccine Injury Act,NCVIA)建立的项目,并且受美国FDA和CDC共同管理。建立这个报告系统的目的在于查明最新、独特或罕见的疫苗不良事件,监控已知不良事件的增加,查明特定不良事件中蕴含的风险因素,根据已报告不良事件的数量或类别识别相应的疫苗生产批次,以及评估新疫苗的安全性。VAERS从接种美国上市疫苗后报告的不良事件(可能的不良反应)中收集和分析信息。VAERS接收从医护人员、生产厂商和公众那里传来的与美国上市疫苗有关的任何不良事件报告。VAERS系统不仅包括常规接种的儿童疫苗的不良事件报告,还包括接种任何疫苗后自愿报告的疑似不良事件报告。FDA对VAERS报告进行持续性监测,以发现不良事件报告率的任何非预期的变动和异常。NCVIA还强制建立了疫苗信息表制度,由医护人员向每位成年人或每名接种了ACIP推荐的常规儿童疫苗的儿童法定代表人分发疫苗信息表。目的是为了保证能为其提供有关疾病风险、接种疫苗的风险及获益的全面书面信息。其内容包括疾病信息、疫苗反应、降低重大不良反应风险的方法、禁忌证、疾病的高危人群及接种疫苗的获益、国家疫苗伤害补偿计划,以及联邦政府的推荐免疫程序。
在《疫苗流通和预防接种管理条例》出台前,我国疫苗安全监管一直由药品监督管理部门主要负责,各级CDC负责对基层医疗卫生机构的具体接种工作进行技术指导和实施。在该条例出台后,疫苗的监管单位由药品监督管理部门和卫生行政部门联合监管,前者负责疫苗质量和流通的监督管理工作,后者对预防接种工作进行监督。1988年北京和上海等地共14家医疗机构开展了药品不良反应报告的试点工作。2005年,我国正式建立针对预防接种不良反应(Adverse Event Following Immunization,AEFI)的监测系统,并通过全国预防接种信息管理系统进行网络直报。根据2010年发布的《全国疑似预防接种异常反应监测方案》,我国的AEFI监测实行属地化管理,对于需要调查的AEFI,区、县级CDC应在接到报告后的48小时内展开调查,且AEFI的个案调查表需在调查开始后3日内完成。
4.3 疫苗损害赔偿制度
对于出现疫苗不良反应的受害者,美国认为国家有责任对其进行一定的赔偿,并积极落实国家责任,使疫苗伤害赔偿日趋制度化。美国于1988年开始实施“全国疫苗伤害补偿计划”,其经费来源于每剂疫苗0.75美元的特别消费税。该计划是一个“无过失系统”,即不强调追究哪一方责任,只要患者由于接种疫苗受到伤害,且接种疫苗被列入该计划的“疫苗伤害表”中,受害者提出申请并提供接种证明,则可自动获得赔偿。目前,美国的疫苗伤害赔偿制度已发展到较为完善的阶段。
我国关于疫苗损害赔偿的法律法规尚不完善。《疫苗流通和预防接种管理条例》规定,由一类疫苗引起的接种异常反应且需要给予补偿的,由政府相关部门在预防接种经费中支出;由二类疫苗引起的,则由生产企业承担;同时,鼓励借助商业保险等形式进行补偿。尽管《疫苗流通和预防接种管理条例》规定了不同疫苗分类对应的补偿主体和费用来源,但是没有给出具体的补偿标准和方案。针对这一问题,不同省区市颁布了一些疫苗赔偿损害的文件来应对疫苗接种不良反应的赔偿问题。上海市2015年出台的《上海市预防接种异常反应补偿办法》中,按照“分项目计算,按级别限额”的方式进行补偿,同时根据各类不良反应的特点建立了快速补偿通道。但是,各地区自行制定的补偿标准各不相同、随意性很大,极易引发“同命不同价”的现象。据2016年一项关于我国疫苗致损救济制度的研究显示,相同条件下,北京市的赔偿金额比四川省高几十万元。因此,我国亟须在国家层面制定出台相应的疫苗损害赔偿法律法规。
相较于美国,目前我国整体疫苗安全监管的法律体系仍待完善,2019年以前主要以国务院《疫苗流通和预防接种管理条例》为基本框架,但整体法律效力较低,可以进一步参照美国,由全国人大制定相关法律。
5.对中国的启示
5.1 健全疫苗审批、生产制度
可以借鉴美国疫苗审批管理经验,明确疫苗生产监管中的具体要求。明确对生产企业检验部门的要求;提高对质量授权人的资格要求;加强对疫苗生产过程中的监管,包括生产工艺、设施、环境、生产原料、辅料等;在疫苗临床前研究中,应对疫苗研发的风险收益加以衡量,考虑疫苗本身固有的毒性、杂质或污染物的毒性、组成成分之间相互作用产生的毒性、与引发的免疫防疫相关的毒性等;在开展临床研究时,应充分关注疫苗的流行病学效果,关注多针接种的必要性和科学性,选择最佳接种程序,确定接种人群的适当范围;同时要强化疫苗批签发管理,确保企业相关资料的真实性和完整性,确保抽样检查的规范性。政府也应该鼓励企业对传统疫苗进行升级换代,促进联合疫苗的开发,培育安全、有效的民族品牌。
5.2 强化疫苗储存和运输管理
从市场需求和企业长远发展来看,第三方冷链配送是未来疫苗运输的一大趋势。然而,目前国内还没有一家可以覆盖全国的医药冷链物流企业,现有的企业规模较小,地域分散,配送能力参差不齐。因此,要规范培养社会物流企业从事疫苗储运业务的资质,推动疫苗冷链物流的市场化;向优秀的冷链物流企业颁发“第三方冷链物流许可证”,只有获得认证的企业才能从事疫苗储运业务,这样可以有效降低疫苗在冷链过程中的失效风险。同时,政府可给予获得认证的企业一定的财政补贴,帮助企业引进RFID和GPS技术,实现上、下游企业信息共享,对各种冷藏车和冷藏库进行全面、动态监控,以确保疫苗的安全性和有效性。
5.3 逐步完善我国疫苗相关法律体系
2018年12月23日由全国人大常委会审议的《中华人民共和国疫苗管理法(草案)》,为我国疫苗监管的相关规范、条例提供了法律基础和框架。《中华人民共和国疫苗管理法》的正式出台,可以大大弥补《疫苗流通和预防接种管理条例》法律效力不足的问题。不过,法律的执行需要全社会协同参与,形成长效的监管机制。一方面,卫生行政、药品监督、流通管理政府部门需要明确监管职责,强化监管能力;另一方面,民众也要积极参与,对于生产企业违规和接种后不良反应,需要积极向有关部门反映。同时,政府应进一步完善疫苗不良反应监测和补偿制度,统一赔偿标准和经费来源。可以建立风险共担机制,由企业纳税和政府共同出资成立赔偿基金,由财政部门托管,这一模式能降低企业的运行风险,也有助于保障公众的健康权益和维护社会稳定。
