道尔顿的原子
随着发现的元素越来越多(迄今已有100多种),一个问题很自然地被提出来了:这么多元素是不是由更简单的东西所组成的?这就是近代原子论所要回答的问题。攻克这个难题的是英国化学家道尔顿。
道尔顿认为,无论是氧、氮、碳、氢这些元素,还是二氧化碳、水等化合物,它们都是由无数个“原子”混合起来组成的。氧元素是由无数的“氧原子”组成的;二氧化碳化合物则是由无数的二氧化碳“复合原子”(现在称为分子)组成的,这种“复合原子”里包含两个氧原子和一个碳原子。导致道尔顿提出这种化学的原子论的,是他所发现的倍比定律。
道尔顿在分析某些化合物的组成时发现,如果A、B两种元素能化合生成几种化合物的话,那么,在这些化合物中一定重量的A元素和同它化合的B元素,它们的重量互相构成简单的整数之比。例如,氧和氮化合在不同的条件下能生成五种不同的化合物:一氧化二氮(N2O)、氧化氮(NO)、三氧化二氮(N2O3)、二氧化氮(NO2)、五氧化二氮(N2O5)。这五种化合物里氮和氧的重量之比分别是:
28∶16,14∶16,28∶48,14∶32,28∶80。
如果计算一下在每种化合物里,跟一份氮化合的氧的重量,就得到如下5个数字:
16÷28=0.57,16÷14=1.14,48÷28=1.71,32÷14=2.28,80÷28=2.85。
把这5个数排起来做比例,再用最大公约数去除它们,就得到一组整数之比:(https://www.daowen.com)
0.57∶1.14∶1.71∶2.28∶2.85=1∶2∶3∶4∶5。
这样的结果说明了什么呢?它表明氮原子和氧原子进行化合时,不会半个、一个半地化合,只能一个、两个、三个、四个、五个地进行化合,所以它们才构成简单的整数比。由此而推论,这样的氧原子和氮原子确实是这两种元素的不可再分割的最小单元了。因为如果它们还可以再分割的话,它们的化合物的重量之比就不会是整数之比了。
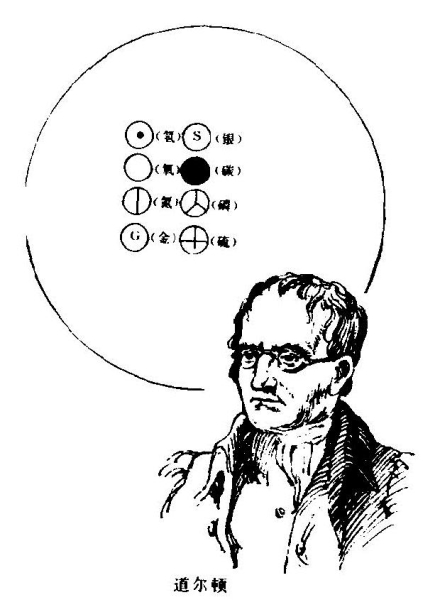
道尔顿还用图来表示自己的“原子”。他画一个圆圈代表氧原子,圆圈中加一个黑点代表氢原子,大黑点代表碳原子,如此等等。
道尔顿还进一步推论,不同元素的原子应当有不同的大小和不同的重量。20世纪的科学家把道尔顿的猜测变成了确实的知识。例如,原子有多大呢?把1亿个原子排成一条线的话,还不到手指甲那么长。原子有多重呢?最轻的氢原子只有1.673×10-24克重,小数点后面接连有23个零!尽管人们发现了100多种原子,但是,这100多种原子在地球上并不是一样多,有几种原子在自然界并不存在,只在实验室被“制造”出十几个来。有12种原子(氧、氢、氮、碳、铁等)却是无处不在,地球上99%的东西都是由这12种原子组成的。
在道尔顿的原子学说中,原子是元素的最小单元,它们是不可再分割的。原子真的是不可再分割的微小粒子吗?这个观点在19世纪末受到了严重的挑战。
