2.6.3 抗体
抗体又称免疫球蛋白(Immunoglobulin,Ig),是一种主要由浆细胞分泌,被免疫系统用来鉴别与中和外来物质如细菌、病毒等病原体的大型Y形蛋白质,仅被发现存在于脊椎动物的血液等体液中,及其B细胞的细胞膜表面。抗体能通过其可变区唯一识别特定外来物的一个独特特征,该外来目标被称为抗原。
抗体是免疫球蛋白超家族中的一种糖蛋白,它们是血浆中丙种球蛋白的主要构成成分。抗体通常由一些基础单元组成,每一个抗体包括两个长(大)的重链,以及两个短(小)的轻链。免疫球蛋白可分为IgG、JgM、JgA、JgD、JgE等类别,它们的基本结构都相似,图2-6给出了抗体的结构示意图。
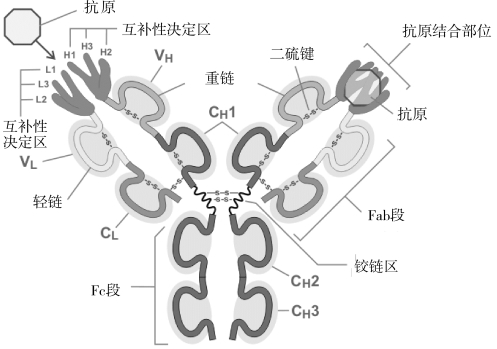
图2-6 抗体结构示意图
Ig由四条多肽链组成,各肽链之间由数量不等的链间二硫键连接。Ig可形成“Y”字形结构,称为Ig单体,是构成抗体的基本单位。天然Ig分子含有四条异源性多肽链,其中,分子量较大的两条链称为重链(Heavy Chain,H),而分子量较小的两条链称为轻链(Light Chain,L);Ig轻链和重链中靠近N端氨基酸序列变化较大的区域称为高变区(Variable Region,V),将靠近C端氨基酸序列相对稳定的区域,称为稳定区(Constant Region,C)。高变区只与抗原结合有关,稳定区与其他B细胞的受体相互作用,两个区域的不同导致抗体种群多样化,C区变化有限,V区的变化使免疫系统在自适应处理中具有能力和速度。铰链区(Hinge Region)位于CH1与CH2之间,富含脯氨酸,易伸展弯曲,从而改变抗原结合部位之间的距离,有利于抗体结合位于不同位置的抗原表位。抗体的功能与其结构密切相关,同一抗体的V区和C区的氨基酸组成和顺序的不同,决定了其功能上的差异。不同抗体的V区和C区在结构变化上具有一定的规律,又使得其在功能上存在共性。V区和C区的组成和结构,决定了抗体的生物学功能。(https://www.daowen.com)
抗体通过与特定的抗原决定簇相结合,从而有效地清除侵入机体内的微生物、寄生虫等异物,图2-7给出抗体与病毐抗原的示意。每一个抗原都有一组抗原决定簇,通过抗体的抗原结合位点和抗原的抗原决定簇之间的模式互补匹配,结合强度取决于模式匹配程度,结合强度越大,识别效果越好。
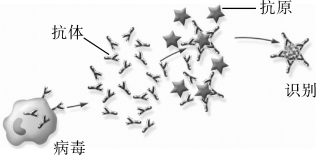
图2-7 抗体与病毒抗原的示意
人体可以产生大约100亿种不同的抗体,每一种都可以与特定抗原的表位相结合,尽管每个人可以产生的抗体是如此之多,但是面对所有的微生物,人体产生这些蛋白质的相关基因还是十分有限。免疫系统发展出了复杂的基因机制,使B细胞可以利用有限的基因产生多样性的抗体,包括结构域的可变性、体细胞的免疫球蛋白重组、体细胞超突变、免疫种型转换等,抗体的结构域中的重链和轻链中均存在的可变区,不同的B细胞所产生的抗体是不一样的,重链部分的基因座包含了65种不同的可变区基因,通过将这些基因与其他结构域的基因相组合,就可以产生高度差异的大量不同抗体。体细胞的免疫球蛋白重组过程可导致可变区发生独特的变化,免疫球蛋白中每一条重链和轻链的可变区是由若干个基因片段(亚基因)所编码的,这些片断分别被称为可变段(V)、多样段(D)以及连接段(J),各段之间具有不同的组合方式,使抗体的可变区可以产生数量巨大的不同抗原结合位,能够结合多样的抗原。体细胞超突变是指B细胞被抗原激活之后,将会迅速地增殖且发生非常高概率的点突变,这种突变方式可以增加抗体池的多样性,并且对抗体与抗原的亲和力产生影响。免疫种型转换是在活化后的B细胞中发生的一个生物学过程,该过程使得细胞可以产生不同种型的抗体,如IgA、IgE及IgG等。
