Fe—C系中渗碳体与石墨在α—Fe中的溶解度
2025年09月19日
一、Fe—C系中渗碳体与石墨在α—Fe中的溶解度
(一) 渗碳体在α—Fe中的溶解度
“渗碳体在铁中的溶解度”一般理解为:碳的溶解极限,当超过此溶解极限时,过量的碳则以碳化铁作为平衡相呈现;而 “石墨溶解度”则理解为:碳的溶解极限,当超过此溶解极限时,过量的碳则以石墨作为平衡相呈现。对于出现碳化铁的情况的平衡条件为:
![]()
则平衡常数K用式(3-13)计算:
![]()
式中 αC(α-Fe)、αFe(α)、αFe3C——分别为C、α—Fe和Fe3C的活度。
由此:
![]()
式中 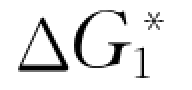 ——生成自由能;
——生成自由能;
R——气体常数;
T——绝对温度。
由于αFe3C和αFe实际上均为1,所以:
![]()
根据无限稀薄溶液,也就是说,根据亨利 (Henry)直线关系,如果在含碳量很少(最多为0.025%)的情况下,取αC= [C](质量分数,%),则:
![]()
并且根据热力学第二定律:
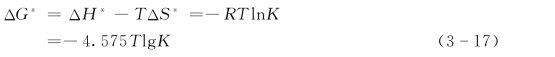
所以,
![]()
式 (3-17)、式 (3-18)中 ΔH*——热焓的变化;
ΔS*——熵的变化。
因此,

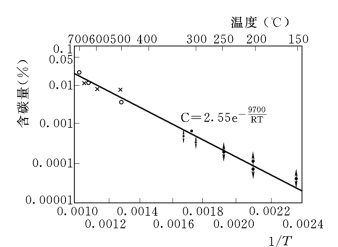
图3-4 由许多试验结果得出的渗碳体在α—Fe中溶解度随温度的变化
由此可以得知,碳在α—Fe中的溶解热为9700cal[2]。
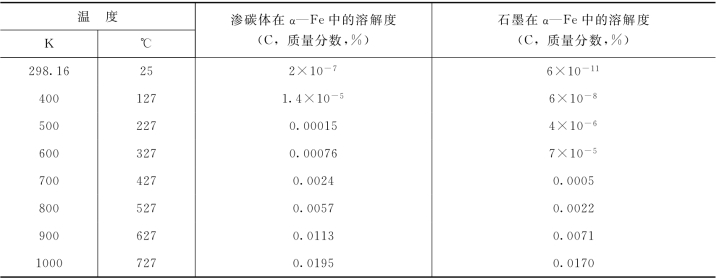
表3-2 渗碳体和石墨在α—Fe中的溶解度
(二) 石墨在α—Fe中的溶解度
石墨与α—Fe之间的平衡,可以式(3-21)、式 (3-22)表示:
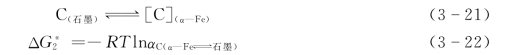
由Fe—C相图得知,碳在α—Fe中的溶解度很小。α—Fe—γ—Fe—石墨共析温度为738℃。在此温度时,碳在α—Fe中的溶解度大约为0.023%。根据L.Darken和R.Gurry关于渗碳体在α—Fe中溶解度的已知数据,可以对此进行计算。由式 (3-21)代入式(3-12),可以得出式(3-23):
![]()
与此相对应,自由能的变化为:

