2.1.1 尿素
2.1.1.1 主要性质和用途
1)物理性质
尿素(Urea),化学名称为脲或碳酸酰,分子式为CO(NH2)2,分子量为60.057,纯尿素中氮的质量分数为46.65%。
纯尿素为白色、无臭的针状或棱柱状结晶体。尿素的熔点为132.7℃,密度为1.330g/cm3,导热系数为79.91W/(m·K)。尿素易溶于水和液氨,也能溶于醇类,稍溶于乙醚和酯,其溶解度随温度的升高而增加。温度大于30℃时,尿素在液氨中的溶解度比在水中的溶解度大。20, 40,60℃时尿素在水中的溶解度(摩尔分数)分别为0.241,0.325,0.429;饱和溶液的密度分别为1.147,1.167,1.184g/cm3;饱和溶液的蒸汽压分别为1733,5333,11999Pa。尿素具有吸湿性,当空气的相对湿度大于尿素的吸湿点时,尿素吸收空气中的水分而潮解。
2)化学性质
尿素在强酸溶液中呈弱碱性,能与酸作用生成盐类。例如,尿素与硝酸作用生成能微溶于水的硝酸尿素[CO(NH2)2·HNO3],尿素与磷酸作用生成易溶于水的磷酸尿素[CO(NH2)2· H3 PO4]。尿素与盐类相互作用可生成络合物,如Ca(NO3)2·4CO(NH2)2,NH4 Cl·CO(NH2)2等。尿素与磷酸钙作用可生成磷酸尿素CO(NH2)2·H3 PO4和磷酸氢钙CaHPO4。尿素在水中会进行水解,最后成为氨和二氧化碳,但常温下水解速度很慢。
尿素在常压下加热到接近熔点时开始异构化,形成氰酸铵,接着分解成氰酸和氨。尿素在高温下可以进行缩合反应,生成缩二脲、缩三脲,甚至三聚氰酸和三聚酰胺。
熔融态尿素在高温下会缓慢放出氨而缩合成多种化合物,最主要的是缩二脲(biuret);高浓度的尿素水溶液也可以生成缩二脲。
![]()
减低压力、升高温度和延长加热时间都会加速缩二脲的生成。
尿素与直链有机化合物作用生成络合物。在盐酸作用下尿素同甲醛反应生成甲基尿素;在中性溶液中与甲醛作用生成二甲基尿素。尿素与甲醛进行缩合反应能生成脲醛树酯;与醇类作用生成尿烷;与丙烯酸作用生成二氢尿嘧啶;与丙二酸作用生成巴比妥酸等。
3)用途
尿素的最主要用途是作肥料,世界上80%~90%的尿素都用作肥料。尿素是高效优质氮肥,既可作底肥又可作根外追肥。尿素中氮的质量分数在46%以上,是硝酸铵的1.3倍、氯化铵的1.8倍、硫酸铵的2.2倍、碳酸氢铵的2.6倍。尿素在土壤中的水分和微生物作用下,转变成碳酸铵,进一步水解及硝化供作物吸收。在此过程中分解出的二氧化碳也可被农作物吸收利用。在土壤中尿素能增进磷、钾、镁、钙等元素的有效性。施用尿素后土壤中无残留物,适量使用一般不会使土壤板结。
尿素在工业上的用途也很广泛,尿素产量的10%用作工业原料,主要作为高聚物的合成材料。如作为尿素甲醛树酯和三聚氰胺—甲醛树酯的原料,用作塑料、喷漆、粘合剂;它还作为多种用途的添加剂,如油墨颜料、炸药、纺织等;尿素还用于医药(如苯巴比妥、镇静剂、止痛剂、洁齿剂等)。
2.1.1.2 尿素生产基本原理
1)尿素合成反应的化学平衡
尿素工业生产的方法是由氨和二氧化碳在液相中反应合成,两种原料均可来自合成氨厂,所以尿素装置一般与合成氨装置相配套。在工业生产条件下,氨与二氧化碳在液相中合成尿素的反应通常认为是两步完成的:
![]()
反应(1)生成氨基甲酸铵(ammonium carbamate,简称甲铵,AC),是强烈的放热反应。在常压、温度165~195℃范围内,液氨与液态二氧化碳反应生成液态甲铵的反应焓ΔH=-86.93kJ/mol。反应(2)生成尿素是吸热反应,在常压、温度298K下的ΔH=28.45kJ/mol。甲铵生成反应是快速反应,易达化学平衡且二氧化碳的平衡转化率很高。甲铵脱水生成尿素的反应速度缓慢,而且须在液相中进行,达到平衡时二氧化碳只有55%~75%转化为尿素,它是尿素合成的控制阶段。
尿素合成反应是氨、二氧化碳、尿素、甲铵、水等多组分组成的气液两相共存的复杂反应体系。除了上述两个液相反应平衡外,还存在氨、二氧化碳、水3个组分的汽液平衡关系。体系偏离理想溶液的程度很大,要严格计算化学反应平衡组成非常困难。
合成尿素的条件一般为液相氨碳(摩尔)比为2.5~4.5,水碳(摩尔)比为0.2~1.0,温度160~220℃。在此范围内有许多计算液相化学反应二氧化碳平衡转化率的半经验公式,下面介绍其中几个。
1969年苏联人Kucheryavyi(库切里亚维)提出一个计算液相化学反应CO2平衡转化率的半经验公式:
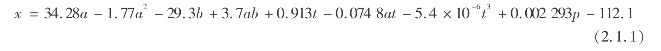
上海化工研究院也根据实验数据整理出了一系列尿素生产过程中应用的经验公式,其中计算CO2平衡转化率的公式为:
