思考题
图6.6 卧式重力分离器
1—进气管;2—椭圆形封头;3—分离帽筒;4—支持板;5—防冲板;6—支持筋;
7—防液流板;8—筒体;9—人孔;10—接板;11—百叶箱式除雾器;12—隔板;
13—手孔;14—出气管;15—出口阻液板;16—排污管
2)旋风分离器的工艺计算
(1)旋风分离器直径的计算
旋风分离器筒体直径的计算公式由水力损失方程和流量公式联立求解得到:
![]()
式中 D——旋风分离器筒体直径,m;
Q1——工作条件下的气体流量,m3/s;
ξ——阻力系数,由实验测定,一般取ξ=180;
ρG——工作条件下的气体密度,kg/m3;
ΔP——水力损失(分离器内的压力降),Pa。由实验得知,当ΔP/ρG值在55~180m范围内时,气体净化度可达95%以上;若小于55m,则净化度降低;高于180m,净化度提高不明显,但压力损失大增。因此,设计时一般取ΔP/ρG=70m,计算出分离器筒体直径,然后进行圆整。
(2)气速验算
①计算气体流速

②计算旋风分离器的压力损失
![]()
③计算旋风分离器的工作范围:根据计算出的D,取ΔP/ρG=55m,即可计算出旋风分离器的最小流速u min、最小流量Q1min和最小流速下的压力损失ΔP min;取ΔP/ρG=180m,则可得到最大流速u max、最大流量Q1max和最大流速下的压力损失ΔP max。
(3)进出气管径计算
计算方法与重力分离器相同,进口流速应为15~25m/s,出口流速应为5~15m/s。
3)天然气中常用旋风分离器的结构
天然气中常用旋风分离器的结构见图6.8。
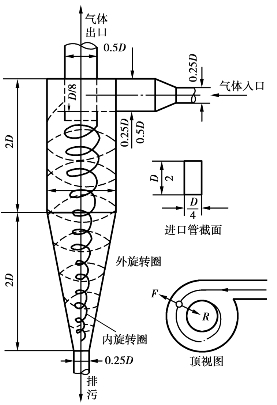
图6.7 旋风分离器的原理示意图
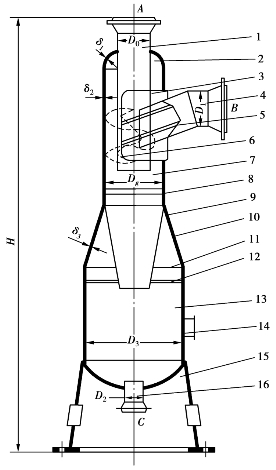
图6.8 旋风分离器的结构示意图
1—出气管;2—椭圆形封头;3—矩形加强板;
4—进气管;5—加强筋;6—螺旋叶片;
7—筒体;8—垫板;9—锥形筒;
10—锥形封头;11—垫板;12—支持板;
13—集液筒;14—手孔;15—裙座;16—排污管
6.2.1.3 其他类型的分离
除重力分离和旋风分离外,还有一些其他分离方法,其基本原理有重力沉降和离心沉降两种,但设备的变化较大,采用组合方式比较多见。比较常见的其他类型的分离器有:
(1)扩散式分离器
根据重力沉降原理,在扩散式除尘器的基础上改进而成,用于分离夹带有水及固体杂质的天然气。
(2)螺道式分离器
利用天然气压力迫使其在狭窄的螺道中做高速旋转运动,形成强烈的离心力场,使天然气中夹带的雾滴在离心力作用下相互碰撞,聚并成大的液滴沉降出来。
(3)串级离心式分离器
在同一分离器内采用内外两级旋流分离,虽结构复杂,但设备体积小,分离效率高,操作弹性好。
6.2.1.4 井场分离工艺流程
采出气的分离一般都设在单井井场或多井集气站,分离掉天然气中的液相和固相杂质后,输去净化厂进一步处理。分离出的烃可进一步回收利用,水可用于回注或制盐。
常用的分离工艺一般有常温分离流程和低温分离流程两种。在常温分离流程中,天然气自气井采出后,经针形阀节流、加热、降压后进入分离器分离烃类凝析液、水和机械杂质,然后通过计量进入集气输气干线。
对含凝析油较多的天然气,广泛采用的是低温分离流程。低温的获取一般采用节流方式,必要时也辅以人工冷源。低温分离流程中,为防止结冻发生,通常需加入甘醇作为防冻剂。
图6.9为单井集气的常温分离流程。
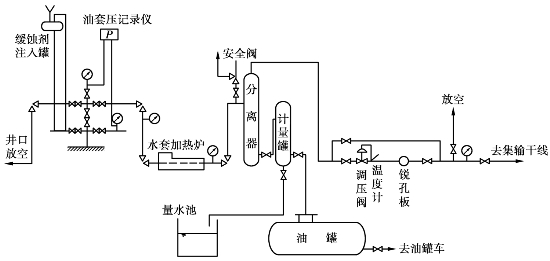
图6.9 单井集气流程示意图
对含硫较多的天然气,为减轻硫对系统的腐蚀,需向气井注入缓蚀剂。不含硫的气井不设缓蚀剂注入罐;不产凝析油的气井不设油计量罐和油罐;常温分离流程中的水加热套是为防止产生天然气水化物而设置的,通常需把天然气加热到30℃以上才能避免水化物的产生。
6.2.2 天然气的脱水
天然气经分离除去液滴和固体杂质后,其中仍含有相当数量的水蒸气。当输气管道压力和环境温度变化时,这些水蒸气可能会从天然气中析出,形成液态水、冰或天然气的固体水化物,从而引起输气阻力增加,输气能力减小,甚至堵塞阀门和管线,影响供气平稳。此外,液态水的存在还会加速酸性组分对管壁、阀件的腐蚀,缩短其使用寿命。因此,在一般情况下,天然气必须经脱水处理,达到规定含水标准后,才能进入输气干线。
天然气的含水量一般用两种指标来表示,一是绝对含水量,另一个则是露点温度。绝对含水量是指单位标准体积(273.15K,0.101325MPa下)天然气中所含水分的质量(mg/m3);露点温度则是指在一定压力条件下,天然气中的水蒸气开始凝结时的温度(℃)。
可用于天然气工业的脱水方法有很多种,选择哪种方法应根据天然气的具体情况而定。目前常用的方法有溶剂吸收法、固体吸附法、直接冷却法和化学反应法。由于直接冷却法和化学反应法的操作费用较高,因此,在一般情况下不常使用这两种方法,使用更多的还是溶剂吸收法和固体吸附法。
6.2.2.1 溶剂吸收法
溶剂吸收法是目前天然气工业中使用较普遍的脱水方法。溶剂吸收的关键是脱水吸收剂的选择,首先,必须要有高的脱水性;其次具有化学稳定性和热稳定性,容易再生,蒸汽压低,粘度小,对烃类气体溶解度小,发泡和乳化倾向小,并且无腐蚀性,同时廉价易得。
天然气的脱水深度一般用露点降表示,露点降就是指脱水装置操作温度与脱水后干气露点温度之差,用来评价脱水剂的脱水效率。
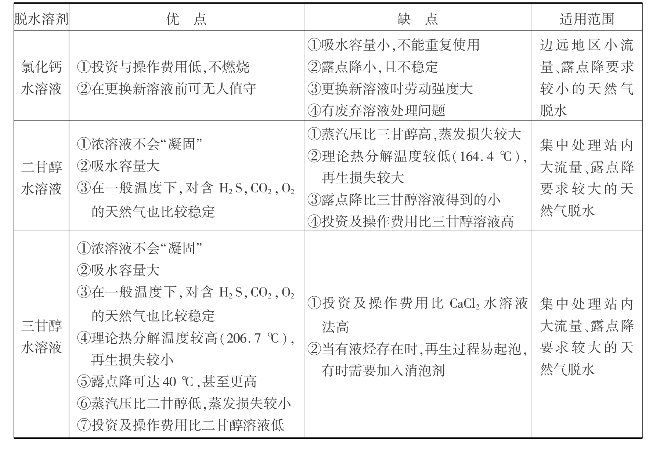
溶剂吸收法脱水目前常用的脱水剂为甘醇和金属氯化物溶液两大类,其中常用的为二甘醇、三甘醇和氯化钙,其主要性能如表6.5所示。
表6.5 不同脱水剂的比较
1)甘醇脱水工艺流程
二甘醇和三甘醇是甘醇脱水工艺中使用最多的两种脱水剂。由于三甘醇的热稳定性比二甘醇好,吸水容量及露点降也比二甘醇高,因此,三甘醇的使用较二甘醇更广泛,特别是需要较大露点降时更是这样。但是,由于三甘醇溶液粘度较大,吸收塔的操作温度则不宜低于10℃。
甘醇脱水工艺从功能上讲分为两大部分,即吸收和再生两部分。在吸收部分,脱水剂甘醇(贫液)由塔顶进入吸收塔,与塔底通入的含水天然气逆流接触;甘醇吸收水分成富液从塔底流出,脱掉水的天然气从塔顶放出,经雾沫分离成干气出系统。
吸水后的甘醇富液在再生部分进行甘醇和水的分离,常用的分离方法主要有蒸馏和汽提两种。脱水后的甘醇贫液再返回吸收使用。
甘醇脱水工艺流程根据天然气的情况不同而有一些差异,但都由吸收和再生两部分构成,其主要设备都是吸收塔和再生塔。图6.10是处理量较大的天然气三甘醇脱水流程,再生部分中的闪蒸罐是用来脱除三甘醇中溶解的烃类物质,贮罐中吹入惰性气体的目的也主要是为了带走烃类蒸汽。
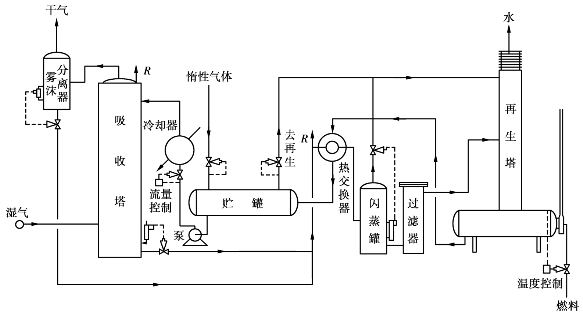
图6.10 处理量较大的天然气三甘醇脱水装置流程
2)吸收塔工艺计算
(1)进塔贫液浓度的确定
出塔天然气的干气露点与进塔贫液的甘醇浓度关系极大。因此,要指望得到指定露点的干气,就必须控制入塔甘醇的浓度。
在脱水吸收塔的操作中,当操作压力低于17MPa时,压力对出塔干气露点几乎无影响,而一般甘醇吸收塔的操作压力远低于此,故压力对出塔气露点的影响可以不予考虑。吸收塔的操作温度对出塔气露点有影响,然而,由于塔内天然气质量流量一般都远大于吸收剂甘醇的质量流量,因此塔内操作温度受入塔天然气温度控制,可以简单地用入塔天然气温度作为塔内有效吸收温度。
图6.11中的平衡水露点是指出塔干气与进塔甘醇贫液中的水含量达到平衡时的露点,只有当塔顶气和进塔贫液中的水含量达到平衡时才能实现,而实际操作中难以达到平衡。出塔干气的真实水露点都比平衡水露点高,通常情况下这个偏差值为8~11℃。因此,出塔干气的平衡水露点温度可由真实水露点温度来推算:
![]()
式中 t e——出塔干气平衡水露点温度,℃;
t r——出塔干气真实水露点温度,℃;
Δt——温度偏差值,一般取8~11℃。
于是,根据入塔天然气的温度和出塔干气的真实水露点温度,就可以从图6.11中查出进塔贫液所要求的浓度。
(2)理论塔板数和贫液循环量的确定
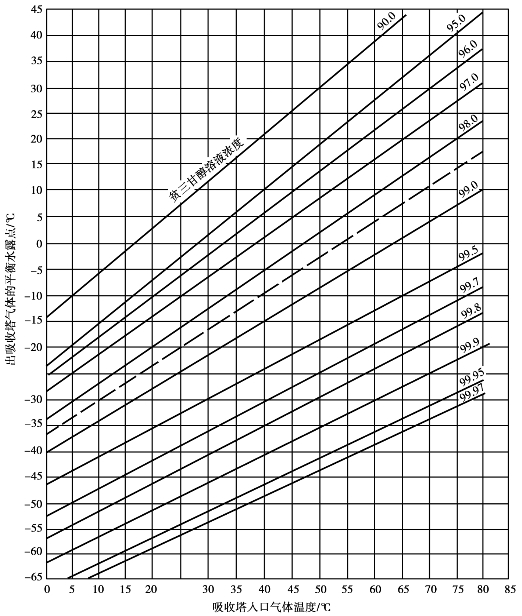
图6.11 吸收塔操作温度,进塔贫三甘醇浓度和流出的干天然气的平衡水露点的关系
注:虚线表示在204℃,0.1MPa下再生塔中产生的贫三甘醇溶液的浓度
增加吸收塔的理论塔板数和增加甘醇贫液的循环量都会提高露点降,使出塔干气的露点往平衡水露点方向靠近。实际上,一旦理论塔板数固定,甘醇贫液循环量增加到某个限度后,露点降的增加就不会再大了。实践得知,在管输天然气的含水范围内,每吸收1kg含水天然气需25~60L三甘醇贫液的循环量。低于25L,可能造成塔板液封不够,天然气穿流;高于60L,则吸收剂使用效率过低,导致再生成本增加。
用三甘醇作脱水吸收剂的吸收塔,其理论塔板数和溶液循环量的关系可用Kremser-Brown公式表示:
![]()
式中 y0——进塔天然气中水的摩尔分数;
y1——出塔天然气中水的摩尔分数;
y e——出塔天然气与进塔贫液水平衡时的气相水的摩尔分数;
A——吸收因子,A=L/KV;
L——三甘醇溶液循环量,mol/s;
V——进塔天然气流量,mol/s;
K——三甘醇溶液中的水与天然气中水的汽液平衡常数,y=Kx;
N——吸收塔的理论塔板数。
当y0,y1和y e已知时,可由图6.12查得吸收因子A的值(N=1,1.5,2时)。
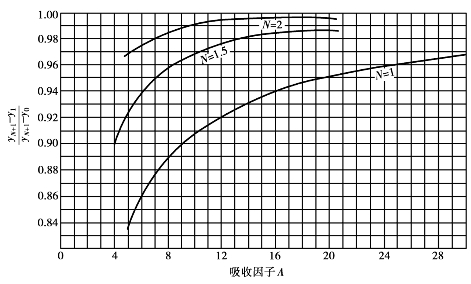
图6.12 克莱姆瑟-勃朗吸收因子图
由于塔内从气相转移到液相的水量与气量和循环量相比很小,因此,可以近似认为在稳定操作条件下,塔内的液气比是常数,即L/Qm=C。而塔内水的平衡常数K,在操作压力为1.4~17MPa,温度4~50℃时,可由下式计算:
![]()
式中 y*——纯水平衡饱和气相摩尔分数;
γ——三甘醇水溶液中水的活度系数,由图6.13查得。
所以,式(6.2.17)中的A也可由下式计算:
![]()
在工程实际中,天然气中水气常用标准体积质量浓度表示,如mg/m3。质量浓度与物质的量分数的换算可用以下关系:
![]()
式中 W——天然气中水气的标准体积质量浓度,mg/m3;
y——天然气中水气的摩尔分数。
例6.1有一三甘醇脱水吸收塔,操作压力7MPa,温度40℃。已知该塔理论板数为1,日处理天然气标准体积量为106 m3,进塔气为40℃下含有饱和水气的天然气,出塔干气要求标准体积含水量为117mg/m3,进塔贫液质量分数为98.7%,求三甘醇贫液循环量(7MPa,40℃下天然气标准体积饱和含水量为1120mg/m3,也是该条件下纯水的气相平衡量)。
解:①由贫液中三甘醇的质量分数从图6.13中查得水的活度系数γ=0.475;②计算贫液中水的摩尔分数:
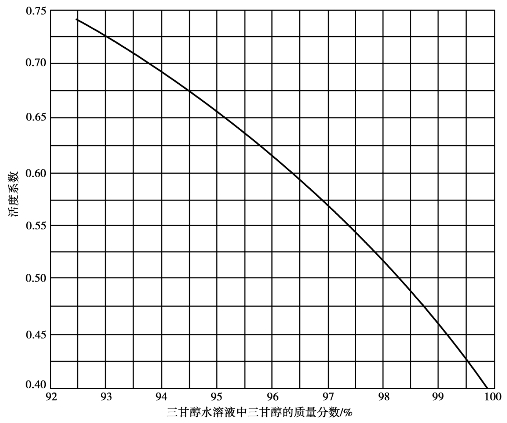
图6.13 三甘醇-水溶液中水的活度系数
![]()
③水的汽液平衡常数及出口干气中的平衡水含量为:
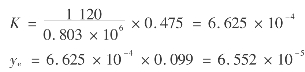
④计算
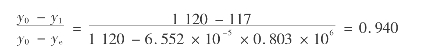
因N=1,查图6.12得A=15。
⑤计算贫液的物质的量流量。
由天然气的日处理量可得气体的物质的量流量:
![]()
由式(6.2.19)得贫液物质的量流量:
L=15×6.625×10-4×1860kmol/h=18.5kmol/h
⑥三甘醇的贫液循环量为:
WL=18.5×(0.901×150+0.099×18) kg/h=2533.3kg/h
(3)吸收塔选型和塔径计算
对直径较小的三甘醇吸收塔可选用填料塔,直径较大时,则应选用板式塔。选用板式塔时,因甘三醇溶液循环量相对于气量很小,为有利于汽液传质和增大操作弹性,多采用泡罩塔板或浮阀塔板,塔板数一般为4~10块,板效率为25%~40%。
板式吸收塔的塔径可先用Brown-Sonder公式计算空塔流量,再用空塔流量来计算塔径。
最大允许空塔质量流速:
![]()
塔径

式中 G a——塔内气体最大允许质量空速,kg/(h·m2);
C——常数,板间距61cm时,C=500,板间距76cm时,C=550;
ρl——液相密度,kg/m3;
ρg——气相密度,kg/m3;
D——吸收塔内径,m;
G——处理气量,kg/h。
3)再生系统工艺条件
(1)再生系统操作条件的确定
为了保证吸收塔出塔干气的露点达到规定值,进塔贫液浓度应严格按图6.11中的控制线控制。对三甘醇富液的再生效果与再沸器的压力和温度有关,如果采用汽提再生,则还与汽提气的用量和汽提效率有关。常压再生时,三甘醇贫液的浓度取决于再沸器的操作温度,而三甘醇热分解温度约为206℃,因此,再沸器操作温度通常控制为191~193℃,最高不得超过204℃。
采用汽提再生时,汽提气可在再(重)沸器内预热后通入贫液汽提柱,也可直接通入再沸器内。通入方式不同,效果也不一样。汽提气应是不溶于水、204℃以下稳定的气体。通常使用的气体为0.3~0.6MPa的现场干天然气或三甘醇富液的闪蒸汽。汽提气的用量不宜过大,以防止贫液汽提柱发生液泛,如图6.14所示。
(2)共沸蒸馏再生
在寒冷地带,要求干天然气露点很低,这就要求脱水吸收塔入塔贫液的甘醇含量很高,采用一般的再生方法很难取得甘醇浓度很高的贫液。因此,共沸蒸馏在再生高甘醇浓度的贫液中起了重要作用。
由于水和许多有机溶剂均可形成较低沸点的共沸物,共沸蒸馏再生方法也就利用这一原理,选择合适的共沸剂,使甘醇中的水很容易蒸馏干净。共沸剂的选择要求无毒,不溶于水和甘醇,蒸发损失小,且价廉易得。可用于三甘醇再生的共沸剂有异辛烷、苯、甲苯、二甲苯、丁酸乙酯等,工业中常用的是异辛烷。
再生过程中,共沸剂与水一起从再生塔顶蒸出,经冷凝后与水分相,再返回使用。
(3)再沸器的加热方式
甘醇再生脱水的再沸器加热方式可以是燃料气直接燃烧加热,也可以采用蒸汽加热、电加热或其他加热方式。加热时,热介质通过加热管对甘醇液进行升温加热。由于所处理的天然气本身就是燃料气,因而大多数再生系统采用的是天然气直燃式加热。
图6.14 三甘醇溶液汽提再生示意图
(4)冷换设备
从再沸器出来的甘醇贫液温度约200℃,不能直接用于吸收,必须将其降温至与进入吸收塔的天然气温度相差不大的程度。因此,贫液从再沸器出来后,经一换热器加热从吸收塔底出来的冷富液,自身温度降至60~65℃,再经一冷却器水冷至50~55℃后才送入吸收塔。
(5)闪蒸器
在吸收塔内,特别是高压操作的吸收塔,有一定量的烃类气体会溶于甘醇溶液中。甘醇溶液吸收烃气,特别是芳烃之后,发泡倾向加大,导致甘醇损失增加;此外,这些烃气在压力降低时会急速逸出,在设备中引起两相混合流体的高速湍流,加速管线和设备的腐蚀与冲蚀;同时,烃气的溢出若处理不善会导致起火或其他事故。
为解决这一问题,在富液进入再生塔之前,增加一闪蒸设备,让所吸收的烃类气体充分释放出来。一般要求富液在闪蒸器内的停留时间为5~20min,闪蒸出的气体可用作汽提气。
用三甘醇作脱水剂脱除酸性天然气中的水分时,硫化氢会溶解到甘醇溶液中,这不仅会使甘醇溶液pH值下降,加大设备管线的腐蚀,而且H2 S还会与甘醇发生反应,导致三甘醇变质。因此,在酸性天然气脱水工艺中,富液在进入再生塔前,应增加一个酸气汽提塔,先行脱除其中的H2 S。
4)氯化钙溶液脱水工艺
氯化钙是一种吸水性很强的无机盐,其高浓度的水溶液也具有很强的吸水性,因此,氯化钙溶液作为天然气脱水中第一个使用的脱水剂,在天然气净化中起过相当重要的作用。
用氯化钙溶液脱水的工艺过程十分简单,仅需一个塔即可完成(见图6.15)。脱水塔共分3部分:上部为吸附段(吸附床),内装直径10~20mm的固体氯化钙颗粒;中部为吸收段,内装3~5块塔板;下部为分离段,是空塔体。
图6.15 氯化钙脱水塔
在脱水过程中,湿天然气先进入脱水塔下部的分离段,脱除所带游离液滴后进入吸收段。在吸收段中,上升的天然气与上段下来的浓氯化钙溶液在塔板上接触,脱去部分含水。进入上部的吸附段时,天然气在固定氯化钙床层中将其余水分脱除,氯化钙颗粒在吸附一定量的水分后溶解下滴至中段,为吸收提供吸收剂。
由于上层颗粒的不断溶解,床层将逐渐变薄。在床层薄到不能满足脱水要求时,就需要重新装填,所以,在处理工艺中往往需要两座相同结构的塔轮换使用。
正因为氯化钙颗粒的装填费钱费事,因此,现在使用此法者已大为减少。
6.2.2.2 固体吸附法
1)吸附过程和常用吸附剂
流体在流经多孔固体粒子时,其中的某些组分分子被固体内孔表面所吸着的过程称为吸附过程。吸附是固体表面作用力的结果,根据表面力的性质可将吸附过程分为物理吸附和化学吸附两大类。
物理吸附主要由范德华(Van deWaals)力或色散力所引起,气体的吸附类似于其凝聚,一般无选择性,过程可逆,吸附热小。吸附作用可以是单分子层,也可以是多分子层吸附。吸附所需的活化能小,所以吸附速度快,比较容易达到平衡。
化学吸附主要由吸附剂表面剩余价力和吸附质之间的作用所致,类似于化学反应,有明显的选择性,多数过程不可逆,吸附热大。化学吸附为单分子层吸附,吸附所需活化能大,所以吸附速度慢,在低温下不易达到平衡。
由于化学吸附多数情况下是不可逆的,吸附剂再生困难,因此在天然气固体吸附法脱水工艺中多采用物理吸附方法。当然,物理吸附和化学吸附相互并不排斥,在同一体系内可能同时或相继出现两种类型的吸附。
用固体吸附法脱除天然气中的水分,得到的干气露点可低于-50℃,操作状态和过程对进料气的温度、压力和流量的变化不敏感,工艺简单,操作方便,对小流量气体脱水操作成本较低。但该方法也有它的不足,如气压降大,吸附剂易中毒和破碎,能耗高,一次性投资费用大。因此,固体吸附法一般适合于中小气流量的天然气脱水。
(1)吸附的基本过程
天然气的固体吸附脱水装置多采用固定床吸附塔。塔内吸附床一般分为3段(见图6.16):上段为饱和吸附层,气体从塔顶进入后,其中的水分在此段被大量吸附;中段为吸附传质层,在饱和段未被吸附尽的水分在此段被进一步吸附,其吸附程度呈一分布带(见图6.16(a));下段则吸附量极微,称为未吸附段,用来保证出塔气能达到规定的脱水要求。
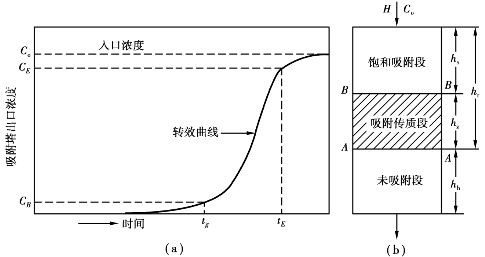
图6.16 吸附剂床和在出床层气体中被吸附物质浓度随时间的变化
在吸附操作过程中,饱和吸附段和吸附传质段的下边界会逐步下移。当吸附传质段的下边界移至床层下端时,未吸附段消失,出口气中的水分将迅速增加,此一时刻称为吸附过程的转效点(tB)。通常到此时就不能再继续使用,需对吸附床进行再生。若继续操作,饱和吸附段的下边界移至床层下端,则称床层到达饱和点(tE)。
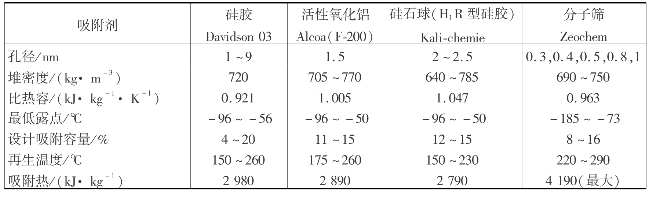
(2)常用脱水吸附剂
对天然气脱水的固体吸附剂,通常要求具有以下性能:
①吸附表面积大,一般要求500~800m2/g;
②对应脱除物具有吸附活性;
③有较高的传质速率;
④能简便经济地再生;
⑤使用寿命长,使用中活性保持良好;
⑥孔隙率高,气体阻力小;
⑦吸水前后都具有较高的机械强度;
⑧吸附和再生过程中,体积无明显变化;
⑨堆密度高,无腐蚀性,无毒性,化学惰性,价格合理。
天然气吸附脱水中常用的固体吸附剂及其主要性能如表6.6所示。
表6.6 常用吸附剂的主要物理特性
2)吸附脱水工艺流程
不同固体吸附剂对天然气脱水的工艺过程基本相同,一般采用双塔流程,一塔脱水时,另一塔再生。也有采用三塔或多塔的流程,在三塔流程中,通常是一塔操作,一塔再生,另一塔冷却。
图6.17为吸附法高压天然气脱水的典型双塔流程。
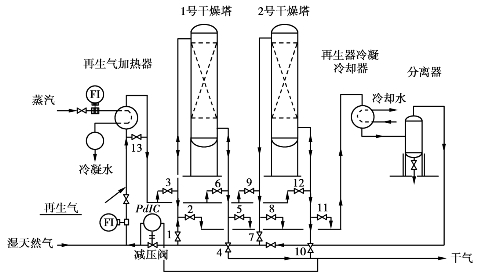
图6.17 典型高压天然气吸附脱水流程图
在操作中双塔轮换脱水和再生。一号塔的工作过程为:
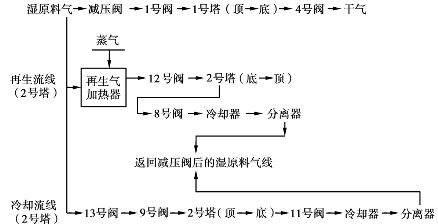
二号塔的工作过程为:
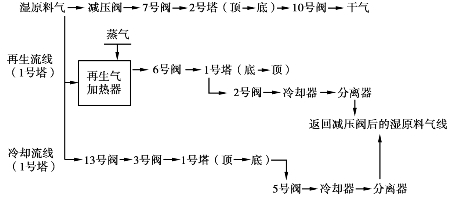
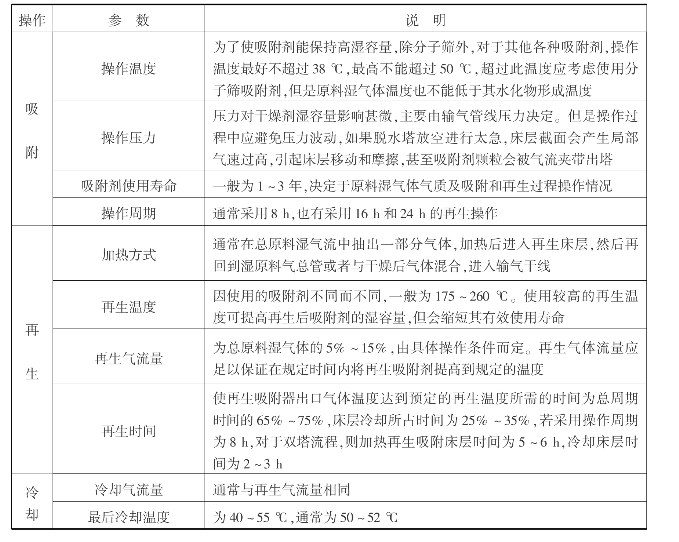
该流程的典型操作条件如表6.7所列。
表6.7 吸附法高压天然气脱水装置操作参数
3)工艺计算
(1)吸附操作周期
在装置处理气量、进口气湿含量和干气露点要求确定后,吸附操作周期主要取决于吸附剂的填装量和湿容量。
吸附操作周期的确定应考虑能满足另一个塔的再生和冷却时间。吸附操作周期的切换应在吸附塔达到转效点时进行。
(2)吸附剂的湿容量
根据图6.16可知,吸附床的湿容量由饱和吸附段和吸附传质段两部分的吸附剂的湿容量构成。吸附剂的有效湿容量可由以下经验式计算:
![]()
式中 x——吸附剂的有效湿容量,100kg吸附剂吸附水的kg数,%;
x s——吸附剂的动态平衡饱和湿容量,100kg吸附剂吸附水的kg数,%;
h T——饱和段与传质段床层高度和,m;
h z——传质段床层高度,m。
当吸附操作在转效点结束时,未吸附段高度h b=0,h T就等于床层总高度,此时,x称为吸附剂的转效点湿容量。
吸附传质段高度h z与湿原料气组成、流速、相对湿度和吸附剂装填量有关,受压力的影响较小。h z可用下式计算:
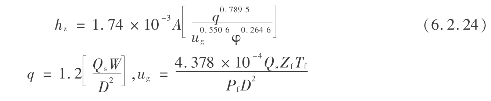
式中 q——吸附剂床层的水负荷,mg/(m2·s);
u g——空塔线速,m/s;
φ——进口气的相对湿度,%,φ=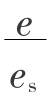 ×100%,e为实际含水理,e s为饱和含水量;
×100%,e为实际含水理,e s为饱和含水量;
A——吸附剂常数,硅胶A=1,活性氧化铝A=0.8,分子筛A=0.6;
Q——湿原料气基准体积(293.15K,1.101325MPa下)流量,m3/s;
W——湿原料气标准体积(273.15K,0.101325MPa下)含水量,mg/m3;
D——吸附床直径,m;
P f——操作压力,MPa;
T f——操作温度,K;
Z f——湿原料气在P f和T f下的压缩系数。
式(6.2.23)计算出的x是吸附剂在吸附装置中所表现出的有效湿容量。对每种吸附剂来说,在相对湿度为100%时,都有一个设计湿容量,可从有关数据表中查到。如硅胶,设计湿容量为7%~9%,活性氧化铝为4%~7%,A型分子筛为9%~12%。
吸附剂的再生一般采用高温气体反吹方式进行。再生气的反吹温度通常控制为175~260℃,用分子筛深度脱水时,反吹温度可高达260~371℃。再生操作一般在常压下进行,必要时可采用减压再生。
(3)吸附塔计算
①吸附剂装填体积:

式中 t B——吸附操作周期,h;
ρb——吸附剂的堆密度,kg/m3;其余同前,V b单位为m3。
②空塔线速度:
![]()
式中 S——气体的相对密度,以空气密度为1计;
C——常数,取值0.25~0.32;
ρg——操作状态下的气体密度,kg/m3;
d p——平均粒径,m。
其余符号同前,u g单位m/s。
③塔径计算:
![]()
各计算式中的Z f,可查有关手册得到。图6.18是低分子量天然气的压缩系数图,条件相近的天然气可用此查出近似值。
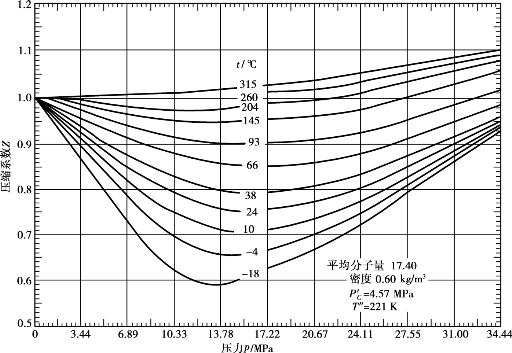
图6.18 低分子量天然气的压缩系数
4)其他吸附净化过程
(1)同时脱除水汽和含硫化合物
采用抗酸性分子筛作吸附剂,在脱水的同时可以脱除硫化氢、硫醇等含硫化合物。当天然气中含有CO2时,也会被一并脱除。
典型的工艺流程为EFCO流程,如图6.19所示。
(2)脱除水分同时回收重烃组分
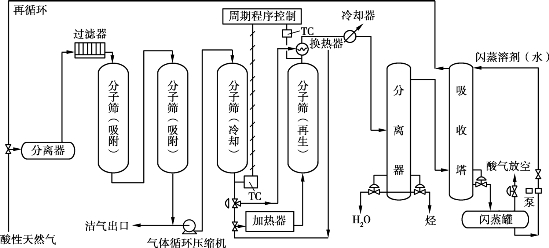
图6.19 EFCO过程流程图
大多数吸附剂在吸附水的同时,也能吸附烃类物质,烃链越长,越容易被吸附。因此,对含重烃组分较多的天然气,可在吸附脱水的同时回收重烃组分。该过程使用的吸附装置与一般脱水过程相同,但操作周期要缩短。为保证充分的再生冷却时间,通常采用三塔或三塔以上的吸附装置。再生气出来后用冷凝器将重烃类物质和水一起冷凝,在油水分离器中回收重烃。
6.2.3 天然气脱硫及硫磺回收
天然气的脱硫方法与合成氨原料气的脱硫方法一样,可采用3种方式:化学吸收法、物理吸收法和直接氧化法。脱硫工艺与合成氨中所介绍的大致相同,因此,此处不再重复,这里着重介绍硫磺的回收和回收尾气的处理。
6.2.3.1 硫磺的回收
自脱硫装置出来的含硫气体,通常称为酸性气体,是回收高纯度硫磺的极好原料,回收的硫磺纯度可达99.95%(干基)以上。酸性气体回收硫磺普遍采用的方法是克劳斯(Claus)法,即氧化催化法。尽管工艺流程几经改进,但基本工艺原理仍是氧化催化。
1)硫磺回收的化学原理
脱硫出来的酸性气体中,主要成分是H2 S气体,其他组分含量相对较少。因此,回收过程中,在燃烧炉和转化器中所发生的反应主要是:

由于单质硫存在多种聚集形态,特别是硫蒸汽中,聚集形态更多。硫的聚集形态受温度影响较大,如硫蒸汽在常温沸点下主要是S6,S7和S8,温度升高时S2随之增加,当温度达到900℃时,基本上是S2形态,到1700℃时则开始离解成单原子硫。
酸气中的其他成分虽少,但在过程中也会发生反应。如燃烧炉中:
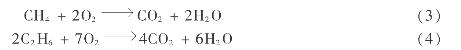
此外,还可能存在一些副反应,如:
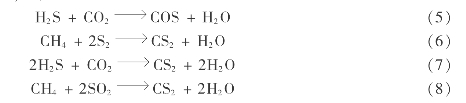
因 此,硫磺回收装置中的实际反应十分复杂,不过从H2 S为主要成分的酸性气体制硫,其核心反应 乃是反应(1)和(2),以及相应的单质硫形态转化反应:

反应(1)取决于燃烧炉的空气供给量,反应(2),(9),(10)和(11)则受操作压力和温度的控制处于不同的平衡状态。
若假定燃烧炉内氧气全部耗尽(工艺上可以做到),根据H2 S在纯理论需氧量下发生反应的化学平衡计算,可得到H2 S转化生成硫蒸汽的理论平衡值与温度和压力的关系(见图6.20)。
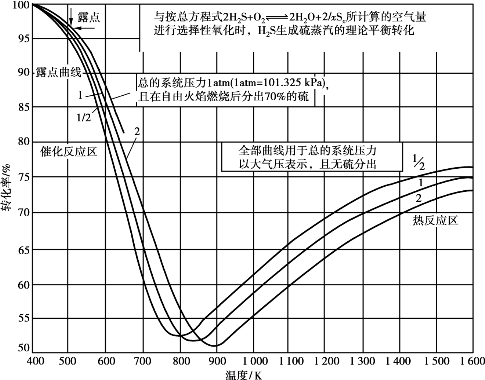
图6.20 纯H2 S制硫的理论平衡转化率
从图中可以看出,H2 S的转化过程可分为两部分,900K以上的热反应区和800K以下的催化反应区。在热反应区内,温度升高转化率增大,而压力增高转化率则降低。在催化反应区内,情况则正好相反。在800~900K温度区内,转化率处于最低状态,因此,在转化器内应避免该温度区操作。
2)硫磺回收催化剂
硫磺回收催化剂的活性组分是活性氧化铝,它依靠分布在表面上的大量活性中心吸附H2 S和SO2,使之反应生成单质硫。
活性氧化铝由氧化铝水合物热脱水生成。氧化铝的水合物按含水量分为三水水合物和一水水合物。三水水合物,又称氢氧化铝,分子式可写为Al2 O3·3H2 O或Al(OH)3,其主要结构类型有α-三水铝石、β1-三水铝石和β2-三水铝石。一水水合物,分子式可写为Al2 O3·H2 O或AlOOH,主要结构类型有一水硬铝石,一水软铝石和假一水软铝石。在600℃以下对这些水合铝石脱水,就可得到活性氧化铝,若脱水温度高于600℃,则会逐渐生成高温氧化铝,失去活性。
目前硫磺回收中使用较多的是铝土矿型催化剂,它的主要成分是氧化铝水合物,以及少量的Fe2 O3,SiO2,TiO2等。氧化铝水合物中既有三水水合物,也有一水水合物,三水水合物含量高者,其催化活性较好。用铝土矿作催化剂时,将其制成块状或条状,以降低床层阻力。铝土矿催化剂的热脱水活化温度为400~500℃。
直接用活性氧化铝作催化剂,可以获得更高的硫磺回收率。但由于活性氧化铝的制作费用高,所以价格较贵,将导致回收硫磺的成本增加。
硫磺回收催化剂在使用中,若温度控制不当,会引起结构转型,降低活性。此外,在使用过程中,由于吸附作用,表面会粘上单质硫、析炭、焦油等,还可能生成硫酸铝。因此,催化剂在使用一定时期后,应进行活化再生,恢复活性。若活性恢复不能达到要求,就需更换新的催化剂。
3)回收工艺流程
工业上使用的氧化催化法硫磺回收工艺有两种普遍使用的流程:单流法和分流法。对含H2 S较少的酸性气体,则采用阿莫科(Amoco)工艺流程。
(1)单流法工艺流程
当酸性气体中的H2 S高于25%时,通常应选择单流法工艺来回收硫磺。单流法工艺流程如图6.21所示,硫收率可达95%。
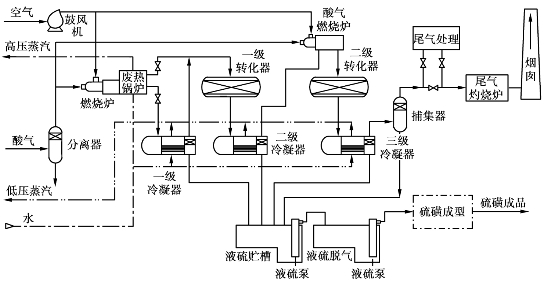
图6.21 单流法工艺流程图
在单流法中,所有酸性气体全部进入燃烧炉,按要求严格配给空气,使酸性气体中的全部烃类完全燃烧,H2 S只反应1/3,以便生成的SO2与剩下的2/3H2 S反应生成单质硫。燃烧炉内温度一般为1100~1600℃,此时60%~70%的H2 S转化成单质硫。由于温度高,炉内副反应复杂,会有少量COS和CS2生成。
从燃烧炉出来的含硫蒸汽的高温气体,经废热锅炉回收热能之后,经冷凝分硫进入一级转化器。转化反应是放热反应,一级转化后的气体经二级冷凝分硫后再送入二级转化器中。二级转化器中通常装活性较高的催化剂,以期获得较高的转化率。由于是放热反应,降低转化温度有利于硫的生成,但转化器温度不能太低,以防止蒸汽硫凝析出来造成催化剂堵塞。
为提高收率,三级冷凝器出口气温应尽可能低,同时再用一捕集器分离气相中的夹带液硫。回收硫后的尾气通常要处理后才能排放。
(2)分流法工艺流程
当酸性气体中的H2 S的体积分数不足25%时,采用单流法工艺燃烧时难以稳定,所以一般应选择分流法工艺流程(见图6.22)。分流法的硫收率比单流法低,一般仅达92%左右。
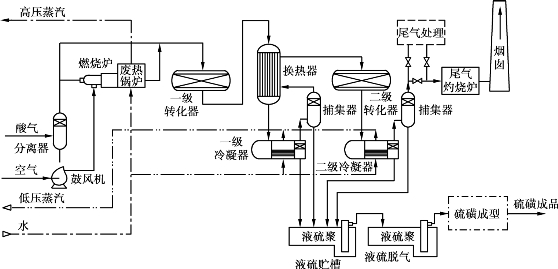
图6.22 分流法工艺流程图
在分流法中,只让1/3的酸性气体进入燃烧炉,严格按要求配给空气量,使全部烃类完全燃烧,其中的H2 S全反应生成SO2,剩余氧为零。
从燃烧炉出来的含SO2的高温气体在废热锅炉回收热量后,与另外2/3的酸气汇合,进入一级转化器,之后与单流法相同。
由于有2/3的酸性气体不经过燃烧炉,因此,分流法要求气体中不得含有重烃类化合物和其他有机物,以免引起催化剂的结炭和结焦,影响成品硫的质量。
(3)阿莫科法工艺流程
如果酸性气体中H2 S体积分数太低,低于15%,则无法用分流法进行回收,只能选择阿莫科法回收工艺(见图6.23)。
在阿莫科法中,酸性气体和空气先与一种热载体道热姆(Dowtherm)的蒸汽换热,升温后才进入一个特殊设计的燃烧炉燃烧。燃烧炉内通入部分燃料气,以维持稳定的酸气火焰。气体从道热姆锅炉出来后,后续的操作与单流法和分流法相同。
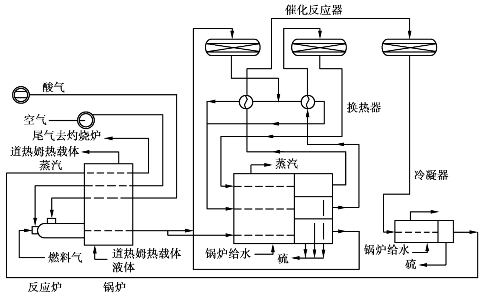
图6.23 阿莫科硫磺回收工艺流程图
由于酸性气体中H2 S体积分数较低,因此,阿莫科法的硫回收率一般都不高,约90%。
4)硫磺回收率的影响因素
克劳斯法回收硫磺的影响因素很多,其主要有以下几个:
(1)转化器级数和操作温度
由于转化反应是一个可逆反应,反应平衡关系受转化器级数和操作温度的影响很大。从理论上讲,由于每级转化后都要冷凝分硫,降低产物含量,因此,级数越多,收率越高。但实际上,当残留H2 S和SO2很少时,增加转化级数并不能提高收率多少。工业上多采用二级或三级转化。
转化反应是放热反应,根据热力学原理,降低转化温度有利于硫的生成,但温度接近硫蒸汽的饱和露点时,操作将是危险的,稍有不慎,则会导致硫蒸汽凝结到催化剂表面,使催化活性降低。
(2)配风比
配风比,就是进入燃烧炉的空气与酸性气体的体积比。当酸性气体中的可燃组分确定时,可按化学反应式的理论需氧量计算其配风比。若酸性气体中除H2 S外的可燃组分体积分数低时,可假定为完全燃烧计算配风量。若体积分数较高时,则应考虑不完全燃烧的可能性,配风量的计算要做适当的调整。
配风量的不足或过剩都将对硫的收率产生严重影响。以单流法为例,若配风量不足,不能生成足够的SO2,使H2 S过剩造成损失;若配风量过大,则会导致过多的SO2生成,形成H2 S不足而造成过剩的SO2损失。由于酸性气体供给中的H2 S不能保持恒定,因此,为保证操作过程中的n(H2 S)/n(SO2)=2,必须根据酸气中H2 S的体积分数来随时调节空气配给量。
(3)有机硫损失
酸性气体中本身就含有一些不能燃烧的有机硫组分,如COS和CS2,在燃烧炉中,副反应也要产生一定的COS和CS2。这两种组分都十分稳定,最后随尾气排出系统,造成硫的损失。
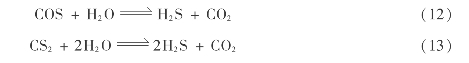
由于COS和CS2在371℃时,可在克劳斯反应催化剂作用下发生水解:因此,转化反应时,可将一级转化器的操作温度控制在371℃左右,以促使COS和CS2的水解,提高有机硫的回收率。
但是,由于操作温度的提高,一级转化器的转化率将下降,因而需增加一级转化器来弥补。
(4)转化气的冷凝和液硫雾滴的捕集
末级转化气冷凝器的出口气温和硫雾捕集器的捕集能力是决定硫蒸汽损失和夹带硫损失的关键。
末级冷凝器出口气温应尽可能低,一般控制在127℃左右。液硫雾滴的捕集器安装在末级冷凝器之后,一般采用立式,内装不锈钢丝网或拉西环,气速控制为1.5~4.1m/s,捕集率可达97.5%。
6.2.3.2 硫磺回收尾气的处理
用克劳斯法回收硫磺时,其硫的回收率为93%~97%,尾气中仍有3%~7%的含硫化合物。这部分含硫化合物主要是H2 S,SO2,COS和CS2,以及未冷下来的硫蒸汽。如果将此尾气直接排放,将对环境造成严重污染,因此,必须对它进行处理后才能排放。
尾气处理方法很多,应用也很广,在天然气工业中用于硫磺回收尾气处理方法常见的有6种,即斯科特(SCOT)法、比文(Beavon)法、魏尔曼-洛德(Wellman-Load)法、萨弗林(Sulfreen)法、冷床吸附(CBA)法和克劳斯波尔(Clauspol)法。下面简要介绍其中两种常用的方法。
1)斯科特法
斯科特法是目前使用较多的尾气处理方法,技术比较成熟,总硫回收率高(可达99.8%以上),适于处理CO2体积分数低于40%的克劳斯装置尾气。
斯科特法的基本工艺原理就是用CoO-MoO3-Al2 O3催化剂将尾气中的SO2、单质硫和有机硫还原成H2 S,用二异丙醇胺溶液将H2 S吸收后与尾气分离,吸收液经再生后返回使用,再生气则送返硫回收装置使用,其工艺流程如图6.24所示。
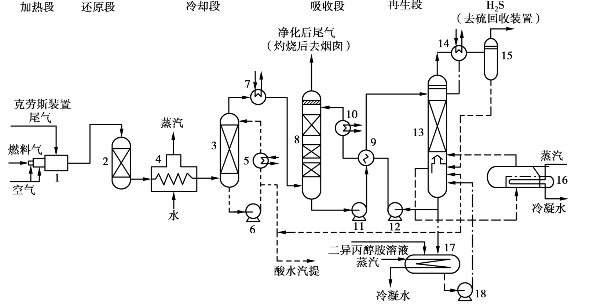
图6.24 斯科特法工艺流程图
1—在线燃烧炉;2—加氢反应器;3—喷淋冷却塔;4—废热锅炉;5—换热器;6—泵;
7—冷却器;8—吸收塔; 9—换热器;10—冷却器;11—泵;12—泵;13—再生塔;
14—冷凝冷却器;15—液滴捕集器;16—重沸器;17—溶剂罐;18—泵
2)克劳斯波尔法(IFP法)
克劳斯波尔法是一种在低温、液相和催化剂作用下,使克劳斯尾气中的H2 S和SO2反应生成单质硫的方法,实质上是克劳斯法回收硫的外部延续过程。
该方法以聚乙二醇为溶剂,羧酸盐为催化剂,在吸收反应塔内完成反应过程,生成的硫靠其自身重力沉降至塔底实现分离回收,溶剂和催化剂循环使用。该法可将总硫回收率提高到98.5%~99.3%,尾气中的有机硫不能回收,其工艺流程如图6.25所示。
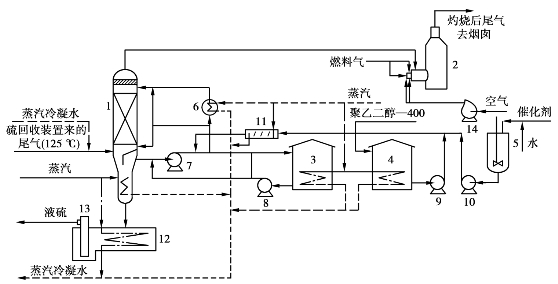
图6.25 克劳斯波尔法工艺流程图
1—吸收反应塔;2—尾气灼烧炉(热催化);3—聚乙二醇中间储罐;4—聚乙二醇储罐;
5—催化剂配制罐;6—换热器;7—溶剂循环泵;8—供料泵;9—聚乙二醇补充泵;
10—催化剂水溶液计量泵;11—混合器;12—液硫槽;13—液硫泵
为了提高硫磺回收效率和尾气处理效率,近年来在克劳斯法的基础上相继出现了将硫磺回收和尾气处理合为一体的工艺,即克劳斯组合工艺和克劳斯变体工艺。
克劳斯组合工艺就是将克劳斯段与尾气处理段组合成一体化装置的工艺,如冷床吸附法(CBA)、MCRC法和超级克劳斯法等。
克劳斯变体工艺仍然以克劳斯反应为基础,但在工艺上与传统克劳斯工艺相比有显著的不同,比较典型的有富氧克劳斯法、直接氧化法和等温催化法等。
6.3 天然气转化合成甲醇
在第一章合成氨工艺中,利用天然气生产合成氨时,首先得将天然气转化成合成气,然后再进行后续工序的生产加工。天然气转化为合成气后,除可生产合成氨外,还可生产其他化工原料产品,其中最重要的就是甲醇。
6.3.1 甲醇性质及制备原理
6.3.1.1 甲醇的性质及用途
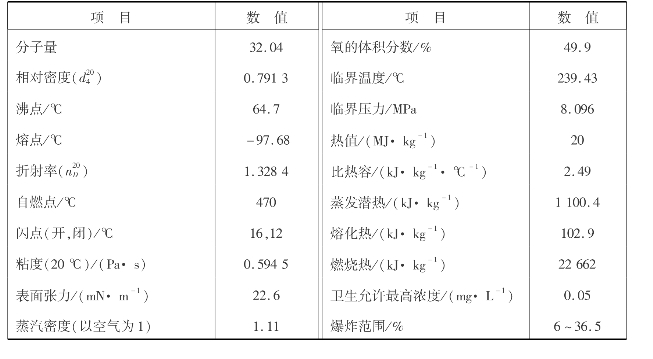
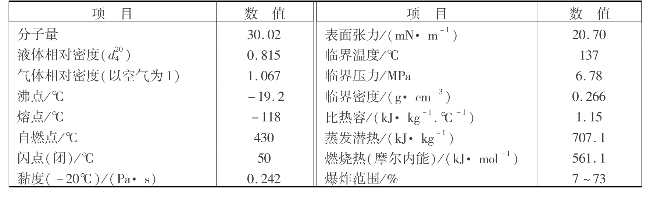
甲醇是饱和一元醇,分子式为CH3 OH,纯甲醇是无色、透明、有毒、易挥发的液体,可与水无限量混合,在嗅觉和味觉上几乎与乙醇一样。甲醇对人体有剧毒,饮用后会导致双目失明。甲醇的物理性质见表6.8所示。
甲醇是一种用途很广的化工原料,主要用于生产甲醛、醋酸、甲苯胺、氯甲烷及各种酸的酯类和维尼纶等,并在很多工业部门中广泛用作溶剂。甲醇在气田开发中用作防冻剂,添在汽油中可提高汽油的辛烷值,甲醇还可直接用作燃料用于发动机。
表6.8 甲醇的物理性质
6.3.1.2 合成甲醇的制备原理
天然气转化合成气中的CO或CO2与H2在一定温度、压力和催化剂作用下反应生成甲醇。其主反应为:
主要副反应有:
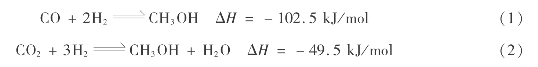
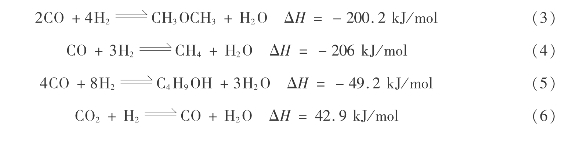
甲醇的合成反应是减分子放热反应,由化学热力学原理可知,增加压力、降低温度、减少反应气流中的惰性气体浓度均有利于甲醇的生成。反应物中n(H2)/n(CO)值对甲醇平衡质量分数也有影响,例如,在20MPa,380℃下合成甲醇,n(H2)/n(CO)=2时,甲醇平衡质量分数为14.8%;n(H2)/n(CO)=4时,甲醇平衡质量分数降至13.3%。
6.3.2 合成甲醇生产工艺
用天然气生产甲醇,在将天然气用水蒸气催化转化成合成气后,根据所用催化剂的不同,可分为高压、中压和低压合成3种方法。
6.3.2.1 高压法合成甲醇
高压法合成甲醇于1923年由德国巴登苯胺烧碱厂(BASF)的米塔希(Mittasch)和施耐德(Schneider)发明。目前广泛使用的UKW法为德国联合莱茵褐煤燃料公司开发的流程,见图6.26所示。
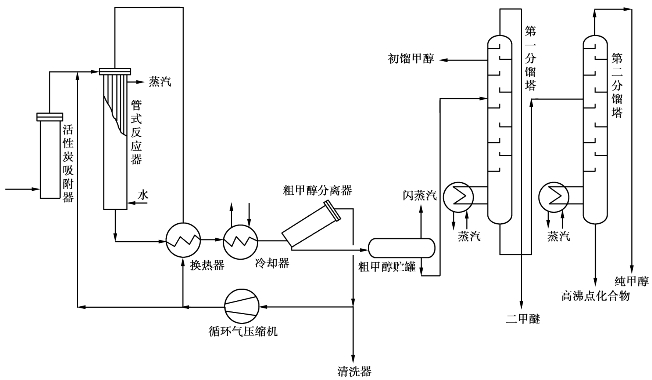
图6.26 高压合成甲醇生产流程图
操作压力约30MPa,温度320~370℃,催化剂为氧化锌/氧化铬复合催化剂。
经压缩后的合成气在活性炭吸附器中脱除五羰基碳后,同循环气一起送入管式反应器中, 在350℃和30MPa压力下,一氧化碳和氢通过催化剂层,发生反应生成粗甲醇。含粗甲醇的气体从反应器出来后,经换热、冷却后迅速送入粗甲醇分离器中,使粗甲醇从气相中冷凝出来,未反应的一氧化碳和氢气循环返回反应器。
冷凝出的粗甲醇送入精馏装置,在第一分馏塔中分出二甲醚和甲酸甲酯及其他低沸点不纯物,在第二分馏塔中除去水和杂醇,得到精甲醇。甲醇质量分数:99.85%~99.95%。
高压法合成甲醇的主原料为天然气,标准状态下发热值为41826kJ/m3。
其定额消耗(以生产每吨甲醇计)为:
天然气 900m3 电 63kW·h
锅炉给水 0.72t 冷却水 57t
高压法的特点是催化剂耐硫,抗热性较好,对含硫合成气比较适应,一般性过热对催化剂不致造成严重失活。但该催化剂的选择性较差,导致副产物较多,因而影响收率。此外,高温高压操作对设备材质要求严,使设备投资费用较高,对技术经济效果有负面影响。
6.3.2.2 低压法合成甲醇
低压法合成甲醇于1960年初由德国鲁奇(Lurgi)公司首先开发成功,其合成压力为4~5MPa,温度200~300℃,采用铜基催化剂(CuO-ZnO-Al2 O3)。其工艺流程如图6.27所示。
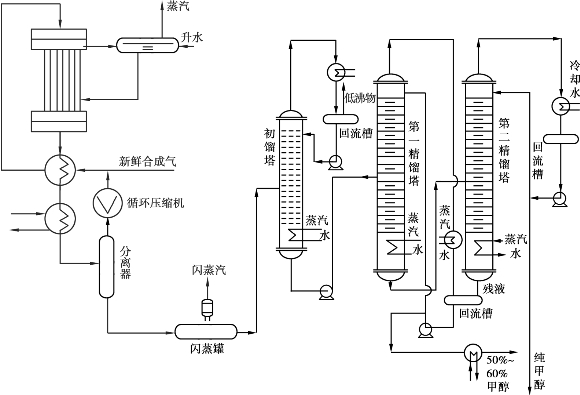
图6.27 低压法合成甲醇生产流程图
合成气经压缩机压缩至4~5MPa后,送入合成塔,经铜基催化剂催化合成甲醇。合成反应的反应热用热回收装置产生高压蒸汽用作透平压缩机动力。合成塔出来的含甲醇的产物气体经换热器与混合气换热后,用空气或冷却水换热冷却,使甲醇冷凝并在分离器中分离得到粗甲醇。
粗甲醇经闪蒸罐闪蒸后送去精馏装置精制。精制中,先用初馏塔除去二甲醚、甲酸甲酯等低沸点杂质,塔底物进第一精馏塔。在第一精馏塔中,50%的甲醇由塔顶出来,其热量作为第二精馏塔再沸器加热的热源,塔底物进第二精馏塔。第二精馏塔塔顶馏出物经冷凝得精甲醇,部分回流后,其余为精甲醇产品,质量分数为99.9%。
该工艺除纯甲醇产品外,第一精馏塔顶部馏出的50%甲醇经换热和部分回流后,可冷凝得到50%~60%的甲醇溶液。
低压合成法所用的铜基催化剂比高压合成法所用的锌铬催化剂活性高,选择性好,所得粗甲醇中甲醇质量分数高,因而使收率提高,生产成本下降。但由于反应压力低,使生产设备体积庞大,不利于大规模生产,故仅适用于中小规模的生产。此外,催化剂耐硫性不如高压合成法,因此,生产合成气的天然气中,硫的质量分数必须降至0.1×10-6以下。
低压合成法的定额消耗如下:
原料天然气 910~925m3 燃料天然气 85~90m3
电50~55kW·h 锅炉给水 0.8~0.9t
冷却水 45~55t
现在使用较多低压合成法还有英国帝国化学工业公司开发的ICI法,其合成压力为5~10MPa。
6.3.2.3 中压法合成甲醇
20世纪70年代初,英国帝国化学工业公司(ICI)提出了中压法合成甲醇的工艺,与此同时,丹麦的荷尔德-托普索(Holder-Topsoe)公司和日本瓦斯化学公司也提出了各自的中压法合成工艺,并都建立了相应的工厂。
中压法合成甲醇主要是在低压法的基础上改进而成,所用催化剂为三元铜系催化剂,适当将压力提高到8~15MPa,温度230~280℃。该工艺兼有高压法和低压法的优点,是近年来采用较多的工艺。中压法工艺流程如图6.28所示。
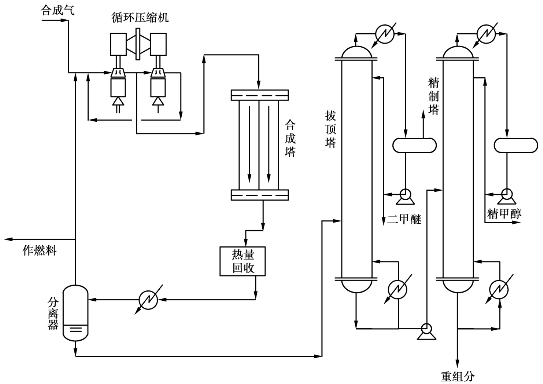
图6.28 中压合成甲醇生产流程图
中压法流程中,合成气压缩至8MPa,与循环气一起送入合成塔,入塔温度220℃左右。合成塔为冷激型,回收的合成反应热产生中压蒸汽可供转化使用。合成塔出塔气经换热器预热合成气后,冷却,在冷凝器中将粗甲醇冷凝分离出来,不凝气大部分循环使用,少部分弛放作为转化炉燃料。
粗甲醇在拔顶塔和精制塔中,经蒸馏除去二甲醚、甲酸甲酯及杂醇油等杂质后,即得精甲醇产品,纯度99.9%。
中压法合成甲醇的定额消耗如下:
天然气(原料) 750~800m3 天然气(燃料) 100~150m3
电10~20kW·h 锅炉给水 1.2~2.5t
冷却水 200~250t
甲醇合成中天然气的转化温度为850~900℃,压力为1~1.7MPa,所产生的合成气中CO2的体积分数为8%~9%,CO的体积分数为20%~21%,H2的体积分数为69%,CH4的体积分数为1.5%~2%,还含有少量的N2。由于合成甲醇不需要氮,故不像合成氨的转化那样通入大量空气。
在实际生产中,为降低n(H2)/n(CO)比值,提高甲醇平衡质量分数,有时向合成气中补充部分CO2,以提高含碳值。
6.4 天然气制乙炔
6.4.1 乙炔的性质、用途及生产方法
6.4.1.1 乙炔的性质及用途
乙炔的分子式为C2 H2,分子量26.04,是无色略带酯味的气体,其物理性质如表6.9所示。
表6.9 乙炔的主要物理性质
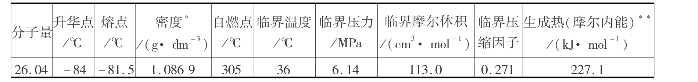
* 101.3kPa,20℃ ** 0℃
乙炔的化学性质活泼,能与铜、银、汞等生成极易爆炸的乙炔化合物,因此,应尽量避免其与这些金属接触,以免发生危险。
乙炔是重要的有机化工原料,是塑料、合成橡胶、合成纤维、医药、农药、染料、树酯和溶剂等有机产品的基础原料,可用于产生高温火焰,还可用于制造乙炔炭黑。
6.4.1. 乙炔的生产方法
1836年化学家戴维(Davy)用碳化钾与水作用制得乙炔,其后,大量的乙炔生产用电石(碳化钙)与水作用制取。1860年别尔捷诺(Bierdino)首次用电裂解烃类制得乙炔,但直到1940年德国休尔斯(Hüls)工厂才首次将其用于工业化生产。此后由烃类热解生产乙炔的方法相继投入工业化应用,并不断得以发展和改进。目前世界上的乙炔来源主要靠3条途径:天然气、电石和乙烯副产品。
天然气裂解生成乙炔的反应是高温吸热反应,其生产过程按供热方式可分为3大类:电弧法、部分氧化法和热裂解法。
电弧法是最早工业化的天然气制乙炔的方法,至今仍在工业中应用。此方法利用电弧产生的高温和热量使天然气裂解成乙炔。
部分氧化法是天然气制乙炔的主体方法,它利用部分天然气燃烧形成的高温和产生的热量为甲烷裂解成乙炔创造了条件,其典型的代表工艺就是BASF的部分氧化工艺。
热裂解法就是利用蓄热炉将天然气燃烧产生的热量储存起来,然后再将天然气切换到蓄热炉中使之裂解产生乙炔。此方法现在基本上已退出工业生产。
近年来在电弧法基础上发展起来的利用等离子体技术裂解天然气制乙炔的方法已进入工业性试验阶段,极有可能成为取代电弧法生产乙炔工业技术。
6.4.2 部分氧化法
6.4.2.1 工艺原理
天然气制乙炔的过程,是由低位能的烷烃转变为高位能乙炔的过程,因此必须对其反应提供大量能量才能使反应得以实现。
天然气部分氧化法制乙炔的基本原理是使部分甲烷用氧气进行部分氧化生成一氧化碳和水,同时放出大量的热量,使其余甲烷被加热至1500~1600℃发生裂解反应。
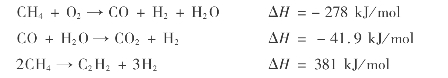
反应产物在反应高温区仅能停留很短时间(一般不超过0.01s),然后用水淬冷,防止生成的乙炔进一步反应。
![]()
甲烷热解反应气体中,乙炔浓度通常都比较低(见表6.10),需用一定的方法对其提浓后才能加以利用。
表6.10 旋焰炉天然气部分氧化裂解气组成(以体积分数计)%

6.4.2.2 工艺流程
天然气部分氧化热解制乙炔的工艺包括两个部分,一是稀乙炔制备,另一个则是乙炔的提浓。工艺流程如图6.29所示。
1)稀乙炔制备
将0.35MPa压力的天然气和氧气分别在预热炉内预热至650℃,然后进入反应器上部的混合器内,按总氧比(n(O2)/n(CH4))为0.5~0.6的比例均匀混合。混合后的气体经多个旋焰烧嘴导流进入反应道,在1400~1500℃的高温下进行部分氧化热解反应。
反应后的气体被反应道中心塔形喷头所喷水幕淬冷至90℃左右。出反应炉的裂化气中乙炔体积分数为8%左右。由于热解反应中有碳析出,裂化气中炭黑质量浓度为1.5~2.0g/m3,这些炭黑依次经沉降槽、淋洗冷却塔、电除尘器等清除设备后,降至3mg/m3以下,然后将裂化气送入稀乙炔气柜贮存。
旋焰裂解反应炉结构如图6.30所示。
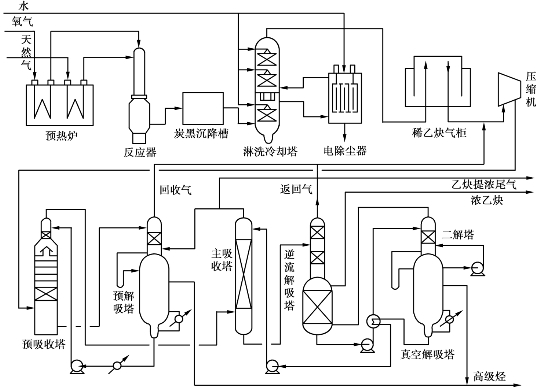
图6.29 部分氧化法天然气生产乙炔流程示意图
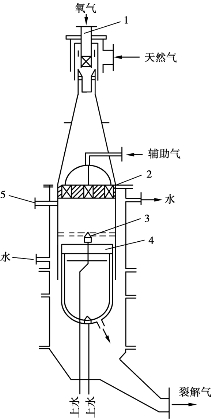
图6.30 旋焰炉结构示意图
1—旋流混合器;2—旋焰烧嘴;
3—淬火头;4—炭黑刮刀;5—点火孔
2)稀乙炔提浓
现行的乙炔提浓工艺主要用N-甲基吡咯烷酮为乙炔吸收剂进行吸收富集。
由气柜来的稀乙炔气与回收气、返回气混合后,由压缩机两级压缩至1.2MPa后进入预吸收塔。在预吸收塔中,用少量吸收剂除去气体中的水、萘及高级炔烃(丁二炔、乙烯基炔、甲基乙炔等)等高沸点杂质,同时也有少量乙炔被吸收剂吸收。
经预吸收后的气体进入主吸收塔时压力仍为1.2MPa左右,温度20~35℃。在主吸收塔内,用N-甲基吡咯烷酮将乙炔及其同系物全部吸收,同时也会吸收部分二氧化碳和低溶解度气体。从顶部出来的尾气中CO和H2体积分数高达90%,乙炔体积分数很小(小于0.1%),可用作合成氨或合成甲醇的合成气。
预吸收塔底部流出的富液,用换热器加热至70℃,节流减压至0.12MPa后,送入预解吸塔上部,并用主吸收塔尾气(分流一部分)对其进行反吹解吸其中吸收的乙炔和CO2等,上段所得解吸气称为回收气,送循环压缩机。余下液体经U形管进入预解吸塔下段,在80%真空度下解吸高级炔烃,解吸后的贫液循环使用。
主吸收塔底出来的吸收富液节流至0.12MPa后进入逆流解吸塔的上部,在此解吸低溶解度气体(如CO2,H2,CO,CH4等);为充分解吸这些气体,用二解吸塔导出的部分乙炔气进行反吹,将低溶解度气体完全解吸,同时少量乙炔也会被吹出。此段解吸气因含有大量乙炔,返回压缩机压缩循环使用,因而称为返回气。经上段解吸后的液体在逆流解吸塔的下段用二解吸塔解吸气底吹,从中部出来的气体就为乙炔的提浓气,乙炔纯度在99%以上。
逆流解吸塔底出来的吸收液用真空解吸塔解吸后的贫液预热至105℃左右后送入二解吸塔,进行乙炔的二次解吸,解吸气用作逆流解吸塔的反吹气,解吸后的吸收液进真空解吸塔,在80%左右的真空度下,以116℃左右温度加热吸收液(沸腾),将溶剂中的所有残留气体全部解吸出去。解吸后的贫液冷至20℃左右返回主吸收塔使用,真空解吸尾气通常用火炬烧掉。
溶剂中的聚合物质量分数最多不能超过0.4%~0.8%,因此需不断抽取贫液去再生,再生方法一般采用减压蒸馏和干馏。
乙炔提浓除N-甲基吡咯烷酮溶剂法外,还可用二甲基甲酰胺、液氨、甲醇、丙酮等作为吸收剂进行吸收提浓。除溶剂吸收法提浓乙炔外,近年研究开发成功的变压吸附分离方法正投入稀乙炔提浓的工业应用中,预计将使提浓工艺得到简化,且经济效果将更佳。
6.4.3 电弧法
电弧法也是BASF开发的,它在电弧炉内的两电极间通入高电压强电流形成电弧,电弧产生的高温可使甲烷及其他烃类裂解而生成乙炔。所采用的电弧电压为7kV,电流强度为1150A,电弧区最高温度可达1800℃。
图6.31为电弧法制乙炔的工艺流程图。天然气以螺旋切线方向进入电弧炉的涡流室,气流在电弧区进行裂解,其停留时间仅有0.002s。裂解气先经沉降、旋风分离和泡沫洗涤除去产生的炭黑,然后经碱液洗、油洗去掉其他杂质。净化后的裂解气暂存于气柜,再送后续工段进行乙炔提浓。
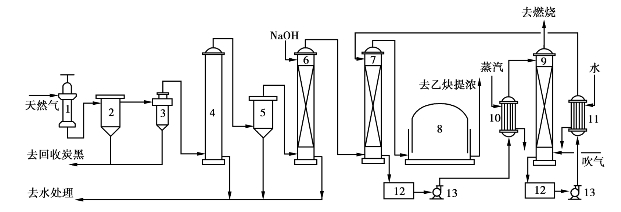
图6.31 电弧法制乙炔工艺流程示意图
1—电弧炉;2—炭黑沉降器;3—旋风分离器;4—泡沫洗涤塔;5—湿式电滤器;6—碱洗塔;
7—油洗塔;8—气柜;9—解吸塔;10—加热器;11—冷却器12—贮槽;13—泵
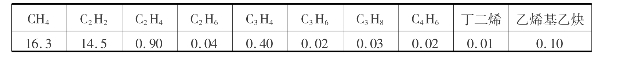
电弧法要求天然气中的甲烷含量较高。以甲烷含量为92.3%的天然气使用电弧法裂解所得裂解气的烃类体积分数如表6.11所示。
表6.11 电弧法裂解气的烃类体积分数 %
电弧法生产乙炔的优点是可以使用各种烃类原料,开车方便;缺点是电耗高,超过10kW·h·kg-1,而且电极损耗快,生产中需要双炉切换操作。
6.5 天然气的氯化加工
天然气的氯化加工,就是将其中的甲烷氯化生成一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳。这些甲烷氯化产品都是有机合成工业中的重要原料或溶剂,用途广泛,用量大。
6.5.1 甲烷氯化物的性质和用途
甲烷氯化物中,除一氯甲烷是气体外,其余都是无色易挥发液体。甲烷氯化产品的主要物理化学数据如表6.12所示。
表6.12 甲烷氯化物的主要物化常数
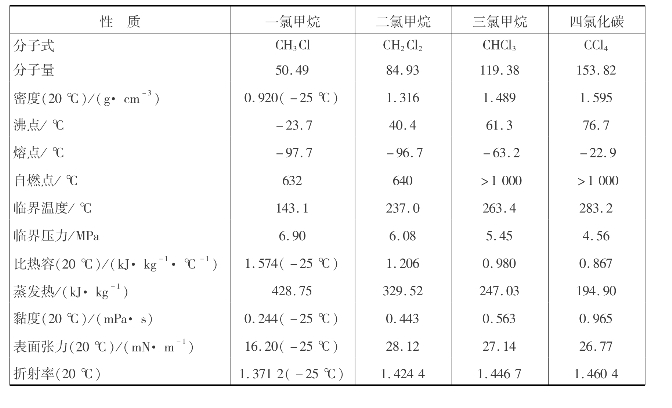
从表6.12可知,甲烷的氯化度越高,沸点越高,密度越大。除一氯甲烷外,其余3种都是很好的有机溶剂,对油脂、橡胶、树酯等都有良好的溶解性,且都是不燃性液体,因此被广泛用于多个领域。
6.5.2 甲烷的氯化反应
当反应温度不太高时,饱和烃的氯化反应是典型的自由基连锁反应,其反应过程包括链的引发、链的传递和链的终止3个阶段,通常采用加热或射入一定波长的光线以提供连锁反应的能量,这就是热氯化或光氯化方法。由于甲烷热氯化或光氯化要副产等分子的HCl,使氯的计算收率不高。20世纪70年代开发出的Transcat氧氯化工艺解决了副产HCl的问题,提高了以氯计算的收率。
表6.13 甲烷氯化产品性质和用途

6.5.2.1 热氯化与光氯化反应机理
在430℃以上,甲烷氯化是不可逆的双分子均相反应,在此温度以下,主要按连锁反应机理进行。在室温和光线不强时,甲烷和氯气不发生反应,只有当氯气分子获得足够能量,被分解为自由基后,连锁反应才能开始。
1)链的引发
由于外界输入一定的能量,如热或光,或由于氯分子与反应器金属器壁表面简单碰撞,氯分子离解成氯原子:氯原子进一步对甲烷产生链引发,形成烷基自由基;烷基自由基再与氯分子作用生成氯代烷和氯原子:
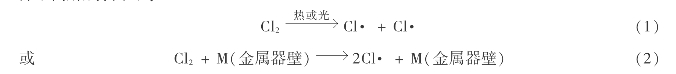

2)链的传递
当氯原子引发甲烷自由基后,链的传递在体系里随之开始:

3)链的终止
由于氯原子与甲基自由基周而复始地传递,其反应也随之层层深入,只有当氯原子或自由基被销毁,连锁反应才能终止。通常有以下4种情况可终止连锁反应:
①氯原子与金属器壁碰撞形成氯分子;
②甲基自由基之间相互碰撞形成乙烷;
③氯原子发生氧化反应;
④有阻止剂存在。
6.5.2.2 甲烷的氧化氯化
由于在热氯化和光氯化反应中都要产生等分子的HCl,使氯的利用率大大降低。甲烷氧化氯化的基本思路是,将不需要的HCl重新变成可利用的氯,以提高氯的利用率。
采用氯化铜-氯化亚铜的熔盐混合物作催化剂,使HCl发生氧化重新生成氯,这就是著名的Deacon反应:
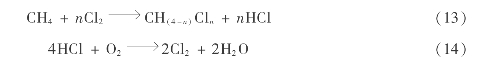
其总反应式为:
![]()
该反应中,关键的反应是氯化氢氧化生成氯气的反应(14),其催化反应机理如下:
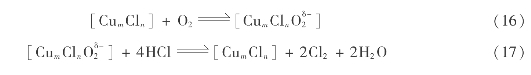
![]()
甲烷氯化的产物实际上是4种甲烷氯化物的混合物,各种氯化物的比例受进气比和反应温度的影响较大,温度高,高氯化物含量高;温度一定,进气中n(Cl2)/n(CH4)越高,高氯化物也越高(见图6.32)。
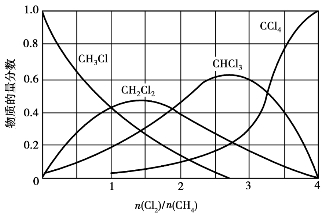
图6.32 n(Cl2)/n(CH4)与甲烷氯化产物组成的关系
甲烷氯化反应是剧烈的放热反应,因此反应温度应控制在500℃以下,超过此温度可能引起爆炸,同时生成碳和氯化氢气体:
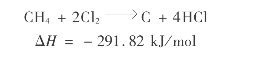
6.5.3 甲烷氯化生产工艺
6.5.3.1 甲烷综合氯化生产工艺
甲烷热氯化与低氯化物光氯化结合生产甲烷氯化物的方法称为综合氯化法,其目的产物是4种甲烷氯化物。
在生产上,为了安全和简化生产条件,在较低温度下对甲烷先进行热氯化,得到的氯化物中,低氯化度甲烷比例较大,然后再用石英水银灯产生340nm波长的紫外光对低氯化产物进行光化氯化,提高高氯化甲烷的比例。工艺流程如图6.33所示。
原料天然气(甲烷)与循环气混合后,与氯气按n(混合气)∶n(氯气)为(3~4)∶1的比例混合送入一级反应器,反应器内装石墨板填料,温度保持在400℃左右进行热氯化反应。反应后的气体中除甲烷氯化物外,还有未反应的甲烷和产生的氯化氢气体,氯气通常被消耗完。
反应气经换热器冷却后,用-30~-20℃的三氯甲烷和四氯化碳混合液吸收,分离出氯化产物;剩余气体送入氯洗涤塔用稀盐酸脱除HCl,然后经中和塔中和、干燥塔干燥后返回与原料气混合再用。
吸收塔底出来的吸收液进汽提塔解吸出大部分一氯甲烷和二氯甲烷,解吸气用热水洗涤除去夹带的HCl后,经中和、干燥,送至蒸馏塔依次蒸馏出CH3 Cl和CH2 Cl2作为产品。
汽提塔和第二蒸馏塔的残余物送入二级反应器A中进行液相光化氯化反应,紫外光340nm,常温下反应。反应产物溢流进入储罐后,送中间产物塔将二氯甲烷分离出来返回光氯化反应器(二级反应器A)回用,余液送入氯仿精馏塔蒸出三氯甲烷产品;残液再经二级反应器B光化氯化成四氯化碳,送四氯化碳精馏塔提纯后得四氯化碳产品。
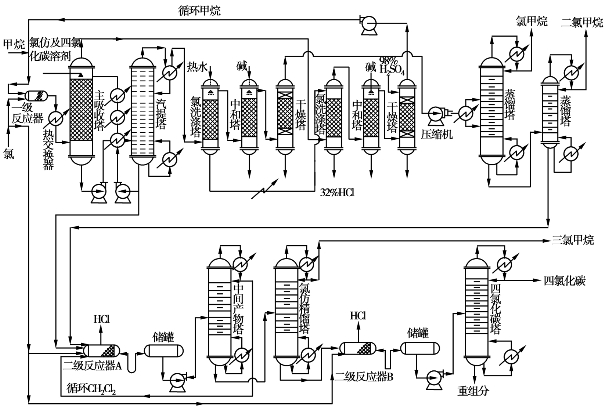
图6.33 甲烷综合氯化法制甲烷氯化物生产流程图
产品规格:
CH3 Cl纯度 99% CH2 Cl2纯度 90%
CHCl3纯度 99.5% CCl4纯度 99.5%
定额消耗(以生产每吨甲烷氯化物计):
天然气(甲烷体积分数>90%) 2220m3 氯气 6960kg
6.5.3.2 甲烷氧化氯化工艺
甲烷氧化氯化一般采用移动床催化氧化氯化工艺(见图6.34),20世纪70年代初,由美国鲁默斯公司首先工业化应用成功。
在氧化氯化工艺中,首先将废氯烃用裂解反应煅烧裂解成HCl,Cl2,CO2和H2 O,裂解温度控制在1316℃以下,裂解气从中部进入氧化反应器,催化剂由氧化反应器上部进入,空气由下部进入,在反应器内发生氧化反应,并使氧载入由氯化亚铜、氯化铜和氯化钾(起降低熔点作用)组成的熔盐溶液中。
氧化反应器出来的气体经处理后,含有N2,CO2,H2 O和O2,一部分排入大气,另一部分返回系统作为提升气,将氧化反应器底部出来的含氧熔盐提升到氧化氯化反应器中,以及将氧化氯化反应器出来的用过的熔盐提升到氧化反应器中去载氧。
与氧化反应器一样,载氧的熔盐从反应器上部进入氧化氯化反应器,经填料床层与下部进来的CH4,Cl2等混合气逆流接触,发生甲烷的氧化氯化反应,生成甲烷氯化物混合气。生成气由塔顶导出,至流出物处理工段除去CO2和H2 O,然后再到氯甲烷分离工段分离出不同甲烷氯化物产品。
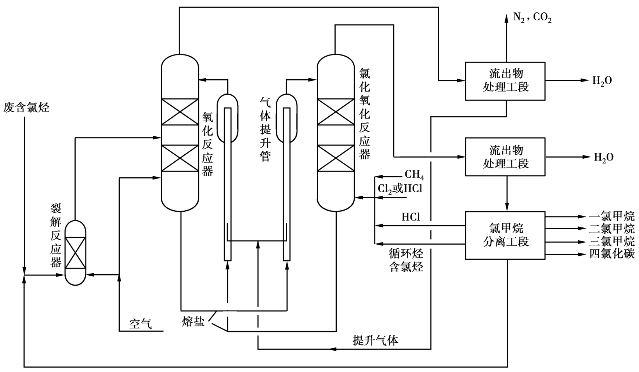
图6.34 甲烷氧化氯化法制甲烷氯化物生产流程图
氧化氯化法不仅可用天然气作原料,还可用乙烷、乙烯等作原料生产烷烃氯化物。由于氧分子不直接与原料气接触,操作较安全,而且氧化氯化反应区压力不超过0.7MPa,温度371~545℃,设备要求相应较低。
6.5.3.3 四氯化碳生产工艺
无论用综合氯化法还是氧化氯化法生产甲烷氯化物,其最终产品都可得到四氯化碳。如果所需产品仅为四氯化碳,可采用单一四氯化碳生产工艺(见图6.35)。
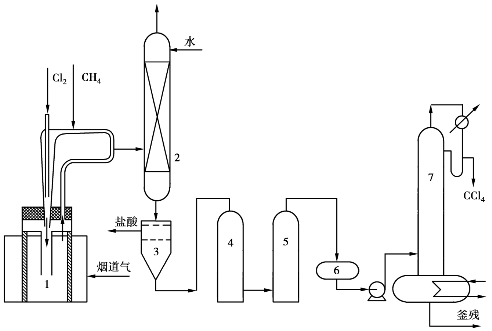
图6.35 甲烷直接氯化制四氯化碳
1—热氯化反应器;2—吸收塔;3—分离器;4—碱洗塔;5—干燥塔;6—中间罐;7—精馏塔
将甲烷预热到380℃,与氯气按3.8∶1的比例混合后经喷嘴进入反应器,同时带入部分氯化产物;反应器顶部排出的产物气,大部分返回反应器,少部分送入吸收塔与水逆流接触,氯化甲烷被冷却下来,HCl被吸收生成盐酸,两者一块进入分离器,上层为水相,排出为盐酸,下层则为粗四氯化碳。粗四氯化碳经碱洗、干燥、精馏处理后,即得四氯化碳产品。
6.6 天然气的其他直接化学加工
6.6.1 天然气合成氢氰酸
氢氰酸(HCN)又叫氰化氢,是一种弱酸性的无机酸,具有一般无机酸的通性。纯氢氰酸是无色流动性好的易挥发液体,有剧毒,在大气中允许质量浓度为0.0003mg/L以下,具有苦杏仁味,沸点25.65℃,熔点-13.3℃,密度0.6874g/cm3,在20~100℃以内可以任何比例与水和多种有机溶剂混溶。氢氰酸可燃,蓝色火焰,空气中的可燃极限为5.6%~40%。低温下氢氰酸比较稳定,当混入水、碱金属或碱土金属化合物、铁屑等杂质后,易起分解或聚合反应,反应放热,有自催化作用,可能引起爆炸。
氢氰酸是重要的化工原料,用途极广,可用来合成甲基丙烯酸酯(有机玻璃单体)、三聚氯氰、草酰胺、核酸碱、二氨基马来腈、氰化钠等,在石油化工、机电、冶金、轻工等行业用量较大。
用天然气为原料合成氢氰酸常用的工业方法是安氏法(Andrussow),就是以甲烷、氨和空气在高温铂合金催化剂作用下发生不完全氧化反应制取氢氰酸:
![]()
其工艺流程如图6.36所示。
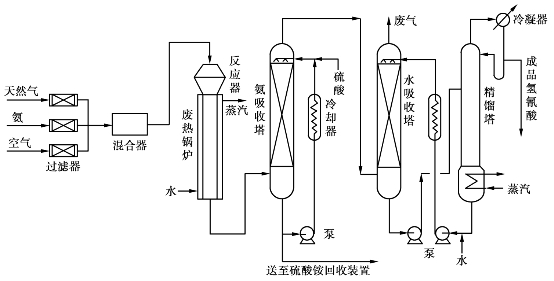
图6.36 安氏法甲烷制氢氰酸流程示意图
天然气、氨、氧气按(1.05~1.1)∶1∶(1.33~1.35)的比例混合均匀后,以0.8~1.2m/s的流速自上而下通过装有3~4层铂网催化剂的反应器,在温度1070~1120℃、压力0.065MPa下反应生成氢氰酸。为防止氢氰酸的高温分解,反应后的气体立即进入反应器下部的废热锅炉冷至200℃左右,然后进入吸收塔,用硫酸除去未反应完的氨。脱氨后的气体用5℃左右的水吸收HCN成水溶液,尾气经处理后放空。
水吸收塔出来的质量分数为2%~3%的HCN水溶液在精馏塔精馏后,得质量分数为99%以上的HCN成品,水冷却后返回使用。
安氏法生产氢氰酸的吨耗指标如表6.14所示。
表6.14 安氏法生产氢氰酸的吨耗指标

除安氏法外,用天然气生产氢氰酸的另一种常见方法是德固萨法(Degussa)。德固萨法实际上是安氏法的改进,也称为BMA法,它与安氏法的最大不同就是甲烷与氨直接在外供热的条件下催化转化得到氢氰酸,不需要氧气环境。该法是将铂催化剂分布于氧化锆陶瓷管的内壁,管内甲烷与氨混合气体经管外间壁加热到1100~1400℃发生反应,以氨计的氢氰酸产率可达83%。此法转化率高、生成物组成简单,但能耗高和反应器结构复杂是其弱点。
6.6.2 天然气硝化制硝基甲烷
硝基甲烷(CH3 NO2)是无色透明,具有芳香味和一定挥发性的易流动油状液体,有毒。密度1.130g/cm3,沸点101℃,凝固点-29℃。溶于水、乙醇和碱溶液,水溶液呈酸性反应,能与多种有机溶剂混溶。硝基甲烷蒸汽与空气能形成爆炸性混合物,爆炸体积分数下限7.3%。
硝基甲烷是一种重要的化工原料和溶剂,可用于合成硝基醇、羟胺盐、氯化苦、三羟基甲基氨基甲烷等,它是一种对涂料、树酯、橡胶、塑料、染料、有机药物等选择性良好的溶剂,常用作硝化纤维、醋酸纤维、丙烯腈聚合物、聚苯乙烯、酚醛塑料等的溶剂。
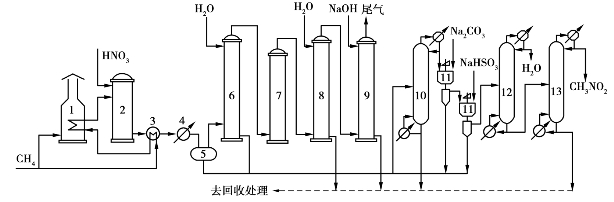
图6.37 甲烷气相硝化流程示意图
1—过热器;2—反应器;3—预热器;4—冷却器;5—气液分离器;6—硝基甲烷吸收塔;7—氧化塔;
8—吸收塔;9—尾气洗涤塔;10—初分塔;11—化学洗涤器;12—脱水塔;13—精馏塔
硝基甲烷的生产一般用甲烷在过热水蒸气存在下用硝酸硝化制得:
![]()
也可用二氧化氮或四氧化二氮进行硝化。
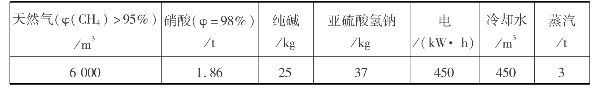
甲烷硝酸气相硝化生产硝基甲烷的工艺流程如图6.37所示。甲烷气相硝化法制硝基甲烷的吨耗指标如表6.15所示。
表6.15 甲烷气相硝化法制硝基甲烷的吨耗指标
1MPa的天然气经加热至300℃后与硝酸一起进入硝化反应器,在常压、300~500℃下完成硝化反应。反应接触时间一般不超过2s,反应气体在速冷器中冷至200℃以下,再用水冷却至室温后,用分离器分出冷凝物,气相送水吸收塔吸收硝基甲烷。
冷凝液与吸收液混合后含硝基甲烷30~40g/L,在初分塔中进行初分,操作压力为常压,釜温101~103℃,喷淋密度为50~200m3/(m2·h),塔顶温度88~95℃,用油水分离器分出粗硝基甲烷,水相回流。
粗硝基甲烷用30~60g/L的碳酸钠和亚硫酸氢钠溶液洗涤,洗涤后的水相回送初分塔,油相送脱水塔蒸去水和轻组分后,再进精馏塔精馏,塔顶馏出物即为含硝基甲烷95%以上的产品。
6.6.3 天然气制二硫化碳
二硫化碳(CS2)是无色透明液体,纯品几乎无味,工业品因含有杂质而带黄色并有恶臭。密度1.26(20℃) g/cm3,熔点-112℃,沸点46.3℃,几乎不溶于水,能与多种有机溶剂混溶。二硫化碳溶解能力很强,能溶解碘、溴、硫、黄磷、脂肪、蜡、树酯、橡胶、樟脑等,是一种用途较广的溶剂。
除用作溶剂外,二硫化碳主要用于人造纤维、四氯化碳、防腐剂、杀虫剂等,也是重要的化工原料。
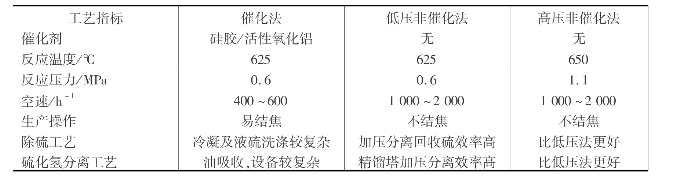
工业上生产二硫化碳的方法主要有两种:木炭法和天然气法。用天然气生产二硫化碳的工艺分催化法和非催化法两类,而非催化法又分低压非催化法和高压非催化法两种。
传统的催化法工艺流程如图6.38所示,其催化剂通常使用硅胶或活性氧化铝。
将熔融的硫磺在气化器中气化成硫蒸汽,将预先干燥过的天然气预热到650℃后,与硫蒸汽混合进入反应器,在反应器中经催化反应生成二硫化碳和硫化氢:
![]()
反应气体在除硫器中除去未反应的硫,冷凝后在吸收塔中用柴油吸收CS2,尾气送硫回收工段回收硫。吸收后的二硫化碳在解吸塔中解吸出来,经冷凝后用二级精馏提纯,得二硫化碳产品,产品纯度95%。
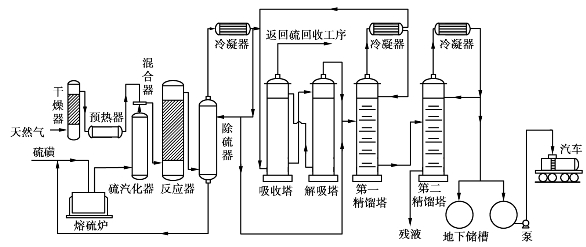
图6.38 天然气制二硫化碳生产工艺流程
由于催化法中的催化剂经常会因为天然气中所含杂质烃类的裂解结焦,使生产受到影响,因此,现在普遍改用非催化法生产。非催化法的工艺流程与图6.38类似,流程中的反应器改为非催化反应器,将吸收和解吸塔换成硫化氢加压分凝器。3种生产工艺情况的比较见表6.16。
表6.16 天然气生产二硫化碳的工艺方法比较
高压非催化法效率虽然比低压非催化法高,但装置投资比较高,因此,采用低压非催化法的相对较多。低压非催化法的主要吨耗指标如表6.17所示。
表6.17 天然气低压非催化法生产二硫化碳吨耗指标
![]()
催化法定额消耗为:硫磺(w(S)≥99.5%)900kg,天然气(φ(CH4)≥95%)约280m3。
6.6.4 天然气直接氧化制甲醛
甲醛,分子式HCHO,分子量30,基本物化性质如表6.18所示。
甲醛易溶于水,在水溶液中以聚甲二醇形式的水合物和多水合物存在。
甲醛是重要的有机合成原料,易进行各种聚合、缩合反应,以甲醛为原料可制取酚醛树酯、脲醛树酯、聚甲醛、维尼纶、乌洛托品、季戊四醇等化工产品,在印染、皮革、造纸、医药、石油等工业部门中也有相当重要的用途。
甲醛的生产方法很多,工业上目前主要采用两种方法:二步法和一步法。
所谓二步法,就是先将烃类原料制成甲醇,然后在常压,500~600℃,铂、银或铜催化剂作用下用空气将甲醇氧化生成甲醛:
![]()
表6.18 甲醛的物理性质
二步法转化率高,原料利用好,但甲醇生产工艺复杂,需高压设备,且流程长。
一步法,就是利用低级烷烃,在催化剂作用下,直接空气氧化制取甲醛。以天然气为原料制甲醛,其催化剂为硼砂和氧化氮:
CH4+O2→HCHO+H2 O ΔH=-280.5kJ/mol
一步法设备简单,流程短,投资少,建设周期短,不需高压设备,很适合天然气、油田气和矿井瓦斯气的就地生产甲醛。但一步法转化率低(单程仅2%~3%),原料利用率较差。
以天然气为原料一步直接空气氧化生产甲醛的工艺流程如图6.39所示。
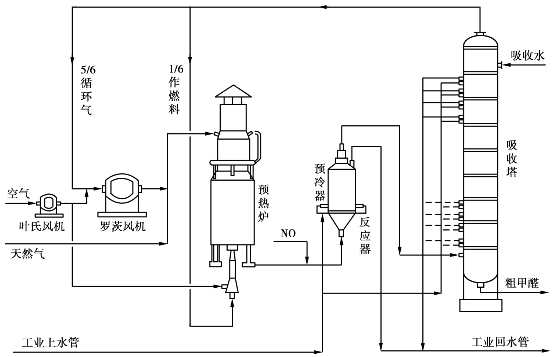
图6.39 天然气直接氧化制甲醛生产流程图
将压力为0.25~0.3MPa的天然气与空气按1∶2的体积比混合后,经预热炉预热至650℃,再与氨氧化制得的NO混合后进入反应器内。在反应器内装有用4%硼酸溶液浸泡过的瓷环作固相催化剂,一氧化氮(NO)为均相催化剂,在670℃,0.136MPa压力下甲烷发生氧化反应生成甲醛。
反应后的气体立即进入反应器上部的速冷器,速冷至90℃后进入吸收塔,用常温水吸收,得到质量分数为30%的粗甲醛水溶液。吸收过甲醛的气体5/6经罗茨风机循环回反应器, 1/6作燃料加热预热炉。粗甲醛水溶液经中和和简单蒸馏即可得到30%以上的甲醛水溶液产品。
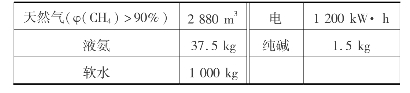
直接氧化法甲烷的单程转化率为2.4%左右,6次循环为11%左右。生产1t30%甲醛水溶液的定额消耗见表6.19所示。
表6.19 生产30%甲醛水溶液的定额消耗/t
思考题
1.天然气的主要成因是什么?其化学成分有哪些?
2.天然气脱水的目的是什么?脱水的效果可用哪些指标来表示?
3.溶剂吸收法天然气脱水所用的吸收剂有哪些?如何确定再生贫液的要求浓度?
4.固体吸附法天然气脱水,请在双塔轮换脱水—再生的流程图中,以1号塔脱水、2号塔再生,描绘出天然气物流的走向。
5.从天然气中脱出的硫(H2 S),一般以硫磺的形式予以回收。硫磺回收的主要反应有哪些?为什么采用两段转化?两段转化的温度各是多少?
6.和合成氨类似,天然气制甲醇也需要进行水蒸气转化反应制合成气。合成氨的合成气和合成甲醇的合成气在组成上有何不同?根据该不同,制备合成气的温度条件有什么不同?
7.天然气合成甲醇的主反应有哪些?主要副反应有哪些?根据反应,判断甲醇双塔精馏的第一塔顶应该得到什么产物?
8.天然气部分氧化制乙炔的反应过程中,可发生哪些主要反应?可获得哪些产品?
9.天然气氧化氯化过程的主要反应有哪些?其中氧化反应的主要目的是什么?该过程可得到哪些氯化产品?
10.天然气和硫磺反应制备二硫化碳的反应式是什么?二硫化碳和硫化氢可用什么方法分离?
