思考题
图3.4BASF二段法生产流程
3.1.2.4 焙烧前矿石原料的预处理和炉气除尘
(1)矿石原料的预处理
对原料进行预处理的目的是使原料的硫质量分数、粒度和水分分别达到一定的要求。不同的原料,需进行的预处理不同。硫精砂的粒度很细,只需干燥后便可送去焙烧,硫铁矿一般为块矿,焙烧前需要破碎和磨细。预处理一般有将硫铁矿粉碎到要求粒度的筛分、将不同品质矿料混合搭配的配矿和脱除硫铁矿中水分等过程。
(2)炉气除尘
沸腾焙烧制得的炉气夹带矿尘最多,其数量与所用原料的品位、粒度、风速和焙烧强度有关,一般为150~300g/m3。炉气中的矿尘不仅会堵塞设备,增大流体阻力,降低传热效果,而且还会堵塞多孔催化剂颗粒的微孔,降低其活性。因此,需要首先尽量除去炉气中的矿尘。要求矿尘标准状态下的质量浓度降低到0.2g/m3以下。
工业上的除尘通常采用机械除尘和电除尘。机械除尘又分为集尘器除尘和旋风除尘两类。一般是按照矿尘的大小,从大到小逐级采用适当方法进行分离的。
3.1.3 炉气的净化与干燥
焙烧硫铁矿制得的炉气中含有因升华而进入炉气的气态氧化物As2 O3,SeO2和HF。砷的存在会使SO2转化的钒催化剂中毒,硒的存在会使成品酸着色。氟的存在不仅对硅质设备及塔填料具有腐蚀性,而且会侵蚀催化剂,引起粉化,使催化床层的阻力上涨。此外,随同炉气带入净化系统的还有水蒸气及少量SO3等,它们本身并非毒物,但在一定条件下两者结合可形成酸雾。酸雾在洗涤设备中较难吸收,带入转化系统会降低SO2的转化率,腐蚀系统的设备和管道。因此,必须对炉气进行进一步的净化和干燥,方可进行二氧化硫的催化转化。
3.1.3.1 炉气的净化
炉气的净化可以采用干法和湿法两种。湿法净化又分为水洗和酸洗,目前普遍采用湿法。
1)砷和硒的清除
三氧化二砷和二氧化硒的饱和蒸汽质量分数随着温度下降而显著降低(表3.3)。炉气冷却到30~50℃后,三氧化二砷和二氧化硒几乎全部凝结。用水或酸洗涤炉气时,一部分砷、硒氧化物被液体带走,大部分凝成固态颗粒悬浮在气相中,成为硫酸冷凝成酸雾的凝聚中心,随后在电除雾器中与酸雾一起清除。气相中的HF被水或稀酸洗涤吸收并溶解。
表3.3 不同温度下As2 O3和SeO2在气体中饱和时(标准状态下)的质量浓度
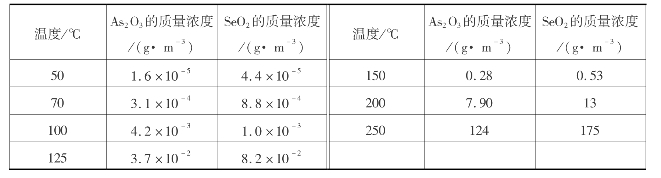
2)酸雾的形成和清除
(1)酸雾的形成
炉气含少量的三氧化硫,也含矿料和空气带入的水分。用水或稀硫酸洗涤时,还有大量水分进入炉气。水分与三氧化硫作用生成硫酸,其反应为:
![]()
反应平衡常数Kp可表示为:
![]()
式中 p(H2 SO4),p(H2 O),p(SO3)——分别表示气相中H2 SO4,H2 O和SO3的平衡分压。
不同温度下的Kp值见表3.4。
表3.4 不同温度下SO3与水蒸气反应的Kp 值

可见,炉气冷却到100~150℃时,炉气中的绝大多数三氧化硫转变成硫酸蒸汽。当气相中硫酸蒸汽的分压大于当时洗涤用硫酸的饱和蒸汽压时,硫酸蒸汽会冷凝。若炉气温度下降很快,硫酸蒸汽的冷凝速度跟不上气温的下降速度,或周围没有可供硫酸蒸汽冷凝的表面,气相中硫酸蒸汽就处于过饱和状态。过饱和程度随温度降低而变得显著。过饱和程度达到某一临界限度时,硫酸蒸汽分子凝聚成为数量众多的细小液滴,硫酸蒸汽再在这些液滴上冷凝,成为气溶胶酸雾,气相中硫酸蒸汽的过饱和程度逐步下降至饱和为止。硫酸蒸汽的过饱和程度S可用以下比值表示:生成酸雾的最低过饱和度称为临界过饱和度,与温度和物质条件有关,与温度的关系如图3.5所示。当物系中存在悬浮的微粒或细滴时,它们成为冷凝的凝聚核心,硫酸蒸汽只要较小的过饱和度就会形成酸雾。
![]()
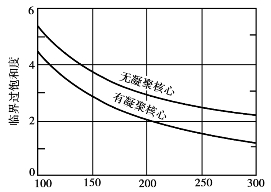
图3.5 硫酸蒸汽冷凝的临界过饱和度
在上述空间冷凝时,若炉气温度骤然降低,硫酸蒸汽的过饱和度剧增,形成的是细微而高度分散的酸雾气溶胶。反之,炉气温度缓慢下降,易形成颗粒较大的雾粒。
若硫酸蒸汽在有冷凝表面(如壁面或液膜)存在下冷凝,并适当控制炉气冷却速度和炉气与冷凝表面间的温度差,可以减少酸雾生成,甚至抑制酸雾。
(2)酸雾的清除
湿法净制时,用水或稀硫酸洗涤炉气,炉气的温度骤降,形成酸雾是不可避免的。酸雾的雾滴直径很小,是很难捕集的物质,洗涤时只有少部分(30%~50%或更少)被酸吸收,大部分要用湿式电除雾器清除。
电除雾器是使雾滴在静电场中沉降,由电晕电极放电,气体中的酸雾液滴带上电荷后趋向沉淀极,在沉淀极上电荷传递后沉析在电极上,凝聚后因自身重力下流。
增大雾滴直径是提高效率的有效方法。增大雾滴直径的主要措施是使炉气增湿。当炉气湿度增大并冷却时,水汽在酸雾表面冷凝而使雾滴增大。酸洗流程中常用增湿塔喷淋5%硫酸使炉气增湿。用文丘里洗涤器时,既除去一些酸雾,也使酸雾液滴增大。清除酸雾时,组成雾滴凝聚核心的砷、硒氧化物等微粒也同时被消除。
3.1.3.2 炉气净制的湿法工艺流程和设备
湿法洗涤有水洗和酸洗两类,但水洗工艺因排污量大,污水处理困难,在越来越高的环保要求条件下已逐渐被淘汰。酸洗流程是用稀硫酸洗涤炉气,除去其中的矿尘和有害杂质,降低炉气温度。大中型硫酸厂多采用酸洗流程。经典的酸洗流程是三塔二电流程,基本工序如图3.6所示。
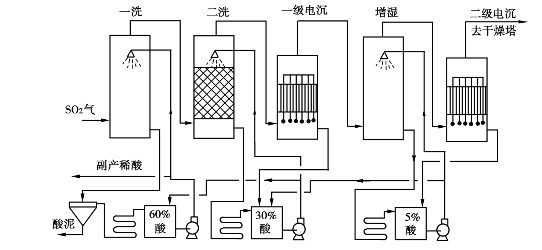
图3.6 三塔二电酸洗流程
温度为327℃左右的热炉气,由下而上通过第一洗涤塔,被温度为40~50℃、质量分数为60%~70%的硫酸洗涤。除去了炉气中大部分矿尘及杂质后,温度降至57~67℃,进入第二洗涤塔,被质量分数为20%~30%的硫酸进一步洗涤冷却到37~47℃。这时炉气中气态的砷硒氧化物已基本被冷凝,大部分被洗涤酸带走,其余呈细小的固体微粒悬浮于气相中,成为酸雾的凝聚中心并溶解其中,在电除雾器中除去。
炉气在第一段电除雾器中分离掉大部分酸雾后,剩余的酸雾粒径较细。为提高第二段电除雾效率,炉气先经增湿塔,用5%的稀硫酸喷淋,进一步冷却和增湿,同时酸雾粒径增大,再进入第二段电除雾器,进一步除掉酸雾和杂质。炉气离开第二段电除雾器时,温度为30~35℃,所含的水分在干燥塔中除去。
从第一洗涤塔底流出的洗涤酸,其温度和浓度均有提高,且夹带了大量矿尘杂质,为了继续循环使用,先经澄清槽沉降分离杂质酸泥,上部清液经冷却后继续循环喷淋第一塔。进入第一洗涤塔的炉气含尘较多,宜采用空塔以防堵塞。第二洗涤塔通过的炉气和循环酸含尘少,可以采用填料塔。循环酸可不设沉降槽,只经冷却器冷却后,再循环喷淋第二塔。
增湿塔和电除雾器流出的稀酸送入第二洗涤塔循环槽,第二塔循环槽多余的酸串入第一洗涤塔循环槽。这样,炉气带入净化系统的三氧化硫最终都转入循环酸里,并从第一洗涤塔循环泵出口引出作为稀酸副产品,但由于其中含较多的有害物质,用途受到很大限制。
该流程的特点是排污少,二氧化硫和三氧化硫损失少,净制程度较好,缺点是流程复杂,金属材料耗用多,投资费用高。
随着科学技术的发展,这种20世纪50年代的先进工艺在某些方面已显得落后。比如净化系统的除热。原三塔两电流程中,炉气带入系统的显热主要靠喷淋酸带出塔外,然后用水冷却酸。这种方法设备多,体积大,传热效率低。现在的塔式稀酸洗涤流程中,第一洗涤塔广泛采用了绝热蒸发,炉气的显热以潜热的形式转入后续设备,这样既提高了炉气除砷的效果,又简化了流程。此外,目前已出现了一系列高效、耐腐蚀的新型设备和材料。
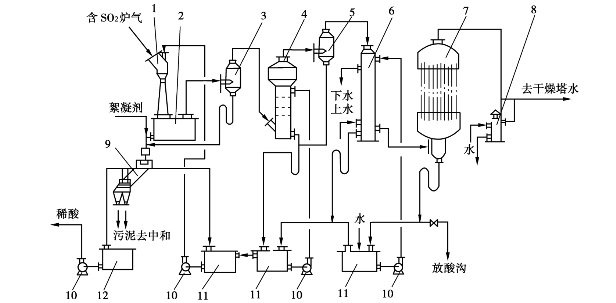
图3.7 文—泡—冷—电酸洗流程
1—文氏管;2—文氏管受槽;3,5—复挡除沫器;4—泡沫塔;6—间接冷却器;
7—电除雾器;8—安全水封;9—斜板沉降槽;10—泵;11—循环槽;12—稀酸槽
文—泡—冷—电酸洗流程(图3.7)是为了适应环境保护的需要,在水洗流程的基础上改革开发了以文氏管为主要洗涤冷却设备的酸洗净化流程。该流程具有以下特点:
①炉气采用两级洗涤。第一级为喷射洗涤器,洗涤酸H2 SO4的质量分数为15%~20%,第二级为泡沫塔,用质量分数为1%~3%的稀硫酸洗涤,洗涤酸循环使用。
②文氏管及泡沫塔均用绝热蒸发冷却炉气,故循环系统不设冷却装置,系统的热量主要由间冷器冷却水带走。
③流程对炉尘含量适应性强。本流程中,炉气进入净化系统前未经电除尘,含尘量在4~5g/m3,文氏管的除尘率达90%以上。经净化后的炉气,水分和杂质含量均达到指标。
④进入系统的矿尘杂质,大部分转入洗涤酸中。含尘洗涤酸从文氏管下部流入斜板沉降槽时,加入聚丙烯酰胺絮凝剂,以加速污泥的沉降,经沉降后的清液循环使用,从而大大减少了净化系统的排污量,大约每吨酸的排污量为25L,达到了封闭循环的要求。
两塔一器两电稀酸洗涤净化流程(图3.8)在大型厂中获得广泛应用。该流程具有以下特点:
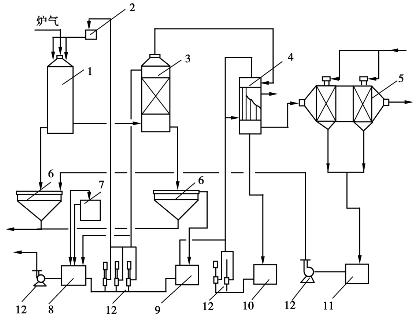
图3.8 两塔一器两电酸洗流程
1—空塔;2—高位槽;3—洗涤塔;4—冷却器;5—电除雾器;6—沉降槽;
7—硅反应槽;8,9—循环槽;10—冷却排液槽;11—洗涤水槽;12—泵
①用温度较高的稀酸喷淋洗涤高温烟气。洗涤酸由于受热而绝热蒸发,酸浓度提高而温度基本不变,省去了出塔酸冷却设备,简化了流程。洗涤酸较高的温度提高了三氧化二砷在酸中的溶解度,减少因砷析出而对管道的堵塞。第一洗涤塔内气相和液相温度较高,降低了硫酸蒸汽的过饱和度,酸雾生成量相对减少。
②第一塔采用质量分数为10%~15%的稀酸洗涤,第二塔洗涤酸H2 SO4质量分数仅1%,有利于气相中砷、氟的清除。
③稀酸循环系统设置硅石反应槽,使溶解在稀酸中的氟化氢与硅石反应,形成溶解度低的氟硅酸而分离,这样可避免稀酸中的氟化氢再次逸入气相。
④第一洗涤塔采取气-液并流方式,避免烟尘堵塞进口气道。且塔系操作气速比常见的高,尤其是第一洗涤塔,比一般塔式酸洗流程中的操作气速大2~3倍,从而强化了设备处理能力。
⑤用列管式石墨冷凝器作为净化系统的除热装置。在气体冷却过程中,由于水蒸气在雾粒表面的冷凝,使雾粒直径增大。为改善传热,采用管内带有翅片的挤压铅管。
⑥采用具有导电和防腐蚀性能的FRP(以聚醋酸纤维和乙基树酯作内层的玻璃钢)作电除雾器。除雾器为卧式,电压80kV,电流300mA。除雾设备小,效率高。
⑦在材质上大量采用非金属材料和耐腐蚀材料,塔的主体及槽管采用耐氟的FRP,塔内的填料改用聚丙烯鲍尔环,以抗氟害。既节省了铅材,施工也方便。
3.1.3.3 炉气的干燥
炉气除去矿尘、杂质和酸雾之后,需经干燥除去炉气中的水分。
1)干燥的原理和工艺条件
因浓硫酸具有吸湿性,常用它来干燥炉气。干燥过程所用的设备,目前广泛采用的是填料塔。为了强化干燥的速率,在接触表面一定时,必须合理选择气流速度、吸收酸浓度、温度以及喷淋密度等。
(1)吸收酸的浓度
在一定温度下,硫酸溶液上的水蒸气压随H2 SO4质量分数的增加而减少,在H2 SO4质量分数为98.3%时,具有最低值。各种温度下不同浓度硫酸溶液的水蒸气分压如图3.9所示。
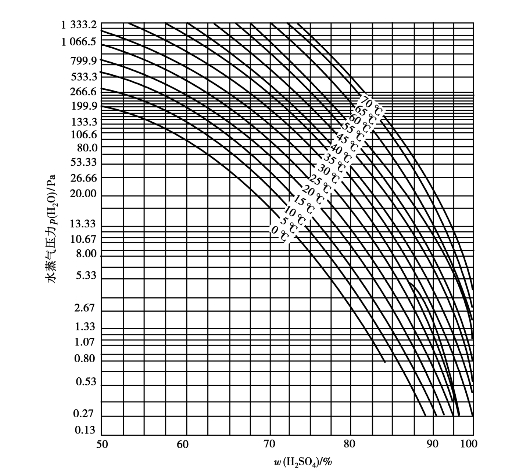
图3.9 硫酸溶液的水蒸气分压
由图3.9可看出,同一温度下硫酸浓度越高,其水蒸气平衡分压越小。如在40℃时,质量分数为92%的H2 SO4液面上水蒸气的平衡分压为2.67Pa左右,此值与同一温度下纯水的饱和蒸汽压7.89kPa相比约小3000倍。从脱水指标看,干燥炉气所用的硫酸浓度越高越好。但是,硫酸浓度越高,三氧化硫分压越大,三氧化硫易与炉气中的水蒸气形成酸雾。温度越高,生成的酸雾越多,表3.5中列出了不同温度下干燥后炉气中酸雾质量浓度与干燥塔喷淋酸质量分数的关系。
表3.5 干燥后气相中酸雾质量浓度与喷淋酸质量分数的关系
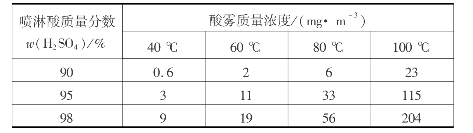
硫酸的浓度大于80%之后,二氧化硫的溶解度随酸浓度的提高而增大。当干燥酸作为产品酸引出或串入吸收工序的循环酸槽时,酸中溶解的二氧化硫就随产品酸带走,引起二氧化硫的损失。
表3.6列出了二氧化硫损失与干燥塔喷淋酸质量分数与温度的关系。
表3.6 二氧化硫损失与干燥塔喷淋酸质量分数、温度的关系
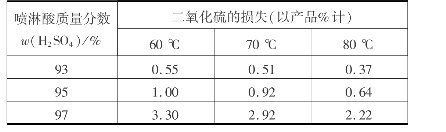
从表3.6可以看出,硫酸的质量分数越高,温度越低,二氧化硫的溶解损失越大。
综上所述,干燥酸质量分数以93%~95%较为适宜,这种酸还具有结晶温度较低的优点,可避免冬季低温下,因硫酸结晶而带来操作和贮运上的麻烦。
(2)气流速度
提高气流速度能增大气膜传质系数,有利于干燥过程的进行。但气速过高,通过塔的压降迅速增加,其关系可用下式表示:
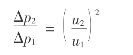
式中 Δp1,Δp2——分别是填料塔内气流速度为u1和u2时的流体压力降。
气速过大,炉气带出的酸沫量多,甚至可造成液泛。目前干燥塔的空塔气速大多为0.7~0.9m/s。
(3)吸收酸的温度
降低干燥塔内吸收酸的温度,有利于减少吸收酸液面上水蒸气分压和酸雾的生成,有助于干燥过程的进行。但吸收酸温度过低,二氧化硫溶解损失增加。为此,某些制酸装置在干燥流程中设置一个吹出塔,以回收溶解在浓硫酸中的二氧化硫,这样又使流程变得复杂。此外,干燥塔酸温规定得过低,必然会增加酸循环过程中冷却系统的负荷。实际生产中,干燥塔进口酸温取决于水温及循环酸冷却效率,通常酸温为30~45℃。
(4)喷淋密度
由于炉气干燥是气膜控制的吸收过程,在理论上,喷淋酸量只要保证塔内填料表面的全部润湿即可。但硫酸在吸收水分的同时,产生大量的稀释热,使酸温升高。因此,若喷淋量过少,会使硫酸浓度降低和酸温升高过多,降低干燥效果,加剧酸雾的形成。
通常的喷淋密度是10~15m3/(m2·h)。喷淋密度过大,不仅增加气体通过干燥塔的阻力损失,也增加了循环酸量,这两项均导致动力消耗增加。
2)炉气干燥的工艺流程
炉气干燥的工艺流程如图3.10所示。经过净化除去杂质的湿炉气,从干燥塔的底部进入,与塔顶喷淋的浓硫酸逆流接触,气相中的水分被硫酸吸收后,经捕沫器以除去气体夹带的酸沫,然后进入转化工序。
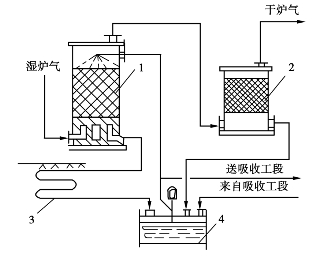
图3.10 炉气干燥工艺流程
1—干燥塔;2—捕沫器;3—酸冷却器;4—干燥酸贮槽
吸收了水分后的干燥酸,温度升高,由塔底流入淋洒式酸冷却器,温度降低后流入酸贮槽,再由泵送到塔顶喷淋。
为维持干燥酸浓度,必须由吸收工序引来质量分数为98% H2 SO4,在酸贮槽中混合。贮槽中多余的酸由循环酸泵送回吸收塔酸循环槽中,或把干燥塔出口质量分数为92.5%~93%的硫酸直接作为产品酸送入酸库。
3.1.4 二氧化硫的催化氧化
二氧化硫炉气经过净化和干燥,消除了有害杂质,余下主要是SO2、O2和惰性气体N2。SO2和O2在钒催化剂作用下发生氧化反应,生成SO3。这是硫酸生产中的重要一步。
3.1.4.1 化学平衡和平衡转化率
二氧化硫的催化氧化反应如下:
![]()
反应释放出大量的热,该反应的平衡常数可表示为:
![]()
在400~700℃范围内,反应热、平衡常数与温度的关系可用下列简化经验式:
![]()
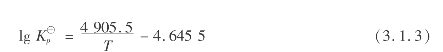
根据平均常数可得二氧化硫平衡转化率x e的计算式如下:
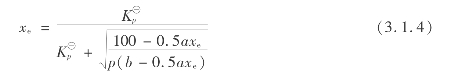
式中 a,b——分别为SO2和O2的初始体积百分数。
当压强p和炉气的原始组成一定时,平衡转化率x e随温度的升高而降低,温度越高,平衡转化率下降的幅度越大。不同炉气原始组成时的平衡转化率与温度的关系如表3.7所示。
表3.7 0.1MPa下不同炉气组成的平衡转化率x e与温度的关系
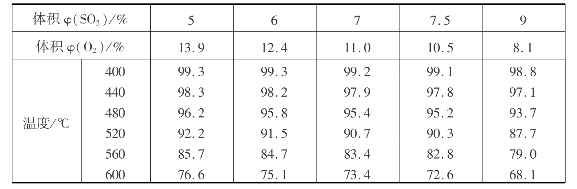
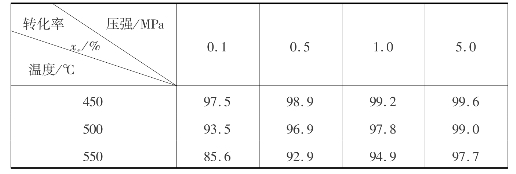
炉气原始组成为:φ(SO2)=7%,φ(O2)=11%,φ(N2)=82%时,不同温度、压强下的平衡转化率如表3.8所示。由表3.8可以看出,当压强增大时,平衡转化率也随着增大,平衡向生成SO3的方向移动。但是,由于常压下转化率已经很高(97.5%),所以工业生产上多用常压转化。
表3.8 平衡转化率与压强、温度的关系
3.1.4.2 二氧化硫催化氧化的动力学
1)催化剂
目前硫酸工业中二氧化硫催化氧化反应所用的催化剂仍然是钒催化剂,它是以五氧化二钒(V2 O5的质量分数为6%~12%)为活性组分,氧化钾为助催化剂,以硅藻土或硅胶为载体制成的。有时还配少量的Al2 O3,BaO,Fe2 O3等,以增强催化剂某一方面的性能。
钒催化剂一般要求具有活性温度低,活性温度范围大、活性高、耐高温、抗毒性强、寿命长、比表面积大、流体阻力小、机械强度大等性能。
国产的钒催化剂型号有S101,S102和S105。S101是国内广泛使用的中温催化剂,S102是环状催化剂,S105是低温催化剂。S101钒催化剂用优质硅藻土为载体,操作温度425~600℃,适用于催化剂床层的各段,其催化活性已达国际先进水平。
对钒催化剂有害的物质有砷、硒氧化物、氟化物、矿尘等。砷氧化物对钒催化剂的危害表现在两个方面:一是对As2 O3很敏感,会将As2 O3吸附,造成催化剂孔隙堵塞,活性下降;二是在较高温下,特别是500℃以上,能和As2 O3生成一种V2 O5·As2 O5的挥发性物质,把V2 O5带走,使催化剂活性降低。温度越高,As2 O3浓度越高,则挥发的V2 O5越多。
硒在温度低于400℃时对钒催化剂有毒害,在400~500℃加热后能恢复活性。
氟在炉气中以HF的形态存在,它能和硅的氧化物作用生成SiF4,从而破坏催化剂载体,使催化剂粉碎。氟还能与钒反应生成VF5(沸点111.2℃),使V2 O5挥发,催化剂活性降低。
水蒸气在大于400℃的温度下对催化剂无毒害作用。低于此温度时,水蒸气与三氧化硫形成酸雾;在一定条件下会损坏催化剂,使机械强度和活性降低。
矿尘能覆盖在催化剂的表面,因而使其活性降低,并增加催化床层的阻力。
2)二氧化硫催化氧化反应速度
在工业生产条件下,作为气-固催化反应的二氧化硫催化氧化,其气流速度已足够大,不会出现外扩散控制。关于二氧化硫催化氧化反应机理,目前尚无定论。我国钒催化剂上常用的反应速率方程为:
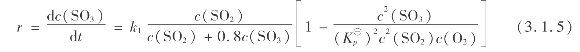
式中 k1——二氧化硫催化氧化的正反应速率常数;
k2——二氧化硫催化氧化的逆反应速率常数;
![]() ——二氧化硫催化氧化的总反应速率常数。
——二氧化硫催化氧化的总反应速率常数。
以二氧化硫和氧的初始浓度a,b代入,式(3.1.5)变为:
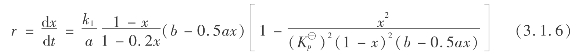
钒催化剂有大量孔隙,孔隙率为50%~60%,有相当数量的孔隙直径为0.1~1μm,内表面积为2~10m2/g。二氧化硫和氧分子扩散到孔深处和生成的三氧化硫分子从微孔深处向外扩散都有很大的阻力。当传质速率低于化学反应速率时,催化剂的内表面不能充分利用。圆柱形钒催化剂的内表面利用率如图3.11所示。
当内表面利用率接近于1,过程为动力学控制;若远小于1,则过程中内扩散有显著影响。从图中可见,催化剂颗粒越小,内表面利用率越高;当颗粒增大,微孔深度增加,内表面利用率就降低。此外,在催化剂的活性温度范围内,温度提高,反应速度加快,反应物还来不及扩散到颗粒深孔,反应已经完成,深处的内表面未能及时起作用使内表面利用率降低。同理,低转化率时,过程有较快反应速度,也使内表面利用率降低。只有在转化率高,反应温度较低和催化剂小颗粒的情况下,内表面才能较好利用。从宏观动力学来说,二氧化硫催化氧化的开始和中间阶段,内扩散起着显著的作用,仅在反应末期才属动力学控制。不同控制步骤的反应物浓度分布如图3.12所示。
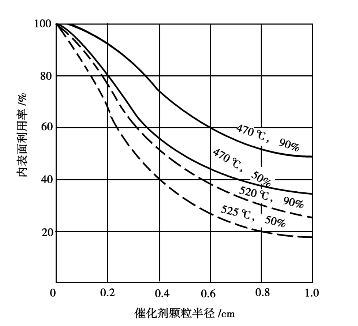
图3.11 不同温度和二氧化硫转化率时,圆柱形钒催化剂的内表面利用率
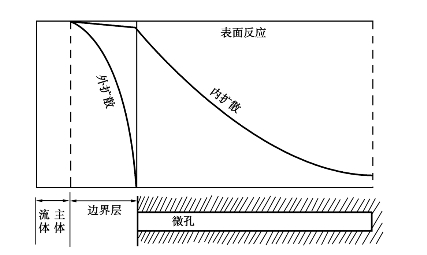
图3.12 不同控制步骤的反应物浓度分布
3.1.4.3 二氧化硫催化氧化的工艺条件
根据平衡转化率和反应速度综合分析,二氧化硫催化氧化的工艺条件主要涉及反应温度、起始浓度和最终转化率3个方面。这些工艺条件怎样才是最适宜,则应根据技术经济原则进行判断。这些原则是:提高转化率和原料利用率,提高劳动生产率和生产操作强度,降低生产费用和设备投资等。
1)最适宜温度
温度对SO2氧化反应的平衡转化率x e和催化氧化反应速度r均有很大影响。从平衡角度来看,温度越低,平衡转化率高;从动力学角度来看,温度越高,反应速度快;而催化剂有一个活性温度范围。为了确定最适宜温度,我们先来看T-x e-r之间的变化规律(图3.13)。
从图3.13可以看出,在各种转化率下,都有一个反应速度的最大值,与此值相应的温度称为最适宜温度;随着转化率的升高,最适宜温度逐渐降低。
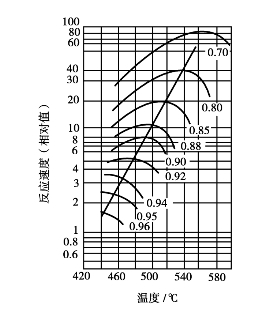
图3.13 反应速度与温度的关系
由热力学原理知,增加压力,平衡温度提高;提高转化率,平衡温度下降;原始气体组成中,降低SO2体积分数,提高O2体积分数,将使平衡温度增大,最佳温度将相应地变化。
2)二氧化硫的起始浓度
进入转化器的最适宜SO2体积分数是根据硫酸生产的总费用最小来确定的。若增加炉气中SO2的体积分数度,就相应地降低了炉气中O2的体积分数。由式(3.1.6)可知,若O2的体积分数(b)减小,SO2体积分数(a)则增大,反应速度d x/d t随之降低,为达到一定的最终转化率所需要的催化剂量也随之增加。因此,从减小催化剂量的角度来看,采用SO2体积分数低的炉气进入转化器是有利的。但是,降低炉气中SO2体积分数,会使生产所需要处理的炉气量增大。在其他条件一定时就要求增大干燥塔、吸收塔、转化器和输送,SO2的鼓风机等设备的尺寸,或者使系统中各个设备的生产能力降低,从而使设备折旧费用增加。因此,必须经过经济核算来确定在硫酸生产总费用最低时的SO2体积分数。SO2体积分数与生产成本的关系如图3.14所示。
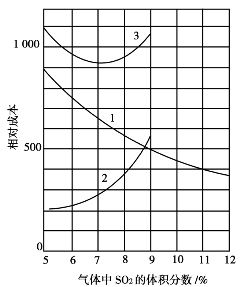
图3.14 SO2体积分数对生产成本的影响
1—设备折旧费与SO2的初始体积分数的关系;
2—最终转化率97.5%时催化剂用量与SO2的初始体积分数的关系;
3—系统生产总费用与SO2的初始体积分数的关系
图3.14中曲线1表明,随着SO2体积分数的增加,设备生产能力增加,相应设备折旧费减少。曲线2表明,随着SO2体积分数的增加,达到一定最终转化率所需催化剂量增加。曲线3表示系统生产总费用与SO2体积分数的关系。a的值为7%~7.5%时,总费用最小。如果炉气中的SO2体积分数超过最佳体积分数,可在干燥塔前补加空气来维持最佳体积分数。
应指出的是,图中数据是在焙烧普通硫铁矿,采用一转一吸流程,最终转化率为97.5%的情况下取得的。当原料改变或生产条件改变时,最佳浓度也将改变。例如,以硫磺为原料,SO2最佳体积分数为8.5%左右;以含煤硫铁矿为原料,SO2最佳体积分数小于7%;以硫铁矿为原料的两转两吸流程,SO2最佳体积分数可提高到9.0%~10%,最终转化率仍能达到 99.5%。
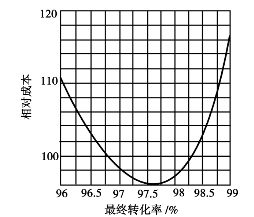
图3.15 最终转化率与成本的关系
3)最终转化率
最终转化率是接触法生产硫酸的重要指标之一。提高最终转化率,可使放空尾气中二氧化硫含量减少,提高原料中硫的利用率,减少环境污染。提高最终转化率需要增加催化剂的用量,并增大流体阻力。因此在实际生产中,主要考虑硫酸生产总成本最低的最终转化率。
最终转化率的最佳值与所采用的工艺流程、设备和操作条件有关。一次转化一次吸收流程,在尾气不回收的情况下,最终转化率与生产成本的关系如图3.15所示。
由图可知,当最终转化率为97.5%~98%时,硫酸的生产成本最低。如有SO2回收装置,最终转化率可以取得低些。如采用两次转化两次吸收流程,最终转化率则应控制在99.5%以上。
3.1.4.4 二氧化硫催化氧化的工艺流程及设备
二氧化硫的催化氧化是可逆放热反应,最适宜温度随转化率的升高而降低。随着催化氧化反应的进行,物系不断放出大量的热量,必然使物系温度不断上升,因此适时、适量地移出反应热,以保持物系的最适宜温度是转化流程和反应器设计的基本原则。
按热量的移出方式不同,转化反应器的型式也有所不同。大致可分为内部换热式和段间换热式(或称多段换热式)两类。前者在转化器内设置催化剂管或冷管(为内部换热式SO2转化器),冷却介质在SO2转化过程中带走热量,以保持最适宜温度。这种转化器结构复杂,操作不便,后来逐渐由段间换热式SO2转化器所代替。它将转化分为几段,每一段基本上进行绝热反应,温度升高后停止反应,在段间冷却降温,温度降低到设计要求后再进行下一段反应。段数越多,反应过程越接近最适宜温度分布的要求。
1)段间换热式转化器的中间冷却方式
段间换热式转化器的中间冷却方式可分为两类,间接换热式和冷激式两种。
间接换热式是将部分转化的热气体与未反应的冷气体在间壁换热器中进行换热,达到降温的目的。换热器放在转化反应器内,称为内部间接换热式,放在转化反应器外,为外部间接换热式。
内部间接换热式转化器结构紧凑,系统阻力小,热损失也小。其缺点是转化器本体庞大,结构复杂,检修不便。特别是由于受管板的机械强度限制,难以制作大直径的转化器,故这种转化器只适用于生产能力较小的转化系统。外部间接换热式转化器,由于换热器设在体外,转化器和换热器的连接管线长,系统阻力和热损失相应增加,占地面积也增多。其优点是转化器结构简单,易于大型化。
图3.16是多段间接换热式转化器内SO2氧化的T-x图。图中的冷却线是水平的,因为冷却过程中混合气体的组成没有变化,所以转化率不变。从这个图可以看出,各段绝热操作线斜跨最适宜温度曲线的两侧,段数越多,跨出最适宜曲线的范围越短,也即是越接近最适宜操作。但是,转化器段数的增多必然导致设备和管路庞杂,阻力增加,操作复杂。实际生产中,一般采用4~5段的间接换热式转化器。
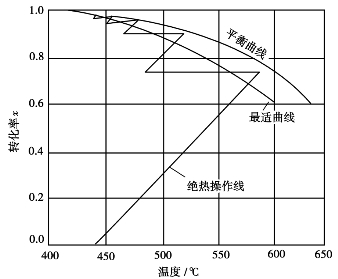
图3.16 多段间接换热式转化器内的T-x图
冷激式转化器采用绝热操作。但冷激式采用冷的气体通入绝热反应后的热气中,让其迅速混合,降低反应气温度。冷激介质可以是冷炉气,也可以是空气,分别称为炉气冷激和空气冷激。
炉气冷激式只有部分新鲜炉气进入第一段催化床,其余的炉气作冷激用。图3.17系四段炉气冷激过程的T-x图,与图3.16不同之处在于换热过程的冷却线不是水平线而是一条温度和SO2转化率都降低的直线。这是由于加入了冷炉气,气体混合物中二氧化硫含量增多,三氧化硫含量虽然不变,但二氧化硫和三氧化硫总含量增加,由此计算而得的转化率降低。
空气冷激式转化器是在段间补充干燥的冷空气,使混合气体的温度降低,尽量满足最适宜温度的要求。图3.18表示四段空气冷激过程的T-x关系。添加冷空气后,气体混合物中SO2 和SO3含量比值没有变化,冷却线仍为水平线;加入空气后,进入下一段催化床的原料气的原始组成发生变化,初始SO2体积分数降低,O2的体积分数增加,平衡曲线、最适宜温度线将向同一温度下SO2转化率增高的方向移动,各段绝热操作线斜率发生改变,彼此不平行。
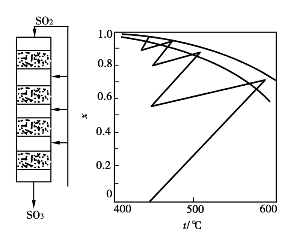
图3.17 四段炉气冷激T-x图
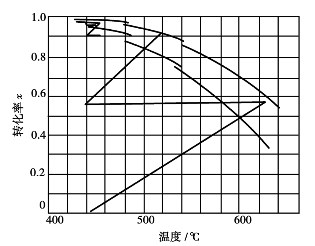
图3.18 四段空气冷激式的T-x图
空气冷激因省略了中间换热器,流程也随着简化。但必须指出,采用空气冷激必须满足两个条件:第一,送入转化器的新鲜混合气体不需预热,便能达到最佳进气温度。第二,进气中的SO2体积分数比较高,否则由于冷空气的稀释,使混合气体体积分数过低,体积流量过大。
根据这些特点,当用硫磺或硫化氢为原料时,炉气中的SO2体积分数较高,炉气比较纯净,无须湿法净化,适当降低温度即可进入转化器,适宜于采用多段空气冷激。而用普通硫铁矿为原料时,炉气中SO2体积分数变化不大,湿法净化后的气体又需升温预热,所以宜采用多段间接换热式或多段间接换热式与少数段炉气冷激相结合部分冷激式。
2)一次转化流程
一次转化是将炉气一次通过多段转化器转化,段与段间进行换热,转化气送去吸收。一次转化按段间的换热方式可分为间接换热式一次转化、冷激式一次转化和冷激-间接换热式一次转化3种方式。下面以炉气冷激-间接换热式一次转化流程为例。
炉气冷激-间接换热一次转化流程如图3.19所示。大部分炉气(约85%)经各换热器加热到430℃后进入转化器。其余炉气从Ⅰ-Ⅱ段间进入,与Ⅰ段的反应气汇合,使转化气温度从600℃左右降到490℃左右,以混合气为基准的二氧化硫转化率从Ⅰ段反应气的65%~75%降到混合气的50%~55%。为获得较高的最终转化率,炉气冷激只用于Ⅰ-Ⅱ段间,其他各段间仍用换热器换热,换热器采用外部换热式。这一流程省去了Ⅰ-Ⅱ段间的热交换器,Ⅳ-Ⅴ段间只用两排列管放在转化器内换热,简化了转化器结构,也便于检修。
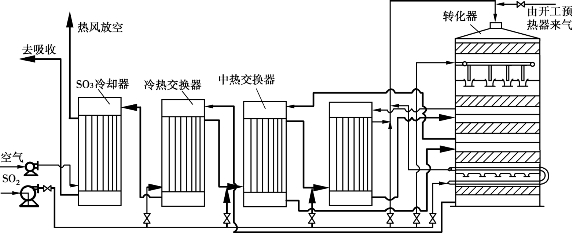
图3.19 一段炉气冷激四段换热转化流程
3)两次转化两次吸收流程
前面讨论的一次转化一次吸收工艺,最佳的最终转化率是97.5%~98%。如果要得到更高的转化率,转化段数要增加很多,这是不经济的。如将尾气直接排入大气,将造成严重污染,采用两次转化两次吸收工艺就能很好地解决上述问题。两次转化两次吸收流程有以下的特点:
①反应速度快,最终转化率高。一次转化后SO3被吸收,再次转化时,减少了逆反应,提高了总反应速率,同时剩余气中n(O2)与n(SO2)比值增大,提高了平衡转化率。
②采用较高体积分数的SO2炉气。中间吸收除去了反应产物SO3,使两次转化可以采用较高体积分数的SO2炉气。对硫铁矿炉气来说,一次转化常用7.5%~8.0%,两次转化常用9.0%~9.5%。但体积分数更高时,炉气中氧含量降低,限制了最终转化率,如炉气含w(SO2)=10%时,最终转化率最高可达99.5%。
③减轻尾气污染。两次转化的尾气中SO2体积分数小于500×10-6,操作正常时只有100×10-6~200×10-6,可用高烟囱排空。两次转化流程虽然投资比一次转化稍高,但若考虑尾气处理在内,成本与一次转化是相近的。
④热量平衡。两次转化两次吸收流程的关键是保持热量平衡。由于增加了中间吸收过程,气体要再一次从100℃左右升到420℃左右,要用较多的换热面积才能满足热平衡的要求。SO2体积分数为7.5%的炉气一次转化所需的换热面积为1,不同SO2体积分数的炉气两次转化所需的换热面积为:
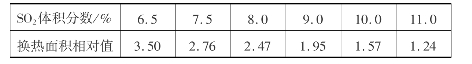
⑤两次转化两次吸收因增加中间吸收和换热器,气流阻力增加,鼓风机压力增大,动力消耗也增加。
两次转化有10多种流程,用得较多的是四段转化,分为(2+2)和(3+1)流程。(2+2)是指炉气经二段转化后进行中间吸收,再经二段转化后第二次吸收。(2+2)流程的转化率在相同条件下比(3+1)流程的稍高一些,因为SO3较早被吸收掉,有利于反应平衡和加快反应速率。(3+1)流程则在换热方面较易配置。我国用得较多的一种(3+1)两次转化两次吸收流程如图3.20所示。炉气依次经过Ⅲ段出口的热交换器和Ⅰ段出口的热交换器后送去转化,经中间吸收,气体再顺序经过Ⅳ段和Ⅱ段换热器后送去第二次转化。二次转化气经Ⅳ段换热器冷却后送去最终吸收。
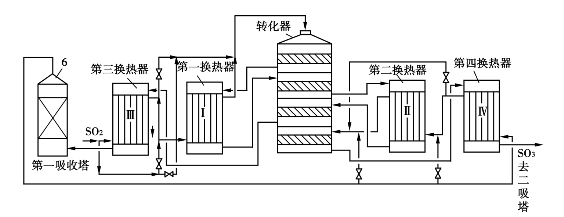
图3.20 ⅢⅠ/ⅣⅡ四段两次转化流程
(3+1)流程有多种换热配置方式,如图3.21所示,可以根据催化剂性能和操作要求来选择,目的是用较少的换热面积,充分利用热能,使过程自然进行。由于Ⅰ段出口气的温度较高,换热量较大,用Ⅰ段换热器预热炉气对开车平稳操作和调节控制是有利的。ⅢⅠ/ⅣⅡ式是我国用得较多的流程。
4)二氧化硫转化器
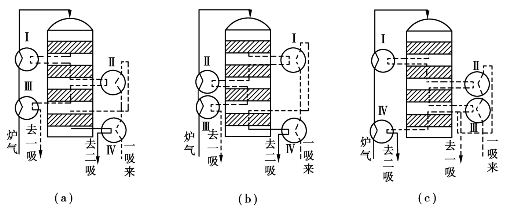
图3.21 (3+1)四段两次转化两次吸收流程的换热配置方式(a)ⅢⅠ/ⅣⅡ式;(b)ⅢⅡ/ⅣⅠ式;(c)ⅣⅠ/ⅢⅡ式
一般设计转化器时,需要考虑下列几个方面:能使转化接近于最适宜温度下进行,以提高催化剂的利用率;转化器的生产能力应尽可能大,以节约材料、投资和用地;气体在转化器内能均匀分布,阻力小,动力消耗低;转化器-换热器组应有足够的换热面,以保证净化后气体能靠反应热而预热到规定温度;转化器内催化剂的装填系数应尽可能大,以提高生产强度;转化器的结构要便于制造、安装、检修和更换催化剂。转化器使用条件如表3.9所示。
表3.9 转化器使用条件

转化器的形式很多,下面举例说明。
图3.22是四段内部间接换热式转化器。转化器壳体由钢板卷焊而成,内衬耐火砖,催化剂分段堆放在钢制的篦子板上,为了防止催化剂漏下,在篦子板上装有铁丝网,铁丝网与催化剂之间放上一层鹅卵石。在第一、二段和第三、四段催化床之间设有换热列管,炉气走管外,与管内的转化气进行换热。第三、四之间因换热量少,所需换热面积也少,换热器为螺旋式。为了测定各段出入口的温度和压力,在各段催化床上下部均装有热电偶,在各段设有测压口。为了使进入转化器的炉气能均匀地分布在催化床的整个截面上,在气体进口处设有气体分布板。为了更换催化剂和检修方便,在各段催化床上方均开有人孔。这种转化器结构紧凑,阻力小,占地面积小,广泛用在日产15~120t硫酸的中小型硫酸生产中。由于受管板的机械强度所限,制作大直径转化器较困难,故限制了单台转化器生产能力的提高。
为了克服这一缺点,苏联将转化器内换热列管改为卧式双程管,如图3.23所示。该转化器有五段催化床,第一、二段间用炉气冷激,第四、五段间用螺旋式换热器间接换热,其余各段均采用卧式双程列管换热。这种转化器结构很复杂,对于大型硫酸生产装置,还是采用多段外部中间换热式转化器较好。
3.1.5 三氧化硫的吸收
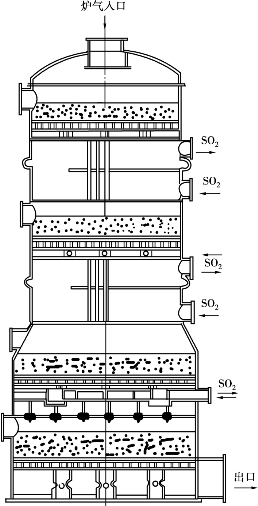
图3.22 中间换热式转化器
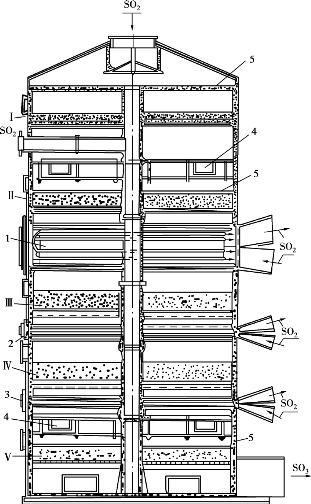
图3.23 第一、二段间炉气冷激的中间换热式转化器
Ⅰ~Ⅴ—催化床;1~3—中间换热器;4—混合器;5—石英层
在硫酸的生产中,SO3是用浓硫酸来吸收的,使SO3溶于硫酸溶液,并与其中的水生成硫酸;或者用含有游离态SO3的发烟硫酸吸收,生成发烟硫酸。这一过程可用下列方程式表示:
![]()
当式中的n>1时,制得发烟硫酸;当n=1时,制得无水硫酸;当n<1时,制得含水硫酸,即硫酸和水的溶液。
接触法生产的商品硫酸通常有92.5%~93%、98%的浓硫酸;含游离SO3体积分数为18.5%~20%的标准发烟硫酸;含游离SO3体积分数为65%的高浓度发烟硫酸,这种高浓度发烟硫酸,近年来在化学工业等部门已得到广泛的应用。
3.1.5.1 发烟硫酸吸收过程的原理和影响因素
吸收系统生产发烟硫酸时,含有SO3的转化气首先送往发烟硫酸吸收塔,用与产品浓度相近的发烟硫酸喷淋吸收SO3。
用发烟硫酸吸收SO3的过程是一个物理吸收过程。在其他条件一定时,吸收速度快慢主要取决于推动力,即气相中SO3的分压与吸收液液面上SO3的平衡分压之差。在气液相进行逆流接触的情况下,吸收过程平均推动力可用下式表示:
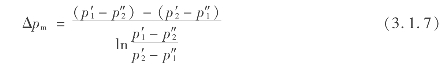
式中 p′1,p″2——分别为进出口气体中SO3的分压,Pa;
p″1,p″2——分别为进出口发烟硫酸液面上SO3的平衡分压,Pa。
当气相中SO3的体积分数和吸收用发烟硫酸浓度一定时,吸收推动力与吸收酸的温度有关。酸温度越高,酸液面上SO3的平衡分压越高,使吸收推动力下降,吸收速率减慢;当吸收酸升高到一定温度时,推动力接近于零,吸收过程无法正常进行。
当气体中SO3体积分数为7%时,不同酸温下所得发烟硫酸的最大浓度如表3.10所示。
表3.10 不同吸收酸温度下,产品发烟硫酸的最大浓度

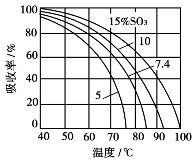
图3.24 用发烟硫酸吸收SO3的吸收率与温度的关系
由表3.10可见,当气体中SO3体积分数为7%时,吸收酸温度超过80℃,将不会获得标准发烟硫酸,吸收过程将停止进行。随着气相中SO3体积分数的提高,在同样条件下,所产生发烟硫酸的浓度也可相应地得到提高。
在一定的吸收酸温度下,气相中SO3体积分数越高,发烟硫酸对SO3的吸收率越高。用SO3的体积分数为20%的发烟硫酸吸收SO3时,气相中三氧化硫的体积分数及吸收酸温度对吸收率的影响可用图3.24的曲线表示。
由图3.24可见,在通常的条件下,用发烟硫酸来吸收SO3时,吸收率是不高的。气相中其余的SO3必须再用浓硫酸吸收。因此,生产发烟硫酸时一般采用两个塔吸收。如果不生产发烟硫酸,全部产品为浓硫酸,则SO3的吸收只需在浓硫酸吸收塔中完成。这是一个伴有化学反应的气液相吸收过程。
3.1.5.2 浓硫酸吸收过程的基本原理和影响因素
在生产中,多采用98.3%的浓硫酸来吸收SO3,SO3与其中的水生成硫酸。在吸收操作中,一般用浓硫酸循环。在循环过程中,由于硫酸浓度不断提高,需要低于98.3%的硫酸和水来稀释,以保持吸收酸的浓度。同时,随着吸收酸量的增加,可不断排出多余部分作为成品酸。
提高SO3的吸收率不但可以提高硫酸产量和硫的利用率,而且吸收后的尾气中SO3减少,对大气污染也小。要提高SO3吸收率,必须选择最适宜的操作条件,其中最重要的是吸收酸的浓度和温度。
(1)吸收酸的浓度
当用浓硫酸吸收SO3时,有下列两种过程同时进行:气相中的SO3被硫酸水溶液吸收后与酸液中的水分结合而生成硫酸;SO3在气相中与硫酸液面上的水蒸气结合生成硫酸蒸汽,使酸液面上的硫酸蒸汽分压增大而超过平衡分压,气相中的硫酸分子便不断进入酸中。
98.3%的浓硫酸是常压下H2 O-H2 SO4体系中的最高恒沸液,具有最低的蒸汽压,它的水汽分压比浓度低的硫酸低,它的SO3和硫酸分压比浓度高的硫酸低。因此,用98.3%的浓硫酸吸收SO3时有较大的推动力,吸收率在逆流操作的情况下可以达到很高。
当吸收酸的浓度低于98.3%时,吸收酸液面上气相中水蒸气分压高,气相中的SO3与水蒸气生成硫酸分子的速度很快,来不及进入液相中。由于酸液面上水蒸气的消耗,酸液中的水分不断蒸发而进入气相,与气相中的SO3生成硫酸分子,结果使气相中硫酸急剧增多,硫酸蒸汽在气相中冷凝成酸雾,而不易被吸收酸所吸收。吸收酸浓度越低,酸液面上水蒸气分压越大,酸雾越容易生成,对气相中的SO3吸收越不完全,即吸收率越低。
当吸收酸浓度高于98.3%时,酸液面上硫酸和SO3蒸汽分压都增大,由于平衡蒸汽分压增大,气相中硫酸和SO3含量增多,SO3的吸收率也会大大降低。因为硫酸和SO3分压高,减少了吸收推动力,使吸收速率降低。因此,用98.3%的硫酸吸收SO3最为有利。
(2)吸收酸温度
吸收酸温度越高,吸收酸液面上总蒸汽压越大,对SO3的吸收越不利。当吸收酸浓度一定时,温度越高,SO3吸收率越低。硫酸生产中,一般将进入吸收塔的吸收酸温度控制在50℃以下,出塔酸的温度则控制在70℃以下。
(3)进塔气温
进塔气温对吸收操作过程也有影响。在一般的吸收操作中,气体温度较低有利于吸收。在吸收SO3时,为了避免生成酸雾,气体温度不能太低,尤其在转化气中水含量较高时,提高吸收塔的进气温度,能有效减少酸雾的生成。表3.11是SO3体积分数为7%的转化气、水蒸气与转化气露点的关系。
表3.11 水蒸气质量浓度与转化气露点的关系
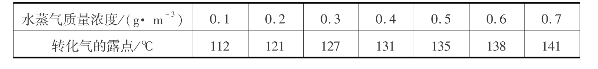
从表3.11中可看出,当炉气干燥到水蒸气含量只有0.1g/m3时,转化气进吸收塔温度必须高于112℃。此外,在两次转化两次吸收工艺中,适当提高第一吸收塔的气体进出口温度,可以减少转化系统的换热面积。
近年来,由于广泛采用两次转化两次吸收工艺,以及节能工艺的需要,吸收工序有提高第一吸收塔进口气温和酸温的趋势,这种工艺对于维护转化系统的热平衡,减少换热面积,节约并回收能量等方面均是有利的。但在工艺条件、设备配置和材料的选择上,也需做一些相应的变更。
3.1.5.3 生产发烟硫酸的吸收流程
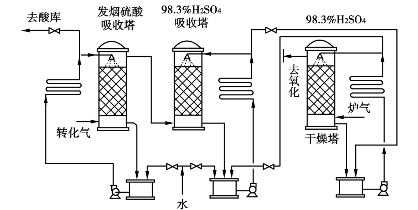
图3.25 制造发烟硫酸和浓硫酸的吸收流程
生产发烟硫酸采用两级吸收流程,如图3.25所示。经冷却的转化气先经过发烟硫酸吸收塔(一塔),再经过浓硫酸吸收塔(二塔),尾气送回收处理系统。发烟硫酸吸收塔喷淋的是含游离SO3体积分数为18.5%~20%的发烟硫酸,喷淋酸温度控制在40~50℃,吸收SO3后浓度和温度均有所升高,经稀释后用螺旋冷却器冷却,以维持循环酸和成品酸的浓度和温度。发烟硫酸的SO3蒸汽压高,只能用98.3%的浓硫酸稀释以减少酸雾的生成。混合后的发烟硫酸一部分作为产品,大部分循环用于吸收。浓硫酸吸收塔用98.3%硫酸喷淋,吸收SO3后用干燥塔来的93%的硫酸混合稀释并冷却,一部分送往发烟硫酸循环槽,一部分送往干燥系统,大部分循环用于吸收,另一部分作为产品抽出。
为有利于发烟硫酸的吸收,进气温度控制较低为70~120℃。虽有一些酸雾生成,因为连续经过两个塔的拦截,有部分酸雾被捕集。
3.1.5.4 生产浓硫酸的吸收流程
我国普遍采用的生产98.3%浓硫酸的吸收流程如图3.26所示。
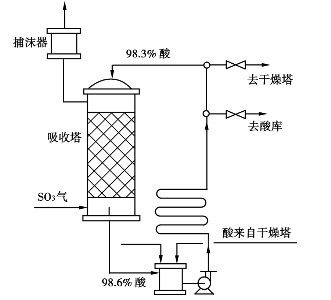
图3.26 生产浓硫酸的泵前吸收流程
催化氧化后的转化气从吸收塔底部进入,98.3%的浓硫酸从塔顶喷淋,气液两相逆流接触三氧化硫被吸收得很完全。进塔气体温度维持在140~160℃,空塔气速为0.5~0.9m/s,吸收在常压下进行。喷淋酸温度控制在50℃以下,出塔酸温度用喷淋量控制,使之小于70℃。吸收塔流出的酸浓度比进塔酸提高0.3%~0.5%,经排管冷却器冷却后送往循环槽,用干燥塔来的变稀硫混合,不足的水分由新鲜水补充,再用酸泵输送,除循环外,部分送往干燥塔,部分抽出作为产品。正常操作时,吸收率可达99.95%。
此流程冷却器位于泵前,称为泵前流程。特点是输送过程中酸的压头小,操作比较安全。冷却器也可以放在泵后,成为泵后流程,酸由泵强制输送通过冷却器,传热效果好,但酸因受压而易泄漏。
3.1.6 废热利用
3.1.6.1 沸腾焙烧的废热
沸腾炉焙烧含硫原料过程中会放出大量的热。由热量衡算可知:每燃烧1kg含硫35%的硫铁矿,可放出热量4521.7kJ,这些热量约40%消耗于炉气、灰渣的加热,其余60%以上的热量即为余热。余热大致分为两部分:一是为维护炉温需导出的部分,约为1.264GJ/t酸;二是导出炉气从850℃降到350~400℃放出的部分,约为1.482GJ/t酸。也就是说,烧1t矿可得到的余热相当于100kg标准煤的发热量。如把它回收利用可得到1.0~1.2t蒸汽。如不把它们利用,须在炉内和炉气出口处设置专门的冷却器移热,这将消耗大量冷却水和电能。由于原料品位、水分和杂质含量不同,以及操作条件(炉温、出口炉气)的不同,在沸腾炉中能得到的余热量有较大差别。表3.12为不同情况下的余热量。
表3.12 不同情况下1kg矿的余热量
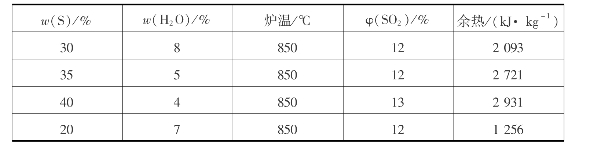
从表3.12中可见,这些余热的回收利用具有很大经济意义。目前国内许多单位已在沸腾炉中配置了废热锅炉,用以回收余热。我国第一座废热铝炉于20世纪60年代初投产,一年利用废热发电达800万度,除满足本身生产需要外,还余1/3以上电力可供输出,装置投资在一年内即可收回。随着我国科学技术的进步,近些年废热利用已很普遍。
3.1.6.2 废热利用方法
为降低硫酸成本,有效回收余热,最有效的方法是利用废热锅炉,进而将余热产生的蒸汽发电。
在废热锅炉推广之前,多数厂采用在沸腾炉上安装间接冷却装置生产热水。由于传热系数不高,冷却面积较大,同时由于冷却水进口温度为常温,排出温度不宜超过60℃(温度高易引起冷却壁结垢),故水耗量及动力消耗均很大。也有厂采用直接喷水的方法控制炉温,此种方法很简便,调节亦十分灵敏,但水气化只把炉内显热转变为潜热,增加了炉气的湿含量,使炉气体积增大,后续净化负荷增大,余热量基本得不到利用。沸腾炉导出的高温炉气如直接进入除尘设备,将会使这些设备很快损坏,所以都采用炉气冷却设备来移热。曾采用过的冷却设备有水夹套、列管式冷却器、水膜冷却器、自然散热式冷却器等。但总的来讲,因炉气冷却器传热效率不高、易损坏,所以耗用钢材多,维修工作量大。
利用废热锅炉串联于工艺流程之中,它既可用来回收余热生产蒸汽,同时也可完成降温除尘的特定工艺作用。因此,这是最有效的余热利用方法。用于制酸的废热锅炉与普通工业锅炉的结构相近,亦是由汽包、炉管和联管3个基本部分组成,只是炉管作为受热元件所处的环境与普通工业锅炉不同。
炉气中硫腐蚀主要为SO3对管件的腐烛。炉气中H2 SO4蒸汽的露点为190~230℃。一旦受热面管壁温度低于气体露点,硫酸蒸汽将凝成液体硫酸而腐蚀管壁金属。要防止低温腐蚀不外乎通过降低炉气露点或提高管壁温度这两种途径。降低炉气中水蒸气含量,尤其是提高焙烧炉出口的SO3的浓度,严格控制焙烧炉气中的氧含量以抑制SO3的生成,可以达到降低露点的目的。为了提高管壁温度,可采用提高锅炉的操作压力,即相应提高蒸汽受热面管内介质的温度,从而使壁温高于炉气露点。经验表明,维持汽包操作压力等于或高于2.45MPa(对应的饱和温度为225℃),基本上可以使蒸发受热面免受低温腐蚀。
目前,我国沸腾炉用的废热锅炉水汽循环方式有自然循环、强制循环和混合循环(即炉气受热管部分用强制循环,沸腾炉内用自然循环,受热管分别置于沸腾炉和炉气烟道内)。
我国到目前为止,各种汽水循环方式的锅炉已形成系列产品,较有代表性的有:DG型自然循环锅炉,混合循环锅炉如F101型和FR型。20世纪80年代以来,中国新建的现代化大型硫铁矿制酸装置都采用水平通道式废热锅炉。在国外,自然循环和强制循环都有采用,但以强制型为多,采用水平通道、炉气横向冲刷受热面较多。具有代表性的锅炉型号有奇鲁型废热锅炉。
3.1.7 三废治理与综合利用
随着工业生产的发展,人们越来越重视环境保护问题,我国于1996年制订了“硫酸排放标准”(见GB 16297—1996)。
在硫酸生产中,有大量废渣、废水、废气产生,简称“三废”。硫铁矿焙烧的废渣主要是氧化铁和残余的硫化铁,以及少量铜、铅、锌、砷和微量元素钴、硒、镓、锗、银、金等的化合物。当矿石中硫的质量分数为25%~35%时,每生产1t硫酸一般要排出0.7~1t的矿渣。大量矿渣不但占用耕地,而且堆放太久将在细菌作用下氧化成为水溶性硫酸铁而污染地层水系。水洗净化流程每生产1t硫酸需排出10~15t污水。污水中除含有硫酸外,还含砷、氟的化合物和其他贵重金属等。生产中的炉气虽然经过转化、吸收,SO2转化为SO3被吸收成为硫酸,但吸收后的尾气中仍含有少量未转化的SO2,其含量随转化率高低而不同,一般在0.3%~0.8%。当吸收率低和吸收塔除沫操作不良时,尾气中还会含有少量SO3和酸雾。
因此,开展综合利用,充分回收原料中的有用成分,使有害物质资源化,是减少硫酸生产有害物排放的主要途径。
3.1.7.1 尾气中有害物的处理
硫酸厂尾气中的有害物主要是SO2、少量的SO3和酸雾。因此,减少尾气中有害物的排放,主要应提高SO2的转化率和SO3的吸收率。采用两次转化两次吸收,使SO2的转化率达到99.75%,就可达到排放标准,这是消除尾气污染的根本措施。
但是,在早期建成的硫酸装置中,绝大多数为一次转化一次吸收流程,其中多数装置目前已建有尾气处理系统。对尾气及含低浓度SO2烟气的处理方法甚多,且各具特色,下面着重介绍应用最广的氨-酸法。
(1)氨-酸法的基本原理
氨-酸法包括吸收、分解、中和三个主要部分。
尾气通入回收塔,与含氨的碱性循环母液逆流接触,尾气中的SO2与母液中的氨或亚硫酸铵作用而被吸收
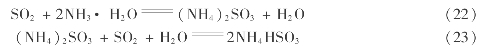
同时,尾气中的O2、少量的SO3以及酸雾,会使溶液发生如下副反应:
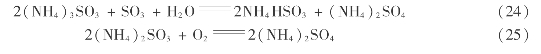
![]()
吸收SO2的有效组分是氨和亚硫酸铵。为了保持操作稳定和节省后继工段硫酸用量,吸收液是循环使用的。随着吸收过程的进行,要补充氨气或氨水,使母液保持一定的碱度,使亚硫酸氢铵转化成亚硫酸铵,这一过程称为再生:
![]()
为保持母液中n[(NH4)2 SO3]/n(NH4 HSO3)的比值稳定,需要不断移出部分母液送分解系统。
吸收后的母液需加浓硫酸分解出SO2回收利用:
![]()
分解生成的SO2有较高纯度,可制造液体SO2或送回制酸系统。硫酸加入量较理论量多30%~50%,以使分解完全。分解后的母液再吹入蒸汽或空气,驱出溶于液相的SO2。用空气吹出的SO2浓度较低,送回制酸系统。
分解液呈酸性,必须通入氨气或加入氨水将过量硫酸中和后才能排放,反应式如下:
![]()
(2)影响回收的因素
25℃用SO2来饱和氨水时,溶液中SO2的平衡质量浓度如表3.13所示。
表3.13 25℃饱和氨水吸收SO2平衡组成

从表3.13中数据表明,进气中SO2浓度很低时,吸收液的SO2质量浓度仍然很高,这是由于SO2与氨反应属于酸碱中和,平衡常数很高的缘故。
图3.27 吸收液组成与SO2回收率的关系
用循环母液吸收尾气时,母液成分对吸收率的影响如图3.27所示。生产时控制母液中n(SO2)∶n(NH3)=0.75~0.85,即n[(NH4)2 SO3]∶n(NH4 HSO3)约为1∶3,pH值在5.5~6.0。此时回收率达90%以上,排空尾气中氨损失0.05~0.2g/m3。多数厂将一段吸收母液中总亚铵盐控制在400kg/m3左右。有些厂采用改进的两段吸收,先用含亚铵盐550kg/m3的母液吸收,再用含亚铵盐100~250kg/m3的母液处理残气,吸收率可从90%提高到98%,排空尾气中SO2降到2.0×10-4以下。
分解温度的影响见表3.14,温度超过80℃,分解率达99%以上。过高的温度使亚硫酸铵分解成硫酸铵和硫代硫酸铵,后者再分解生成元素硫,会堵塞设备。常用的分解温度为80~85℃。
表3.14 饱和氨水吸收SO2后分解温度与分解率的关系

(3)氨-酸法的工艺流程
氨-酸法的工艺流程如图3.28所示。尾气送入回收塔吸收其中的SO2,回收塔有两段,第一段有2~3块塔板使SO2体积分数从2.0×10-3~4.0×10-3降到5.00×10-4;第二段有2块塔板,SO2降到1.00×10-4~2.00×10-4,经过除沫层后排空。各段有单独的母液循环系统,系统中有补充氨的循环槽。
图3.28 氨-酸法处理硫酸尾气流程
多出的浓母液送往高位槽,再流往混合槽,同时流往混合槽的有硫酸高位槽来的硫酸。在混合槽中反应并释放出高浓度的SO2,占总分解出SO2量的60%~80%,送去干燥和加压到0.4~0.8MPa后液化成液体SO2,也可在常压下冷冻到-10℃冷凝成液态。
混合槽中初步分解的母液流入填料分解塔。塔底通入空气将母液中的SO2吹出并送回制酸系统。分解液在中和桶内用氨气中和,溶液含硫铵550~580kg/m3,可直接作为产品。
3.1.7.2 烧渣的综合利用
硫铁矿或硫精矿焙烧后残余大量的烧渣。烧渣除含铁和少量残硫外,还含有一些有色金属和其他物质。沸腾焙烧时得到的烧渣分为两部分:一部分是从炉膛排渣口排出的烧渣,粒度较大,铁品位低,残硫较高,占总烧渣量的30%左右;另一部分是从除尘器卸下的矿尘,粒度细,铁品位较高,残硫较低,有色金属含量也稍高一些。
烧渣和矿灰宜分别利用。它们可用于以下几个主要方面:
①作为建筑材料的配料:代替铁矿石作助溶剂用于水泥生产以增强水泥强度;制矿渣水泥;用硫酸处理并与石灰作用以生产绝热材料;用于生产碳化石灰矿渣砖。用于这些配料的量均不大,如1t水泥约用含铁大于30%的矿渣60kg。
②作为炼铁的原料:1个年产40万t硫酸厂的烧渣如能全部利用,可炼钢10~20万t。就可利用性而言,烧渣含铁量低于40%时,几乎没有作为炼铁原料的利用价值。一般来说,在高炉炼铁时,入炉料的含铁品位提高1%,高炉焦比可降低1.5%~2.5%,生铁产量增加2.6%~3%,因为随入炉料含铁量的增加,脉石量减少,溶剂消耗量降低,燃烧消耗量减少。国外不少厂矿为提高硫铁矿对硫磺的竞争力,将硫铁矿精选到含硫47%~52%,使烧渣达到炼铁精料的要求,降低硫酸成本。
③回收烧渣中的贵重金属:有些硫化矿来自黄金矿山的副产物,经过焙烧制取SO2炉气后,烧渣中金、银等贵金属含量又有所提高,成为提取金银的宝贵原料。
④用来生产氧化铁颜料铁红,制硫酸亚铁,玻璃研磨料,钻探泥浆增重剂。
3.1.7.3 硫酸厂排放液的处理和回收
用硫铁矿焙烧制取SO2原料气时,经常有污酸、污泥和污水的排出。污酸污泥主要来自炉气的酸洗净化系统。污水来自两个方面:一是炉气水洗净化系统排出的大量的洗涤水;二是厂区内冲洗被污染地面的出水。无论是污酸或污水,均含有数量不等的矿尘和有毒物质,其中还包括一些有色金属及稀有元素。必须在排放前进行处理并回收有用元素,使有害物质含量降低到国家规定的排放标准以下。
关于硫酸厂排放污酸污水的处理方法,可根据排出液的成分及当地条件而采用因地制宜的方法。目前常用的有两类:
(1)加入碱性物质的多段中和法
通过加入碱性物质使污酸污水中所含的砷、氟及硫酸根等形成难溶的物质,通过沉淀分离设备使固体矿尘及有毒物质从污酸污水中分离出来。常用的碱性物质有石灰石、石灰乳、电石渣以及其他废碱液。为加速污酸污水中固体物质的沉降,可添加适量凝聚剂,如氢氧化铁、碱式氯化铝、氯化物以及聚丙烯酰胺等。
(2)硫化-中和法
主要用于冶炼烟气制酸系统的污酸处理。冶炼烟气制酸装置排出的稀酸中,常溶有铜、铅、锌、铁以及砷和氟的成分,在中和处理前,先除铅,再经硫化除去铜和砷,然后中和处理,使清液达到排放标准。
3.2 硝 酸
3.2.1 概 述
纯硝酸(100% HNO3)为无色液体,具有窒息性与刺激性,相对密度为1.522,沸点为83.4℃,熔点为-41.5℃,常温下能分解:
![]()
释放出的NO2溶于硝酸而呈黄色。
硝酸能以任意比例溶解于水,并放出稀释热。稀释热可用下式计算:

式中Q——稀释热,J/mol;
m——纯硝酸的物质的量,mol;
n——水与纯硝酸的摩尔比。
工业硝酸分为浓硝酸(96%~98%)和稀硝酸(45%~70%)。浓硝酸的规格见表3.15。
表3.15 浓硝酸标准(GB/T 337.1—2002)
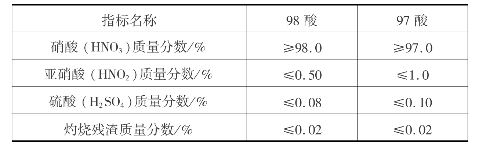
硝酸是氧化性很强的强酸。除金、铂及某些稀有金属外,各种金属皆能与稀硝酸作用生成硝酸盐。“王水”(浓硝酸与盐酸体积比为1∶3的混合液)能溶解金和铂。
硝酸也是重要的基本化学产品,产量在各类酸中仅次于硫酸。硝酸具有广泛的用途:制造化肥,大部分用于生产硝酸铵和硝酸磷肥;制造硝酸盐,如钠、镁、锂、铷等金属的硝酸盐,其中硝酸锂(熔点264℃,分解温度600℃)用作热交换载体,硝酸铷用作制造丁二烯的催化剂;作有机合成原料,浓硝酸可将苯、蒽、萘和其他芳香族化合物硝化制取有机原料;制造草酸,与农作物废料反应制取草酸,或与丙烯、乙烯、乙二醇作用制取草酸;用于军火工业,制取TNT炸药,或精制提取核原料;用于合成香料,硝酸与二甲苯反应制得的二甲苯麝香,广泛用于调配化妆品、皂用及室内用香料;硝酸还用于化学试剂及有色金属酸洗。
目前,工业硝酸皆采用氨氧化法生产。该工艺包括氨的接触氧化、一氧化氮的氧化和氮氧化物的吸收。此工艺可生产浓度为45%~60%的稀硝酸。
3.2.2 稀硝酸生产过程
3.2.2.1 氨的催化氧化制取一氧化氮
1)氨氧化反应
氨和氧可进行下面3个反应:
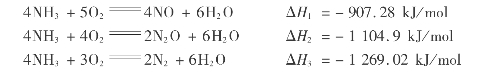
另外,还能发生下列3个反应:
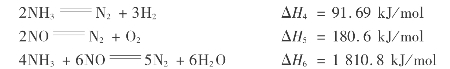
不同温度下,氨氧化和氨分解反应的平衡常数见表3.16。
表3.16 不同温度下氨氧化和氨分解反应的平衡常数(p=0.1MPa)
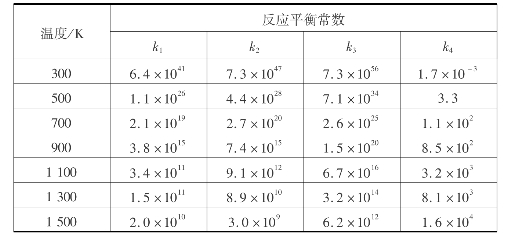
由表3.16可看出,在一定温度下,反应的平衡常数皆很大,可视为不可逆反应。比较平衡常数可得,如果对反应不加控制,氨和氧反应的最终产物必然是氮气。欲得到NO,不能从热力学去改变化学平衡来达到目的,只能从反应动力学方面去着手。即寻找一种选择性催化剂,抑制不希望的反应。目前最好的选择性催化剂是铂。
2)氨氧化催化剂
氨氧化催化剂有两大类:一类是铂系催化剂;另一类是非铂系催化剂。
(1)铂系催化剂
铂系催化剂以金属铂为主体,价格昂贵,催化活性最好,机械性能和化学稳定性良好,易再生,容易点燃,操作方便,在硝酸生产中得到广泛应用。常用的铂系催化剂是铂、铑、钯合金(质量分数分别为铂93%、铑3%、钯4%)。
因铂难以回收,铂系催化剂不用载体。工业上将其做成丝网状。新铂网表面光滑、有弹性,但活性不好,在使用前需要进行“活化”处理,即用氢火焰进行烘烤,使之疏松、粗糙,以增大接触面积。
与其他催化剂一样,铂里的许多杂质都会使其活性降低。空气中的灰尘和氨气中夹带的油污等会覆盖铂的活性表面,造成暂时中毒;硫化氢也会使铂网暂时中毒,尤其是PH3,气体中即使仅含有0.002%,也足以使铂催化剂永久中毒。为保护铂催化剂,预先须对反应气体进行净化处理。即使如此,铂网还是会随着时间的增长而逐渐失活。因此,一般在使用3~6个月后就进行再生处理。再生的方法是将铂网从氧化炉中取出,先浸入质量分数为10%~15%盐酸溶液中,加热到60~70℃,在该温度下保持1~2h,然后将铂网取出用蒸馏水洗涤至水呈中性。再将其干燥并用氢火焰重新活化,活化后活性一般可恢复正常。
铂网在硝酸生产中受到高温及气流的冲刷,表面会发生物理变化,细粒极易被气流带走,造成铂的损失。损失量与温度、压力、网径、气流方向以及接触时间等因素有关。一般认为,温度超过800~900℃,铂的损失会急剧增加。因此,常压下氨氧化时铂网温度一般为800℃,加压时一般为880℃。
铂价格昂贵,目前工业上用数层钯-金捕集网置于铂网之后来回收铂。在750~850℃下被气流带出的铂微粒通过捕集网时,铂被钯置换。铂的回收率与捕集网数、氨氧化操作压力及生产负荷有关。常压下,用一张捕集网可回收60%~70%的铂;加压氧化时,要回收60%~ 70%的铂,需要两张甚至更多张捕集网。
(2)非铂系催化剂
为替代价格昂贵的铂,长期以来,对铁系及钴系催化剂进行了许多研究。因铁系催化剂氧化率不及铂网高,目前难以完全替代铂网,一般是将两者联合使用。国内外对铂网和铁铋相结合的两段催化氧化曾有工业规模的试验,以期达到用适当的非铂催化剂代替部分铂的目的。但实践表明,由于技术及经济上的原因,节省的铂费用往往抵消不了由于氧化率低造成的氨消耗,因此非铂催化剂未能在工业上大规模应用。
非铂催化剂价廉易得,新制备的非铂催化剂活性往往也较高,所以研制这类新催化剂仍是很有前景的。
3)氨催化氧化反应动力学
一般来讲,氨氧化过程与其他气-固催化反应过程一样,包括:反应物的分子从气相主体扩散到催化剂表面;在表面上被吸附并进行化学反应;反应产物从催化剂表面解吸并扩散到气相主体等步骤。有人认为反应机理是:
①铂吸附氧的能力极强,吸附的氧分子发生原子间的键断裂。
②铂催化剂表面从气体中吸附氨分子,随之氨分子中氮和氢原子分别与氧原子结合。
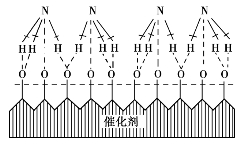
图3.29 铂催化剂表面生成NO的图解
③在铂催化剂活性中心进行电子重排,生成一氧化氮和水蒸气。
④铂催化剂对一氧化氮和水蒸气吸附能力较弱,因此它们会离开铂催化剂表面进入气相。
在铂催化剂上氨氧化生成NO的机理如图3.29所示。
氨向铂催化剂表面扩散过程最慢,是整个氧化过程的控制步骤。诸多学者认为,氨氧化的反应速度受外扩散控制,对此,M.N.捷姆金导出了800~900℃在Pt-Rh网上氨氧化反应的动力学方程为:
![]()
式中 c0——氨空气混合气中氨的体积分数,%;
c1——通过铂网后氮氧化物气体中氨的体积分数,%;
S——铂网的比表面积,即活性表面积/铂网截面积;
m——铂网层数;
d——铂丝直径,cm;
V0——标准状态下的气体流量,L/(h·cm2)。
4)氨氧化工艺条件的选择
选择氨氧化工艺条件时,考虑的主要因素有:氨氧化率、生产强度和铂损失。
(1)温度
温度越高,催化剂的活性也越高。生产实践证明,要达到96%以上的氨氧化率,温度不得低于780℃。然而,温度太高(超过920℃时),铂的损失剧增,且副反应加剧。常压下氨氧化温度取780~840℃。压力增高时,操作温度可相应提高,但不应超过900℃。
(2)压力
氨氧化反应实际上可视为不可逆反应,压力对于NO产率影响不大,但加压有助于反应速度的提高。尽管加压(如0.8~1.0MPa)导致氨氧化率有所降低,但反应速度的提高可使催化剂的生产强度增大,节省NO氧化和NO2吸收所用的昂贵不锈钢设备。生产中究竟采用常压还是加压操作,应视具体条件而定。一般加压氧化采用0.3~0.5MPa,也有采用综合法流程,即氨氧化采用常压,NO2吸收采用加压,以兼顾两者之优点。
(3)接触时间
接触时间应适当。时间太短,氨来不及氧化,使氧化率降低;时间太长,氨在铂网前高温区停留过久,容易被分解为氮气,也会降低氨氧化率。
考虑到铂网的弯曲因素,接触时间可由下式计算:
式中 pk——操作压力;
![]()
Tk——操作温度;
f——铂网自由空间体积分数。
其余符号意义同动力学方程。
铂网规格一定,接触时间与网数成正比,与气量成反比。
为避免氨过早氧化,常压下气体在接触网区内的流速不低于0.3m/s。加压操作时,由于反应温度较高,宜采用大于常压时的气速,但最佳接触时间一般不因压力而改变。故加压时增加网数的原因就在于此。
另外,催化剂的生产强度与接触时间有关,即
![]()
在其他条件一定时,铂催化剂的生产强度与接触时间成反比(即与气流速度成正比)。从提高设备的生产能力考虑,宜采用较大的气速。此时氧化率比最佳气速时稍有减小,但总的经济效果是有利的。
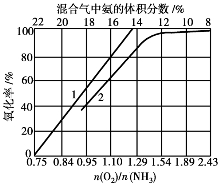
图3.30 900℃时,氧化率与催化剂生产强度、混合气中氨的体积分数的关系
在900℃及n(O2)/n(NH3)=2的条件下,不同初始氨质量浓度c0时,氨的氧化率与生产强度的关系见图3.30。由图可看出,对应于某一个氨质量浓度c0,有一个氧化率最大时的催化剂生产强度A。工业上选取的生产强度一般稍大些,多控制在600~800kg/(m2·d)。如果催化剂选用Pt-Rh-Pd三元合金,催化剂的生产强度可达900~1000kg/(m2· d),氨氧化率可保证在98.5%左右。
(4)混合气体组成
氨氧化的混合气中,氧和氨比值[v=n(O2)/ n(NH3)]是影响氨氧化率的重要因素之一。增加混合气中氧的体积分数,有利于增加氨氧化率;增加混合气中的氨的体积分数,则可提高铂催化剂的生产强度。硝酸制造过程除氨氧化需氧外,后工序NO氧化仍需要氧气。在选择v时,还要考虑NO氧化所需的氧量。为此,需考虑总反应式:
![]()
当v=n(O2)/n(NH3)=2,配制v=2的氨空气混合气,假设氨为1mol,则氨的体积分数可由下式算出:
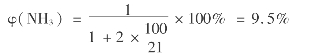
因此,氨氧化时,若氨的体积分数超过9.5%,后工序NO氧化时必须补加二次空气。氧氨比在1.7~2.0时,对于保证较高的氨氧化率是适宜的。为提高生产能力,一般均采用较9.5%更高的氨的体积分数,通常加入纯氧配成氨一富氧空气混合物。必须注意,氨在混合气中的含量不得超过12.5%,否则便有发生爆炸的危险。若加入一些水蒸气,可以降低爆炸的可能性,从而可适当提高NH3和氧的体积分数。
(5)爆炸及其预防措施
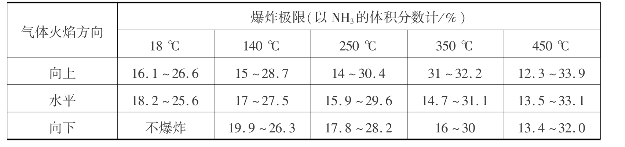
氨-空气混合气中,一定浓度的氨一旦遇到火源便会引起爆炸,爆炸极限与混合气体的温度、压力、氧的体积分数、气体流向、容器的散热速度等因素有关。当气体的温度、压力及氧的体积分数增高,气体自下而上通过,容器散热速度减小时,爆炸极限变宽;反之,则不易发生爆炸。氨-空气混合气的爆炸极限如表3.17所示。
表3.17 氨-空气混合物的爆炸极限
氨-氧气-氮气混合气的爆炸极限参见表3.18。
表3.18 氨-氧气-氮气混合气的爆炸极限
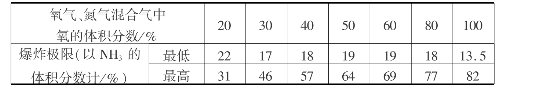
为保证生产安全,防止爆炸,在设计和生产中要采取必要的措施,严格控制操作条件,使气流均匀通过铂网,合理设计接触氧化设备或添加水蒸气,并避免引爆物存在。
5)氨催化氧化工艺流程及反应器
常压下氨的催化氧化工艺流程如图3.31所示。
空气由净化器顶部进入,来自气冷器的水从净化器顶部向下喷淋,形成栅状水幕与空气逆流接触,除去空气中部分机械杂质和一些可溶性气体。然后进入袋式过滤器,进一步净化后送入鼓风机前气体混合器。来自气柜的氨经氨过滤器除去油类和机械杂质后,在混合器中与空气混合,送入混合器预热到70~90℃,然后进入纸板过滤器进行最后的精细过滤。过滤后的气体进入氧化炉,通过790~820℃的铂网,氨氧化为NO气体。
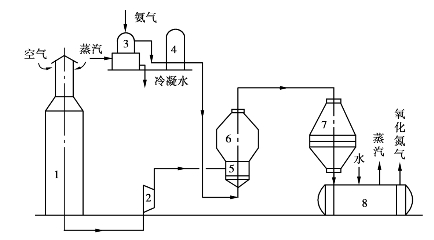
图3.31 氨氧化部分工艺流程
1—空气净化器;2—空气鼓风机;3—氨蒸发器;4—氨过滤器;
5—混合器;6—纸板过滤器;7—氧化炉;8—废热锅炉
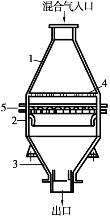
图3.32 氨氧化炉
1—上锥体;2—中部圆筒;
3—下锥体;4—花板;5—铂网
高温反应后的气体进入废热锅炉,逐步冷却到170~190℃,然后进入混合预热器,继续降温到110℃,进入气体冷却器,再冷却到40~55℃后进入透平机。
气体通过冷却器时,随着部分水蒸气被冷凝,同时与部分氮化物反应,出冷却塔会生成质量分数为10%左右的稀硝酸,此冷凝酸送回循环槽以备利用。
氨催化氧化的主要设备是氨氧化炉。氨氧化炉的构造如图3.32所示。它是由两个锥体1,3和一段圆柱体2所组成。上锥体与中部圆柱体为不锈钢,底部锥体为碳钢,内衬耐火砖。上锥体与圆柱体之间设有花板4,板上钻有小孔,用于分散气体,使之均匀。下锥体与圆柱体之间有数层铂网5,安装在不锈钢的支架上。铂网以上的圆筒四周设有4个镶有云母片的视孔。此外,还设有点火孔、取样器,铂网以下的圆筒体内设有热电偶温度计。
混合气由氧化炉上部进入,硝化气(含有NO及NO2,N2 O3,N2 O4等氮氧化物的气体称为硝化气)从炉下部引出。这与过去由炉下部进气不同,它可避免由下部进气而引起的铂网震动。
为更加有效地利用氨氧化的反应热,现行工艺中出现了将氨氧化炉与废热锅炉组合成一个整体的装置(图3.33)。
3.2.2.2 一氧化氮的氧化
只有NO2才能被水吸收制得硝酸。NO的氧化反应如下:
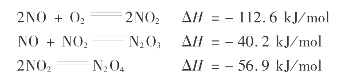
NO是无色气体,微溶于水。NO2是棕红色气体,与水生成硝酸,气态的NO2在低温下会部分迭合成无色的N2 O4,在常压下21.5℃时冷凝变成液体,到-10.8℃时变成固体。常温下N2 O3容易分解成NO和NO2。氮的氧化物有毒,规定每立方米空气中不能超过5mg。
上述3个反应都是分子数减少的可逆放热反应,降温加压有利于NO氧化反应的进行。NO和NO2生成N2 O3在0.1s内便可达到平衡;NO2迭合成N2 O4更快,在10-4 s内便可达到平衡。
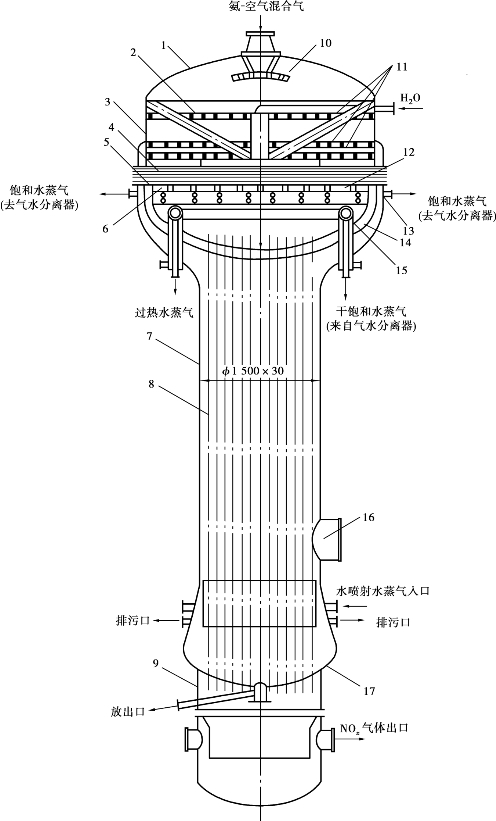
图3.33 大型氨氧化炉-废热锅炉联合机组结构图
1—氧化炉炉头;2—铝环;3—不锈钢环;4—铂-铑-钯网;5—纯铂网;6—石英管托网架;
7—换热器;8—列管; 9—底;10—气体分布板; 11—花板;12—蒸汽加热器(过热器);
13—法兰;14—隔热层;15—上管板(凹形);16—人孔; 17—下管板(凹形)
NO氧化成NO2是硝酸生产中重要的反应之一,与其他反应比较,是最慢的一个反应,因此NO氧化为NO2的反应就决定了全过程进行的速度。
在NO2用水吸收生成HNO3的过程中,还能放出NO,所以在吸收过程也需考虑NO的氧化反应。如何提高NO的氧化度,以及提高NO氧化的速度是硝酸生产中很重要的一个问题。
1)一氧化氮氧化反应的化学平衡
气相中,NO,NO2,N2 O3,N2 O4及O2等达到平衡,它们的平衡组成应满足下面3个公式:
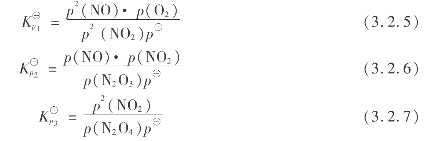
平衡常数 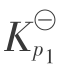 与温度的关系用下式表示:
与温度的关系用下式表示:
![]()
将式(3.2.8)计算值和实验值列于表3.19。
表3.19 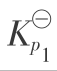 的计算值与实验值
的计算值与实验值

由表3.19可见,温度低于225.9℃时,NO氧化反应可以认为是不可逆的,只要控制在较低温度,NO几乎全部氧化成NO2。在常压下温度低于100℃或0.5MPa温度低于200℃时,氧化度α(NO)都几乎为1。当温度高于800℃时,α(NO)接近于0,即NO2几乎完全分解为NO及O2。
生成N2 O4和N2 O3的反应速度通常都极快。只要在氮氧化物气体中有NO2就可以认为总会有N2 O3及N2 O4存在,其量与平衡含量相当。从平衡条件下计算的结果,与N2 O4含量相比,仅有很少一部分是以N2 O3形式存在。因此,在实际生产条件下可以忽略N2 O3对NO2和N2 O4的影响。
在低温下会有更多的NO2叠合成N2 O4,达到平衡时,混合物组成可由平衡常数Kp3求得。Kp3与温度的关系是:
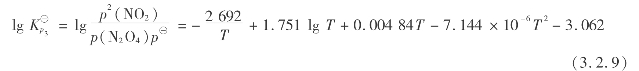
2)一氧化氮氧化的反应速度
根据实验,NO氧化为NO2的反应速度方程式可表示为:
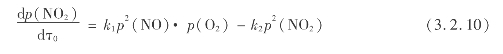
式中 k1,k2——正、逆反应速度常数。
工业生产中,温度均低于200℃,故NO的氧化实际上是不可逆的,上式可改写为:
![]()
对NO氧化反应来说,k与温度的关系不符合阿累尼乌斯公式,即温度升高会使过程减慢,这是一个反常的反应。
若已知初始浓度和总压,可积分上式得出反应时间关系式:
![]()
式中 a——NO的起始浓度,摩尔分数;
b——O2的起始浓度,摩尔分数;
p——总压力,0.1MPa;K=2k; r=b/a。
以Ka2 p2τ为横坐标,α(NO)为纵坐标, r为参变数作图可得出计算氧化时间τ的较方便的算图,如图3.34所示。
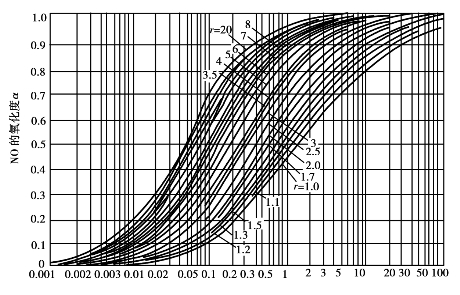
图3.34 氧化时间算图
由图3.34可得以下结论:
①随着α(NO2)的增大,所需氧化时间的增长并非等速,α(NO)较小时,τ增加较少;α(NO)较大时,τ增加很多,说明要使NO完全氧化,需要很长时间。
②当其他条件不变而改变压力时,压力对K影响不大,故τ近似地与p2成反比。压力增加时,所需时间减少很多,故加压可以大大加速氧化速度。
③当其他条件不变而改变温度时,温度降低,K增加。但α(NO)和r一定时,Ka2 p2τ不变,故τ降低。所以从加快反应速度来看,降低温度是有利的。
但必须指出,在用水吸收氮氧化物的过程中会放出NO,NO还要继续氧化及转化成硝酸,在吸收以前将NO全部氧化成NO2是没有必要的,通常只氧化到一定程度(如70%~80%)即可。
3)一氧化氮氧化的工艺过程
从上面讨论可知,加压、低温和适宜的气体浓度有利于NO氧化,同时也有利于吸收。
氮氧化物在氨氧化时经过余热回收,可冷至200℃左右。在温度下降的过程中,NO就会不断氧化,而气体中的水蒸气达到露点后就开始冷凝下来,从而就有一部分NO和NO2溶解在水中,成了稀硝酸,这就降低了气体中所含氧化物的浓度,不利于以后的吸收操作。
为了解决这个问题,氮氧化物气体必须很快冷却下来,使其中水分尽快冷凝,NO尽量少氧化成NO2。如果NO2浓度不高,溶解在水中的氮氧化物量也就较少了。这个过程是在所谓快速冷却设备中进行的,对冷却器的选择应是传热系数大的高效设备,以实现短时间完成气体冷却和水蒸气的冷凝。快速冷却设备有淋洒排管式、列管式和鼓泡式冷却器等。
经快速冷却后的气体,其中水分已大部分除去。此时,就可以使NO充分进行氧化。通常是在气相或液相中进行,习惯上可分干法氧化和湿法氧化两种。
干法氧化是将气体通过一个氧化塔,使气体在里面充分地停留,从而达到氧化的目的。氧化可在室温下操作,也可以采取冷却措施,以排除氧化时放出的热量。
湿法氧化是将气体通入塔内,塔中用较浓的硝酸喷淋。这时使NO氧化的原因有二:
①NO与O2在气相空间、液相内以及气液相界面上进行氧化,大量喷淋酸可以移走氧化时放出的热量,而且由于液相氧化而加速了反应。
②基于吸收过程的逆反应
![]()
在温度、浓度一定的条件下,气相中的NO会被HNO3氧化成NO2。
当气体中NO的氧化度达到70%~80%时,即可进行吸收制酸操作。
3.2.2.3 氮氧化物气体的吸收
氮氧化物气体中除了一氧化氮外,其他的氮氧化物都能按下列各式与水互相作用:
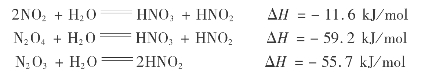
实际上,氮氧化物气体中N2 O3含量极少,因此在吸收过程中所占比重不大,可以忽略。亚硝酸只在温度低于0℃和浓度极小时才稳定,所以在工业生产条件下,它会迅速分解。
![]()
因此,用水吸收氮氧化物的总反应式可概括如下:
![]()
可见,被水吸收NO2的总数中只有2/3生成硝酸,还有1/3又变成NO,要使这一部分NO也变成硝酸,必须继续将其氧化成NO2。在第二个循环被吸收时,又只有其中的2/3被吸收,其中1/3又变为NO。所以,要使1mol NO完全转化为HNO3,实际上在整个过程中氧化的NO量不是1mol,而是1mol+1/3mol+(1/3)2 mol+(1/3)3 mol+…=1.5mol。
由于含氮氧化物气体用水吸收时,整个塔内是NO2吸收和NO再氧化同时进行的,这样就使整个过程变得更加复杂起来。
1)吸收反应平衡和平衡浓度
上面水吸收氮氧化物的总反应为放热、分子数减少的可逆反应。从热力学看,降低温度、增高压力对平衡有利。为了测定及计算方便起见,把平衡常数分成两个系数来研究:
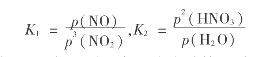
图3.35 lg K1与温度及硝酸质量分数的关系
平衡常数只与温度有关,而K1与K2除了与温度有关外,还与溶液中酸含量有关。酸浓度改变时,K1与K2均要变化。图3.35为系数K1与温度的关系。
由图3.35可以看出,温度越低,K1值越大;硝酸浓度越低,K1值也越大。若K1为定值,则温度越低,酸浓度越大。因此,只有在较低温度下才能获得较浓硝酸。K2值与温度及硝酸浓度间的关系和K1值相反,温度越高K2值越大。
虽然低浓度硝酸有利于吸收,但是生产中要考虑吸收速度的大小。如果用大量低浓度硝酸来吸收氮氧化物,即使吸收完全,得到产品酸的浓度也很低。而当硝酸质量分数>60%时, lg K1<1,吸收几乎不能进行,反应向逆反应方向进行。
综上所述,从化学平衡角度来看,用硝酸水溶液吸收氮氧化物气体,成品酸所能达到的质量分数有一定的限制,常压法不超过50%,加压法最高可制得质量分数为70%的HNO3。
从吸收的平衡浓度来研究,当硝酸的质量分数65%时,几乎不再吸收。所以在常压、常温下操作时很不容易获得比65%更浓的硝酸,一般不会超过50%。要想提高硝酸浓度,就必须降温或加压,而以加压更为显著。
2)氮氧化物吸收速度问题
综上所述,在吸收塔内用水吸收氮氧化物时,反应可表示为:
![]()
以水吸收氮氧化物是一个非均相的气液反应,它由一系列依次进行的步骤组成:首先是气相中二氧化氮和四氧化二氮通过气膜和液膜向液相扩散;其次是液相中NO2和N2 O4与水作用生成硝酸与亚硝酸;而后亚硝酸分解成硝酸及NO;最后是NO从液相向气相扩散。
在这些步骤中后两步的速度较快,研究表明液相中氮氧化物与水反应是整个速度的控制步骤。由于二氧化氮和四氧化二氮在气相中很快达到平衡,控制步骤是N2 O4而不是NO2和水的反应。
从NO的氧化速度讲,在一定温度及压力下,它与氮氧化物气体中NO及O2的浓度成正比。
在吸收系统的前部,气体中氮氧化物的浓度较高,吸收用的硝酸浓度也较高,所以NO的氧化速度大于NO2的吸收速度。到吸收系统的后部,气体中氮氧化物的氧化速度较低,吸收用的硝酸浓度也较低,此时NO2的吸收速度大于NO的氧化速度。只是在吸收系统中部,两个反应的速度都必须考虑。
加压操作吸收时,现在多采用筛板塔,在泡沫状态下能使NO在液相中进行激烈的氧化,使酸吸收所需的设备容积大大减少。常压操作吸收时都用填料塔,同时进行吸收及氧化反应。
3)氮氧化物吸收条件的选择
吸收工段的任务是将气体中的氮氧化物用水吸收成为硝酸。要求生产的硝酸浓度尽可能高,总吸收度尽可能大。
总吸收度指气体中被吸收的氮氧化物总量与进入吸收系统的气体中氮氧化物总量之比。
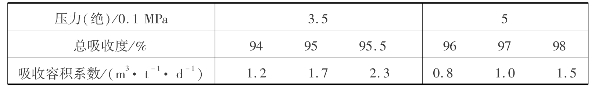
产品酸浓度越高,吸收容积系数(m3·t-1·d-1)(即每昼夜1t100% HNO3所需要的吸收容积)越大。常压吸收操作的参考数据如表3.20所示。
表3.20 常压吸收操作产品酸的浓度与吸收容积系数的关系

在温度和产品浓度一定时,总吸收度越大,则吸收容积系数越大。因而吸收塔尺寸与造价越大,操作费用也越大。加快反应速度、尽可能减少吸收容积系数,是选择吸收过程操作条件的基本原则。
(1)温度
降低温度,平衡向生成硝酸的方向移动。同时,NO的氧化速度也随温度的降低而加快。在常压下,总吸收度为92%时,若以温度30℃的吸收容积作为1,则5℃时只有0.23,而40℃时高达1.50。所以无论从提高成品酸的浓度,还是从提高吸收设备的生产强度,降低温度都是有利的。
由于NO2的吸收和NO的氧化都是放热反应,每生成1t硝酸需除去大约4.18GJ热量。过去都是用水降温,吸收温度多维持在20~35℃。若用冷冻盐水来移走热量,可使操作温度降到0℃以下。
(2)压力
提高压力,不仅可使平衡向生成硝酸反应的方向移动,可制得更浓的成品酸,同时对硝酸生成的速度有很大的影响。这是因为NO在气相中所需氧化空间几乎与压力的三次方成反比。所以加压可大大减少吸收体积。
表3.21是当温度为37℃时,两个不同压力下,每昼夜制造1t硝酸(100% HNO3)不同总吸收度所需的吸收反应容积。
适宜吸收压力的选择,需视吸收塔、压缩机、尾气膨胀机的价值、电能的消耗、对成品酸浓度的要求等一系列因素而定。
表3.21 不同压力时,总吸收应与吸收容积系数的关系
目前实际生产上除采用常压操作外,加压的有用0.07,0.35,0.4,0.5,0.7,0.9MPa等压力,这是因为吸收过程在稍微加压下操作已有相当显著的效果。
(3)气体组成
主要指气体混合物中氮的氧化物的浓度和氧的浓度。
由吸收反应平衡的讨论可知,使产品酸浓度提高的措施之一是提高NO2的浓度或提高氧化度α(NO)。其关系如下式:
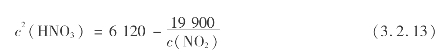
式中 c(HNO3)——成品酸浓度(55%~60%);
c(NO2)——氮氧化物浓度。
增加c(NO2),可提高c(HNO3)。为了保证进吸收塔气体的氧化度,气体在进入吸收塔之前必须经过充分氧化。
气体进入吸收塔的位置对吸收过程也有影响。因为气体冷却器出口的气体温度在40~45℃。由于在管道中NO继续氧化,实际上进入第一塔塔底的温度可升高到60~80℃。若气体中尚有较多的NO未氧化为NO2而温度又较高时,氮氧化物遇到浓度为45%左右的硝酸有可能不吸收,反而使硝酸分解。这种情况下,第一塔只起氧化作用,气体中的水蒸气冷凝而生成少量的硝酸。整个吸收系统的吸收容积有所减少,影响了吸收效率。此时生产成品酸的部位会后移到第二塔。
为使第一塔(在常压下)出成品酸,可将气体从第一塔顶加入。当气体自上而下流过第一塔时,在塔上半部可能继续进行氧化,而在塔下半部则被吸收。这样,成品酸就可以从第一塔导出,而且提高了吸收效率。实践证明该措施是有效的。
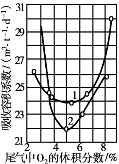
图3.36 六塔系统中,吸收容积与二次空气加入量的关系
1—所有空气从一塔加入;
2—空气加入每一塔中
当氨-空气混合气中氨的浓度达到9.5%以上时,在吸收部分就必须加大二次空气。实际上在吸收时,NO氧化和NO2吸收同时进行,以至问题较复杂,很难从计算中确定出最适宜的氧含量。通常是控制吸收以后尾气中的氧的体积分数,一般在3%~5%。尾气中氧的体积分数太高,表示前面加入二次空气量太多,反而将氮氧化物稀释,且处理气量大,阻力过高;太低时,表示所加二次空气量不足,也不利于氧化。这样都能影响到吸收体积,其关系如图3.36所示。此外,从图3.36还可看出,吸收容积系数和二次空气的加入方式也有关系,曲线1表示在第一塔一次加入;曲线2表示在各塔分几次加入。最适宜的尾气中氧浓度前者约为5.5%,后者约为5.2%。如果尾气中氧浓度较低(<4%),曲线1的V吸较小,故一次加入较好。若尾气中氧浓度较高(>4%),则曲线2的V吸较小,因而分批加入为佳。
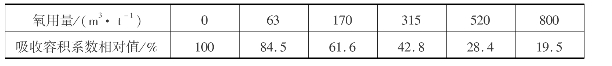
若在氨催化氧化时采用纯氧或富氧空气,则不仅能提高NH3的氧化率,对吸收部分也是很有利的。采用氧量越多,则吸收容积系数就越小,如表3.22所示。
表3.22 吸收容积系数与氧用量的关系
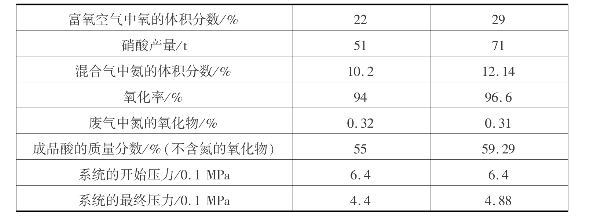
如在加压下同时用富氧空气,则生产效能更高。由表3.23可见,当氧用量增加时,混合气体中氧含量、氧化率、成品酸产量以及浓度都随之提高。
表3.23 利用富氧空气时操作条件的比较
4)吸收流程
吸收设备应能保证气液两相充分地接触和NO的氧化与NO2吸收两个过程同时迅速进行。
(1)常压下的填料塔
常压吸收都用多塔,为了移走吸收过程的反应热及保证一定的吸收效率,应该有足够的循环酸,一般采取5~7塔操作。塔数与吸收容积系数、能量消耗关系如表3.24所示。
表3.24 不同塔数下的某些技术经济指标
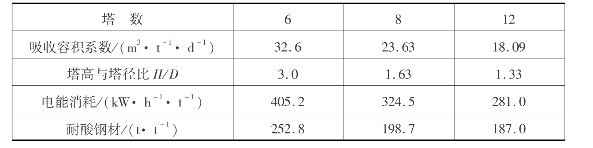
对填料的基本要求是既要具有大的自由空间率,又要有大的比表面。由于前几个吸收塔主要是进行吸收过程,所以应该用比表面大一些的填料;而在后面几个塔中,氧化过程很慢,故采用自由空间大的填料,通常用50mm×50mm×5mm及75mm×75mm×8mm的瓷环。
气体流速太小不利于扩散;太大,则阻力过大。酸的喷淋量取决于能使填料表面充分润湿,又可以导出塔内的反应热。为此,前几个塔内由于放热多,需要的喷淋酸量大于后几个塔。例如第一、二塔取8~10m3/(m2·h),其余各塔取3~5m3/(m2·h)。
气液相的流向并无严格要求。但在硝酸吸收塔中同时进行着吸收和氧化过程,所以并流操作时,气体一边吸收一边继续在氧化,吸收推动力未必低于逆流操作,故一般配置气液流向时,主要以节省气体管道为原则。
(2)常压下氮氧化物吸收流程与成品酸的漂白
常压下,氮氧化物吸收流程为多塔串联吸收。从第一或第二吸收塔引出的成品酸因溶解有氮氧化物而呈黄色。酸浓度越高,溶解越多,如58%~62%的硝酸中可以有2%~4%的氮氧化物。为了减少溶解的氮氧化物的损失,以满足硝酸使用的质量要求,故成品酸未经入库以前,先经“漂白”处理。方法是在漂白塔中通入空气以使溶入的氮氧化物解吸。
此外,在常压吸收时,尾气中含有1%左右的氮氧化物,需要用纯碱溶液加以回收。而在加压吸收时,尾气中氮氧化物的体积分数已减低到0.2%,减少了处理的难度。但尾气压力较高,宜在尾气排入大气前用与压缩机装在同一轴上的膨胀机回收能量,这样可使压缩机的电力消耗减少25%~40%。
3.2.2.4 稀硝酸生产工艺流程
稀硝酸生产流程按操作压力不同分为常压法、加压法及综合法3种流程。衡量某一种工艺流程的优劣,主要决定于技术经济指标和投资费用,具体包括氨耗、铂耗、电耗及冷却水消耗等。上述3种流程的主要技术经济指标如表3.25所示。
表3.25 国内各种硝酸生产方法的技术经济指标
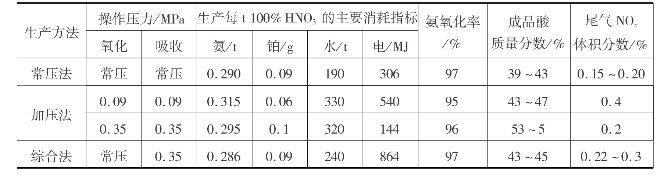
从降低氨耗、提高氨利用率角度来看,综合法具有明显的优势。它兼有常压法和加压法两者的优点。其特点是常压氧化、加压吸收,产品酸质量分数为47%~53%。采用氧化炉和废热锅炉联合装置,设备紧凑,节省管道,热损失小。用带有透平装置的压缩机,降低电能消耗。吸收塔采用泡沫筛板,吸收效率高达98%。图3.37为综合法生产稀硝酸的典型工艺流程。
综合法稀硝酸生产工艺是在常压法与加压法基础上演变发展起来的,20世纪40年代不少国家已拥有这种技术。法国Ugine Kuhlmann综合法稀硝酸生产装置是在常压下氧化, 0.41MPa压力下吸收;而Stamicarbon流程中,氧化是在略带负压的条件下操作,吸收则采用带有格板的填料塔,在0.3~0.45MPa压力下进行。在硝酸生产中,要求进入氨氧化系统的气体杂质含量越低越好,因杂质会降低催化剂活性。所以氨气必须过滤,以除掉其中的油、铁屑等机械物质,空气也要过滤或用富氧膜鼓风。
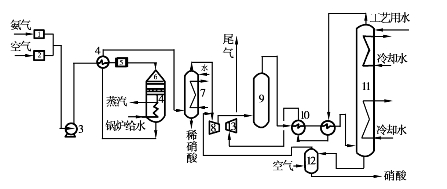
图3.37 综合法硝酸生产示意流程
1—氨过滤器;2—空气过滤器;3—混合气鼓风机;4—混合气预热器;5—过滤器;
6—氧化炉;7—气体冷却洗涤器;8—透平压缩机;9—氧化器;10—尾气预热器;
11—吸收塔;12—漂白塔;13—尾气透平;14—废热锅炉
3.2.3 浓硝酸的生产简介
浓硝酸通常是指几乎无水的硝酸(浓度高于96%)。浓硝酸是国防工业和化学工业的重要原料,广泛用于硝酸磷肥、矿山炸药、化学纤维及高聚物的生产。
浓硝酸制备通常有间接法和直接法。间接法是在稀硝酸中加入脱水剂并经浓缩制成浓硝酸。直接法则是将氮氧化物、氧和水直接合成。另外,尚有采用氨氧化、超共沸生产和精馏的浓硝酸生产方法。
3.2.3.1 由氨直接合成浓硝酸
1)制造浓硝酸的生产过程
由氨为原料直接合成浓硝酸,首先必须制得液态N2 O4,将其按一定比例与水混合,加压通入氧气,按下列反应式合成浓硝酸:
![]()
工艺过程包括以下几个步骤:
(1)氨的接触氧化
生产工艺与稀硝酸相同。
(2)氮氧化物气体的冷却和过量水的排出
以氨为原料用吸收法制造浓硝酸总反应为:
![]()
按该反应式配料只能得到浓度为77.8%的硝酸。为了得到100% HNO3,必须将多余水除去。通常采用快速冷却器除去系统中大部分水,同时减少氮氧化物在水中的溶解损失。然后采用普通冷却器进一步除去水分并将气体降温。
(3)一氧化氮的氧化
一氧化氮氧化分两步进行。首先用空气中的氧将NO氧化,使氧化度达到90%~93%,然后用浓硝酸(98%)进一步氧化,反应如下:
![]()
如果采用加压操作将NO氧化,就不必用浓硝酸,而仅用空气中的氧即可将NO氧化完全。
(4)冷凝生成液态N2 O4
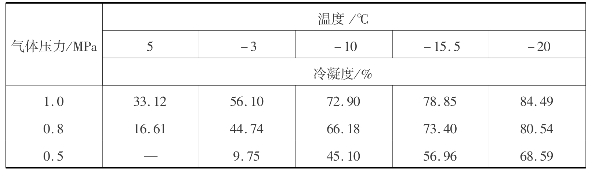
将NO2或N2 O4冷凝便可制得液态N2 O4。温度越低,N2 O4的平衡蒸汽压越小,冷凝就越完全。实际操作一般将冷凝过程分两步进行。首先用水冷却,然后用盐水冷却。盐水温度约-15℃,冷凝温度可达-10℃。低于-10℃时,N2 O4会析出,堵塞管道和设备,恶化操作。
应当指出,用空气将氨氧化得到的氮氧化物最高浓度为11%,分压约11.1kPa。若冷凝温度为-10℃时,液面上N2 O4蒸汽分压为20kPa,此时N2 O4难以液化。为使N2 O4液化,必须提高总压力以提高N2 O4分压,使N2 O4分压超过该条件下的饱和蒸汽压。由表3.26可知,压力越高,N2 O4冷凝程度越大。
在提高N2 O4分压之前,应将氮氧化物气体中的惰性气体(如N2)分离。最好用浓硝酸吸收气体中NO2,以达到上述分离目的,同时得到发烟硝酸。而后将发烟硝酸加热,将其中溶解的NO2解吸出来。此时逸出的NO2浓度近乎为100%。
表3.26 NO2的冷凝度(NO2体积分数为10%)
将发烟硝酸中游离的NO2蒸出是一个普通的二组分蒸馏过程。压力增高,对于从硝酸溶液中分离出高浓度氮氧化物较有利。但加压下沸点升高,设备腐蚀加重,气体泄漏造成损失。综合两者因素,一般在稍减压条件下进行操作。
氮氧化物蒸出的过程是在铝制板式塔或填料塔中进行。含NO2的硝酸溶液被冷却到0℃,由塔顶加入,溶液自上而下受热分解放出氮氧化物,并提高HNO3质量分数。气体由塔顶排出,温度为40℃,含有体积分数为97%~98%的NO2和2%~3%的HNO3。氮氧化物经冷却送入高压反应器,便可得到液态N2 O4。
(5)N2 O4合成硝酸
直接合成浓硝酸的反应包括如下步骤:
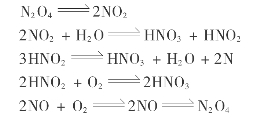
有利于直接合成浓硝酸的条件是:提高操作压力;控制一定的反应温度;采用过量的N2 O4及高纯度的氧,并加以良好的搅拌。
一般工厂采用5MPa的操作压力,若压力再继续提高,影响效果变小,动力消耗剧增。反应温度以65~70℃较合适。
原料配比对反应速度影响甚大,若按理论的比例合成浓硝酸,即使采用很高的压力,反应时间仍需很长。实际生产中一般采用配料比6.82左右,相当于原料中含有25%~30%过剩量的N2 O4。
此外,氧的用量及纯度也十分重要。一般氧的耗用量为理论量的1.5~1.6倍,氧的纯度为98%。若氧的纯度降低,则难以得到纯硝酸。
2)直接合成浓硝酸的工艺流程
直接合成浓硝酸的工艺流程有早期的霍科(Hoko)法,20世纪60年代末出现了考尼亚(Conia)、萨拜(Sabar)、住友(Sumitomo)等法。图3.38为浓硝酸合成的住友法工艺流程,该流程具有下列优点:
①将氮氧化物气体、空气和稀硝酸在0.7~0.9MPa压力和45~65℃下直接合成为85%中等浓度的硝酸,既不用氧化,又省去高压泵和压缩机。
②采用带有搅拌器的釜式反应器,气液反应速度快,节省反应时间。
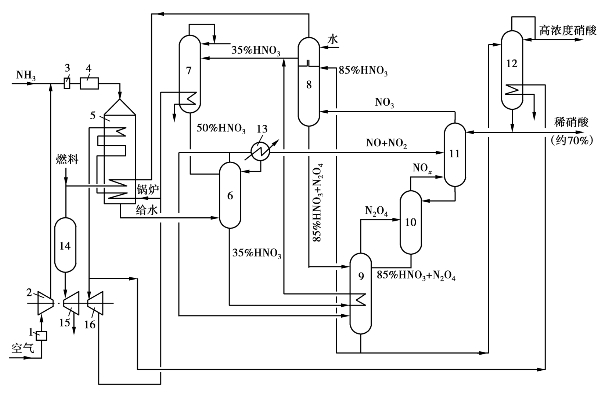
图3.38 住友法浓硝酸和稀硝酸联合生产的工艺流程
1,3—过滤器;2—空气压缩机;4—氨燃烧器;5—废热锅炉;6—分解冷凝塔;
7—稀硝酸精馏塔;8—NO2吸收塔;9—漂白塔;10—反应器;11—尾气吸收塔;
12—浓硝酸精馏塔;13—冷凝器;14—尾气燃烧器;15—尾气透平;16—蒸汽透平
③设有NO2吸收塔,用质量分数为80%~90%硝酸吸收NO2制成发烟硝酸,然后在漂白塔中用空气气提。吸收和气提在同一压力下进行,循环吸收动力消耗低。
④流程中设有分解冷凝塔,将温度为125~150℃的氮氧化物气体与质量分数为50%的HNO3相接触,使稀硝酸分解产生NO和NO2。与此同时,氮氧化物气体中的水分被冷凝,将酸稀释为质量分数为35%的硝酸,送入稀硝酸精馏塔进行提浓。这样既可提高氮氧化物气体浓度,又能除去过量的反应水,达到多产浓硝酸的目的。
3.2.3.2 间接法生产浓硝酸简介
硝酸水溶液质量分数为68.4% HNO3的混合物为恒沸混合物,若采用直接蒸馏法,硝酸质量分数不会大于68.4%。因此由稀硝酸间接生产浓硝酸是借助于脱水剂,通过精馏取得,目前工业上采用的有浓硫酸法和硝酸镁法。
1)浓硫酸法浓缩硝酸
早在1935年中国就用浓硫酸作脱水剂,即将稀硝酸与浓硫酸混合,经蒸馏制取质量分数为97%的HNO3,稀硫酸(72% H2 SO4)供加工为硫酸铵用。工业上为减少硫酸用量,先将稀硝酸浓缩到60%。
美国Chemico开发的NAC/SAC工艺过程如下:经计量的质量分数为60%的HNO3和93% H2 SO4进入填料脱水塔,热量由再沸器供给,将硝酸蒸出,气化的硝酸和呈平衡状态的少量水蒸气从塔顶排出,经冷凝、冷却得98% HNO3产品。72% H2 SO4从塔底部排出,进入第二填料塔经气提脱硝,然后在鼓式浓缩器内与炉气接触而再浓缩至93%,供循环使用。硫酸法浓缩工艺设备腐蚀严重,工业发达国家部分设备采用钽、钛等贵金属。
2)硝酸镁法浓缩硝酸
将浓硝酸镁溶液加入到稀硝酸中,便立即吸收硝酸中的水分,经萃取蒸馏可制取浓硝酸产品。1965年美国Hercules Powder公司首先开发了工业规模的硝酸镁浓缩工艺技术。中国于1964年开发了相近工艺,其过程为:浓缩塔内所需热量由塔底部加热器供给,约50% HNO3与72%~74% Mg(NO3)2分别计量后,进混合分配器,流入提馏段顶部,混合液自上而下与加热蒸出的硝酸蒸汽进行热交换,提馏段顶部出来的115~120℃含有约90% HNO3蒸汽进入精馏段,98% HNO3蒸汽从塔顶逸出,经冷凝、冷却后,一部分作回流液,另一部分为产品。塔底排出的Mg(NO3)2溶液浓度为68%,送蒸发器浓缩到72%~74%返回系统循环使用。
3.2.4 尾气的治理和能量利用
硝酸生产装置中排出的尾气,仍含有一定量带黄色的氮氧化物,通常以NO x表示,环境污染严重,必须加以治理。各国都规定了硝酸尾气中NO x排放标准,以每立方米尾气中含NO x的体积表示,美国、日本规定最大允许为200cm3/m3,法国规定为500cm3/m3,中国规定小于300cm3/m3。
3.2.4.1 催化还原法
以烃类为还原剂进行催化还原反应来降低系统尾气中NO x含量称为催化还原法。如天然气与尾气中NO x进行的反应:
![]()
从吸收塔出来的尾气预热后与天然气相混合,经一段催化反应炉进废热锅炉移去部分热量,再进二段催化反应炉,经废热锅炉回收热量,再进尾气透平膨胀机回收能量放空。德国巴斯夫公司(BASF)的V2 O5/Al2 O3催化剂能代替贵金属钯与铂催化剂,出口气体指标可达:残氨10~20cm3/m3,NO x仅50~150cm3/m3。
为了降低能源消耗,节约基建投资及减少操作费用,20世纪70年代以后开发了选择性催化还原法。此法以氨为还原剂,氨与NO x的反应速度大于氨的氧化速度,当反应温度控制在210~270℃时,通过固定床上的催化剂发生反应,使NO x还原为氮气。
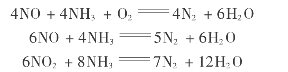
若反应温度低于210℃,易生成亚硝酸铵,有可能引起爆炸,而高于270℃则氨氧化反应呈加快的趋势。中国大庆硝酸装置的尾气治理亦采用此法,其过程为由硝酸吸收塔顶排出的尾气经除雾器、换热器加热后与经预热后的氨气混合后进入催化反应器,尾气通过膨胀透平回收能量放空。
3.2.4.2 溶液吸收法
为降低硝酸装置生产过程中尾气NO x的含量,可采用碱液吸收。工业上通常采用氢氧化钠或碳酸钠溶液治理尾气,并得到硝酸钠与亚硝酸钠副产品:
![]()
![]()
此外,也有采用氨水、碱性高锰酸钾溶液、尿素溶液等吸收的方法。法国G.P.公司采用强化吸收,实质上是提高吸收压力,增加吸收塔塔板块数来强化吸收,使排出吸收塔尾气中NO x直接达到排放标准200cm3/m3。
3.2.4.3 固体吸附法
治理硝酸尾气还可用分子筛、硅胶、活性炭及离子交换树酯等固体物质作吸附剂,将吸附的NO x以硝酸形式回收。但吸附法再生周期短、系统阻力大、操作费用高,大型硝酸装置中较少采用。
3.2.5 硝酸的毒性、安全和贮运
硝酸对人体皮肤会引起严重的烧伤,溅入眼睛尤其危险,氮氧化物和硝酸蒸汽低浓度时会引起呼吸道粘膜刺激症状,如咳嗽等。高浓度时,引起头痛、强烈咳嗽、胸闷,严重者出现肺气肿。因此,工作场所空气中的NO2允许浓度,中国和原苏联规定为0.085mg/m3,美国为0.1mg/m3,德国为0.08mg/m3。
尽管硝酸不燃烧,但它是强氧化剂,与金属粉末、有机物质等发生反应后,有引起燃烧或爆炸的危险。
工厂为了保持硝酸生产的连续进行并随时向外提供商品酸,在厂区需设室内式或半露天式酸库,以防烈日暴晒,宜单层建筑,不宜设在地下室,地面应耐酸腐蚀,电气设备、电线等应有耐酸防腐措施。稀硝酸容器为不锈钢材质,输送稀硝酸采用装有不锈钢罐的槽车;浓硝酸的容器为铝质的,输送浓硝酸采用装有铝罐的槽车。
不慎被浓硝酸灼伤皮肤应立即用大量水或小苏打水清洗并及时送医院救治。
思考题
1.何为发烟硫酸?对98%的硫酸水溶液,若用SO3和H2 O的摩尔分数表示,分别是多少?
2.工业上曾经用过的氧化SO2制硫酸的方法有哪些?写出其主要反应式。
3.可用于生产硫酸的矿石有哪些?各有什么特点?
4.硫铁矿的主要成分是什么?焙烧硫铁矿的主要化学反应有哪些?
5.焙烧硫铁矿的主要副化学反应是什么?有什么危害?
6.焙烧硫铁矿的设备是什么?根据物料状态,设备内可分几个区域?各区域的物料特点是什么?
7.根据焙烧目的,有几种焙烧方式?它们在控制“氧过量”上和主要产物方面有何不同?
8.焙烧过程总体是一个强放热反应,如何利用该热量?
9.焙烧后炉气的净化过程分几步?采用的方法和达到的目的如何?
10.为什么干燥SO2气体采用93%~95%的硫酸?
11.SO2氧化为SO3的反应相态、热效应、反应平衡、催化剂有何特点?
12.有人认为SO2氧化为SO3的气固相催化反应为气液相催化反应,说明这种解释的可能性和传质反应历程。
13.SO2氧化为SO3的温度、压力、SO2含量等工艺条件如何?
14.工业上常用炉气冷激(3+1)的两次吸收过程,请在转化率-温度关系图中表示出反应历程。
15.SO3的吸收过程通常采用发烟硫酸或/和浓硫酸吸收,为什么采用浓度为98.3%的浓硫酸?浓度太高、太低又有什么影响?
16.确定SO3吸收塔操作温度时,主要考虑哪些方面的因素?
17.氨氧化制硝酸的主要反应,其相态、热效应、反应平衡、催化剂等有什么特点?主要副反应有哪些?
18.氨氧化反应制NO的温度、压力、氨含量如何考虑?如果按化学计量配给空气,则氨氧化气体中氨的含量是多少?
19.NO的氧化反应,其相态、热效应、反应平衡、反应速度等有什么特点?
20.NO2吸收制硝酸,通常由40%左右的稀硝酸作吸收剂,吸收的主要化学反应式如何?
21.从NO的氧化反应和NO2的吸收反应特征,描述湿法氧化反应器中的物料变化过程。
22.控制吸收过中的总氮吸收度,主要通过什么手段实现?
23.相对氨氧化一次加入空气,在氨氧化和吸收过程中两次加入空气的优劣性如何?
24.氨催化还原处理尾气中NO x的主要反应是什么?
