8.2.2 煤气化基本原理
2025年09月17日
8.2.2 煤气化基本原理
8.2.2.1 煤气化反应化学平衡
固体燃料的气化有一系列的化学反应,对于主要含碳的固体燃料,其主要反应如下:
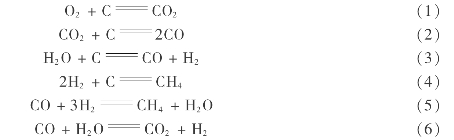
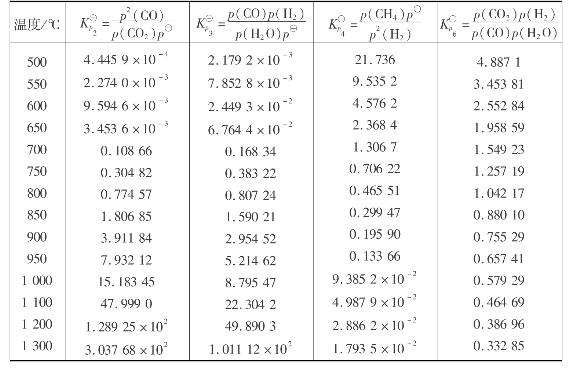
表8.2列出了(2),(3),(4),(6)等气化反应式的平衡常数。
表8.2 气化反应平衡常数
对于化学反应,一般体系都伴有能量变化。表8.3列出了重要的燃烧和气化反应的反应热和平衡常数。
表8.3 燃烧及气化反应热、平衡常数
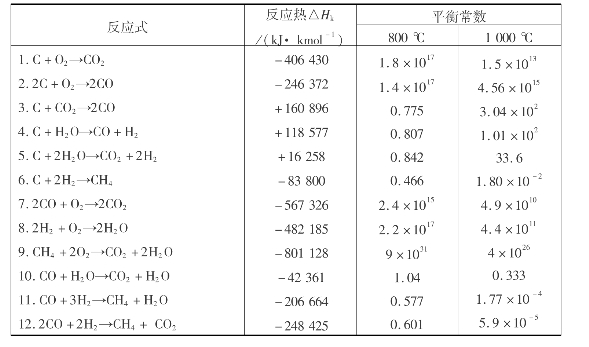
由热力学平衡关系可以从理论上计算气化气体组成与平衡温度关系。计算表明:温度高,气化反应进行比较完全;压力高,生成甲烷多,因此高压气化可以得到含甲烷多、热值较高的煤气。
8.2.2.2 气化动力学
煤气化时受热首先是热解,生成半焦、液态和气态产品,焦粒的气化是传质和化学反应交替进行的过程。其反应在低温时仅受化学反应控制,而高温时传质过程则成为决定速率的因素。在整个反应中,气化剂的吸附、活性部位的表面反应以及产物的解吸构成了气化反应的基本步骤。
碳的气化反应通常按一级反应计算反应速率:
![]()
式中 m(C)——燃料的质量,kg;
c(O2)——氧气的浓度,kmol/m3;
k——速率常数,它与温度的关系为
式中 A——指前因子;
