4.3.1 白洋淀湖泊湿地上覆水环境因子特征分析
4.3.1.1 温度
水体温度是湖泊湿地系统中重要的生态要素。水温的变化不仅直接影响到湖泊水生生物的生长、繁殖,还是影响水体DO浓度高低的关键因子(郭秀云等,2007)。当水温较低时,水生生物生命活动变缓甚至停止,水中各种物质的转化速率相应降低;当水温上升时,水生生物的新陈代谢增强,呼吸作用加快,物质转换速率增加,有机物的耗氧率明显增高,导致水中DO含量减少。
白洋淀湖泊湿地虽沟壑纵生,但相互连通,因此水体温度分布比较均匀,图4.6为白洋淀湖泊湿地实验区表层水体温度的时间变化情况,4个不同的实验区水温差异并不显著,最大温差约3℃。在实验期间,白洋淀湖泊湿地水体温度表现出明显的季节变化,水温范围为0~32.0℃,并在8月达到最高温度,12月出现最低温度,之后水体逐渐结冰,直至第二年春天重新融化。
尽管白洋淀湖泊湿地整体水温差异不大,但湖心区和湖滨带的水温仍不相同。图4.7是各实验区湖心区和湖滨带平均水温变化图,由图4.7可以看出,在5—10月植物生长季,湖滨带的水温略低于湖心区水体温度,主要原因是植被的遮阴作用一方面减少了阳光对湖滨带水体的照射;另一方面也降低了陆地区的土壤温度,经过热传递作用使得湖滨带水温相对较低。
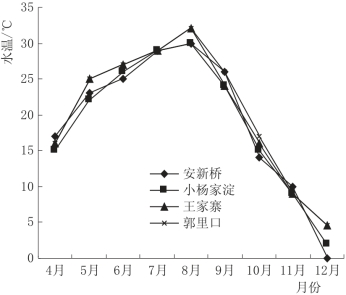
图4.6 白洋淀湖泊湿地水温时序变化图
4.3.1.2 DO
DO是水体中所有需氧生物新陈代谢的关键因素,是反映水中生物生长状况和污染状态的重要指标。湖泊湿地水体中DO水平主要与溶解平衡条件、湖泊水动力条件、光合作用强度、化学和生物新陈代谢耗氧程度等因素有关(张莹莹等,2007)。图4.8是白洋淀湖泊湿地水体(10cm处)DO时序变化图,由图4.8可知,4个实验区DO的含量表现为:郭里口>王家寨>小杨家淀>安新桥,与白洋淀主要污水的入淀流向相反,说明污水入淀后,经过水体的稀释、水生生物的吸收降解以及沉降等作用逐步得到净化。由图4.8还可看出,4个不同实验区水体的DO虽有不同但变化趋势大致相似,均在温度最高的8月DO含量达到最低,而温度最低的12月DO最高,这与O2在水中溶解度的变化特征相一致,温度越低,DO含量越高。
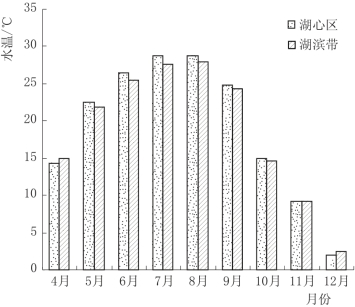
图4.7 白洋淀湖泊湿地水温空间变化图
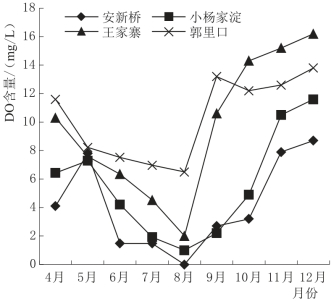
图4.8 白洋淀湖泊湿地DO时序变化图
与水温的空间变化相似,湖心区和湖滨带水中DO的含量也存在差异。图4.9是白洋淀湖泊湿地DO空间变化图,由图4.9可以看出,湖心区和湖滨带水中DO含量的变化趋势相一致,都随温度升高而降低,随温度降低而升高。在整个实验期,湖滨带水体DO含量均低于湖心区,这可能与湖滨带的特殊环境有关。湖滨带水位由湖心区向陆地区逐渐变浅,有利于芦苇的生长繁殖,芦苇发达的根系又会改变底质的微环境,使得该区成为微生物种类和数量最多的区域,微生物的生命活动以及对污染物的降解都需要消耗大量的DO;同时,茂密的芦苇还会对水中的各种污染物进行物理截留,增加了DO的消耗量,加之湖滨带的气—水界面较小,不利于大气中O2向水中的扩散,这些都可能造成湖滨带水中DO含量低于湖心区。
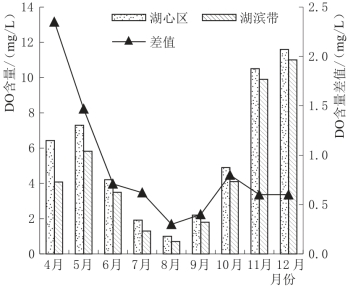
图4.9 白洋淀湖泊湿地DO空间变化图
由图4.9还可知,虽然湖滨带水体DO均低于湖心区,但两者的差值变化明显。4月时,湖心区和湖滨带水体DO的差值为2.4mg/L,随着时间的推移差值不断减少,8月时差值达到最小值0.3mg/L。但9月差值逐渐增加,10月再次出现峰值,11月和12月的差值基本一致。分析其原因可能为:白洋淀湖泊湿地在4月晚春季节温度迅速回升,湖滨带的各种生物开始复苏,生命活动加快,对水中DO的需求急剧增加;而湖心区由于水位深,对温度变化的响应缓慢,各种生物、化学反应仍处于较低水平,所以表现为二者水中DO差值最大。5—8月,随着温度的升高,一方面O2在水中的溶解度相对降低;另一方面湖心区各种生物数量也逐渐达到较高的水平,其新陈代谢能力加强,导致需氧量增多;而湖滨带在耗氧的同时,会有部分氧通过芦苇发达的根系补充给水体,因此,8月湖滨带和湖心区水体DO差值最小。(https://www.daowen.com)
8月以后,芦苇逐渐成熟,苇叶开始变黄脱落,脱落的苇叶腐败分解,增加了耗氧量;同时,芦苇的光合作用开始减弱,根系对水体的输氧能力也相应降低。湖滨带和湖心区水体DO差值逐渐增加,至10月达到一个峰值。11月白洋淀湖泊湿地进入冬季,温度迅速下降,芦苇收割完毕,各种生物的新陈代谢活动减少甚至停止,因此,湖滨带和湖心区水体DO差值又有所降低,且维持相对平稳的状态。
4.3.1.3 p H
湖泊水体的p H是水环境整体组成状况的主要参数指标,很大程度上确定了生物的发展条件,控制了水体中各类物质的迁移和转化过程,如元素的溶解沉淀、吸附解吸等(孙顺才等,1993;王雨春,2001)。
在白洋淀湖泊湿地中,4个实验区水中p H的变化特征不明显,图4.10是白洋淀湖泊湿地p H时序变化图。由图4.10可以看出,安新桥和小杨家淀实验区水中p H变化较大,为7.60~9.30,且无明显规律性,而郭里口实验区水中p H的变化范围较小,为7.80~8.48,原因可能是入淀污染物在短期内改变了水体的酸碱度,使安新桥和小杨家淀实验区水体的p H出现较大范围的波动;随着污染物在淀中的流动,p H逐渐趋于平稳,所以在郭里口实验区表现出相对稳定的p H。
从空间变化看,湖心区水中p H均高于湖滨带,且在7月和8月两区域的差值较大,结果见图4.11。可能原因主要包括两个方面:一方面是浮游植物的光合作用导致湖心区水体p H上升(金相灿等,1990);另一方面是湖滨带大量生长的芦苇在新陈代谢过程中分泌部分酸性物质,而且湖滨区的微生物数量和种类都多于湖心区,对底质中有机质的降解作用强于湖心区,这都会使湖滨带水体的p H降低。
4.3.1.4 CODMn
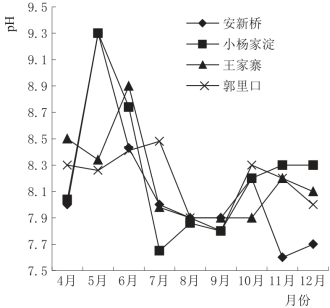
图4.10 白洋淀湖泊湿地p H时序变化图
CODMn是指在一定条件下,以高锰酸钾为氧化剂,处理水样时所消耗的量。一般来说,自然水体中的物质在外界所提供的条件下,都要尽其所能转变为最稳定的形态存在。水体中的亚硝酸盐转化为硝酸盐,亚铁转化为三价铁,硫化物、亚硫酸盐转化为硫酸盐,即含硫、磷的化合物能转变为硫酸盐和磷酸盐,含氮化合物能转变为硝酸盐等,这些稳定简单的化合物作为CODMn被测出。因此,CODMn可以表征水中还原性无机和有机污染物的含量。但由于CODMn的测定受温度、测定时间及氧化剂浓度所限,因此只能测定出水样中50%~70%的有机物质。
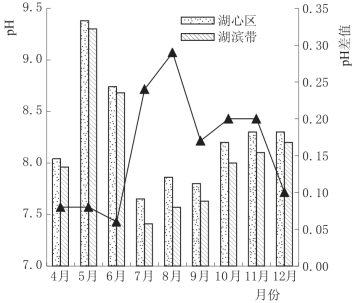
图4.11 白洋淀湖泊湿地p H空间变化图
图4.12为白洋淀湖泊湿地4个不同实验区水中CODMn的时序变化图。由图4.12可以看出,由于安新桥是污水入淀最先到达的地区,所以该处的CODMn普遍高于其他3个实验区,而小杨家淀是离安新桥最近的点,所以CODMn的变化特征基本与安新桥相似,都表现为4月和12月时含量较高,5—10月CODMn在相对较低的水平波动,可能与环境温度有关。4月和12月白洋淀湖泊湿地的温度都较低,各种生物的生命活动减缓或停止,所以水中还原性污染物的转化过程受到影响;而5—10月适宜的温度使湿地中各种生物的新陈代谢活动加强,有助于还原性污染物的转化。从图4.13湖心区和湖滨带CODMn的差值也能看出,在冻融的4月和温度较高的7—9月,湖心区的CODMn都远高于湖滨带,这就说明了生物作用一定程度上加速了水中还原性污染物的去除速度,使其含量明显降低。
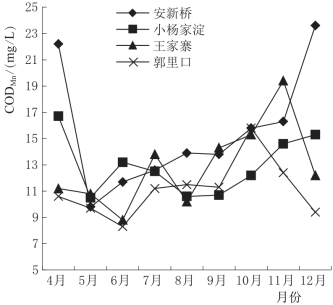
图4.12 白洋淀湖泊湿地水体CODMn时序变化图
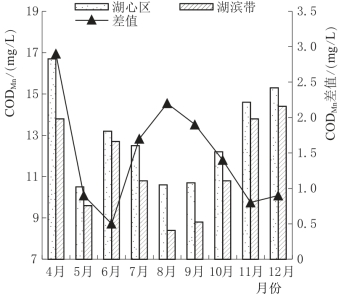
图4.13 白洋淀湖泊湿地水体CODMn空间变化图
