关于脂蛋白a和残余胆固醇
脂蛋白a[Lp(a)]是由肝脏合成的一种类低密度脂蛋白的颗粒,由包含载脂蛋白B100(ApoB100)的LDL颗粒、载脂蛋白A[ApoA]和氧化磷脂(ox-PL)构成,由于Apo(a)的肽链长短不一,所以Lp(a)具有明显的多态性、大小不等。Lp(a)最初在20世纪80年代引起人们的关注,但由于流行病学研究的缺陷,并没有得到足够的研究与重视。
近些年的一些研究揭示了Lp(a)与动脉粥样硬化的关系,证明了Lp(a)与心血管疾病之间存在独立的因果关系。研究表明,确诊为ASCVD且Lp(a)水平升高>500毫克/升的患者患心血管疾病的风险增加31%,ASCVD事件的发生率为41.5%。也有研究表明,Lp(a)水平高于1800毫克/升可能与ASCVD的终生风险有关,相当于杂合性家族性高胆固醇血症的风险。
根据中国人群的研究结果,指南推荐Lp(a)水平低于300毫克/升,并推荐在以下人群中进行Lp(a)筛查:ASCVD极高危人群,早发ASCVD家族史(男<55岁,女<65岁),直系亲属血清Lp(a)水平>900毫克/升,家族性高胆固醇血症或其他遗传性血脂异常,钙化性主动脉瓣狭窄(CAVS)。
20%~30%的总人口存在Lp(a)水平升高。Lp(a)主要受遗传因素的影响,其代谢过程目前并不完全清楚,因此其致病机制也没研究清楚。目前也没有专门的药物将Lp(a)浓度降低到实现心血管益处所需的程度。他汀类药物不降低或升高Lp(a)水平;而烟酸使其降低约30%,但没有心血管获益。PCSK9抑制剂能够降低Lp(a)50~120毫克/升;然而这种益处似乎只在Lp(a)水平非常高的患者中才能看到。据报道,米泊美生(一种血浆胆固醇酯转移蛋白抑制剂)可以降低Lp(a)的水平,但是没有明确的心血管获益。
目前,诺华公司正在开发一种全新的药物——Pelacarsen,这是一种肝细胞导向的第二代反义寡核苷酸(ASO),能够靶向结合肝细胞中的载脂蛋白A信使RNA(m RNA),阻止载脂蛋白A的翻译和产生,最终阻断Lp(a)的合成。Ⅱ期临床试验的数据表明,Lp(a)降低了50%以上,并且效果能维持16周。目前正在进行Ⅲ期临床试验,顺利的话,Pelacarsen有望成为第一个针对Lp(a)的药物。
另一个正在研发的药物是Olpasiran,这是一种利用小干扰RNA(siRNA)技术的Lp(a)靶向剂,Ⅰ期临床试验显示Olpasiran在剂量≥9毫克时,Lp(a)下降的中位数百分比>90%,并且其作用持续时间超过6个月。如果这两个药物成功上市,将为降低Lp(a)的治疗提供有效的手段,也能够更好地降低心血管病的风险。
残余胆固醇(RC)包括富含甘油三酯的极低密度脂蛋白、中等密度脂蛋白和非空腹状态下的乳糜微粒残留物中的胆固醇含量;非空腹状态下体内RC的水平较空腹时约高0.2毫摩/升,但并没有临床意义;因此建议在大多数患者中使用非空腹血脂,在非空腹血浆甘油三酯>5毫摩/升(440毫克/分升)时可以考虑空腹采样。(https://www.daowen.com)
残余胆固醇=总胆固醇-低密度脂蛋白胆固醇-高密度脂蛋白胆固醇
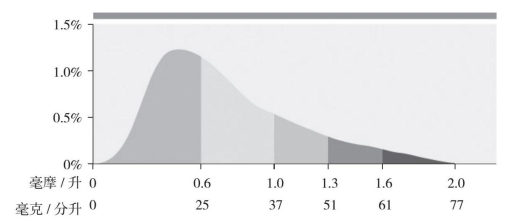
残余胆固醇的分布特征
浓度分布不对称,尾端朝向更高的水平
流行病学和孟德尔随机研究表明,残余胆固醇升高与包括心肌梗死在内的缺血性心脏病风险的增加有很强的相关性;残余胆固醇不依赖低密度脂蛋白胆固醇促进动脉粥样硬化性心血管疾病。
PREDIMED队列研究分析了残余胆固醇水平和主要不良心血管事件(心肌梗死、卒中或心血管死亡)之间的关系,发现RC每增加10毫克/分升(0.26毫摩/升),主要不良心血管事件(MACE)风险则增加21%;在超重或肥胖人群中,TG和RC的水平与心血管事件的发生相关,且独立于生活方式和其他危险因素。RC>30毫克/分升(0.78毫摩/升)可作为识别心血管高风险的临界值,将RC降低32毫克/分升(0.83毫摩/升)估计可减少20%的MACE复发。非空腹RC每增加1毫摩/升,相应的缺血性心脏病的风险增加2.8倍。
治疗方面除了选择减重、低脂饮食、限酒戒烟和体力活动之外,他汀类、贝特类、烟酸类药物,高纯度鱼油制剂和PCSK9抑制剂等常见的降胆固醇或TG药物均可降低RC的水平。
