任务二 病毒的增殖和培养
病毒具有复制周期,包括吸附、穿入、脱壳、生物合成、组装和释放等步骤。特异性吸附是病毒表面的分子与细胞的受体结合的结果,血凝作用的本质也是病毒与细胞受体的结合。穿入和脱壳可发生在细胞膜、内吞小体及核膜上,因病毒种类而异。在隐蔽期病毒进行活跃的生物合成,此时完成mRNA 的转录及蛋白质的合成。病毒转录的方式各不相同,有许多值得注意的特点。翻译的蛋白质有的尚需后加工,如糖基化、酶裂解等。结构简单的无囊膜二十面体病毒的衣壳可自我组装。大多数无囊膜病毒在细胞裂解后释放出病毒颗粒。有囊膜的病毒则以出芽方式成熟并释放,有细胞膜出芽和胞吐两种形式。
一、病毒的增殖
(一)病毒增殖的方式
病毒增殖只在活细胞内进行,其方式有别于其他微生物,是以病毒基因为模板,在酶的作用下,分别合成其基因及蛋白质,再组装成完整的病毒颗粒,这种方式称为复制。
病毒的复制是由宿主细胞供应原料、能量、酶和生物合成场所,在病毒核酸遗传密码的控制下,于宿主细胞内复制出病毒的核酸和合成病毒的蛋白质,进一步装配成大量的子代病毒,并将它们释放到细胞外的过程。
(二)病毒复制过程
病毒的复制过程大致可分为吸附、穿入、脱壳、生物合成、组装与释放5 个主要阶段。
1.吸附
病毒附着在宿主细胞的表面称为吸附,是病毒复制的第一步。这个过程包含静电吸附及特异性受体吸附两阶段。细胞及病毒颗粒表面都带负电荷,Ca2+、Mg2+等阳离子能降低负电荷,促进静电吸附。静电吸附是可逆的,非特异的。
特异性吸附对于病毒感染细胞至关重要。病毒表面的分子(如纤突等)吸附敏感细胞表面的受体,这种结合是特异的。病毒受体是宿主细胞表面的特殊结构,多为糖蛋白,有些是免疫球蛋白超家族的成员,例如新城疫病毒、甲型流感病毒等的CD169(唾液酸),伪狂犬病病毒的CD155、犬瘟热病毒的CD150、小鼠肝炎病毒的CEA 等。病毒与受体的特异结合反映了病毒的细胞嗜性。
吸附作用受许多内外因素的影响,如细胞代谢抑制剂、酶类、脂溶剂、抗体,以及温度、pH 值、离子浓度等。
2.穿入
穿入是指病毒或其一部分进入宿主细胞的过程。病毒吸附于细胞表面后,迅速侵入细胞。侵入宿主细胞的方式有4 种:①膜融合,病毒包膜与宿主细胞膜融合,将病毒的内部组分释放到细胞质中,如流感病毒;②利用细胞的胞吞作用,多数病毒按此方式侵入;③完整病毒穿过细胞膜的移位方式,如腺病毒;④某些病毒以完整的病毒颗粒直接通过宿主细胞膜穿入胞浆中,如呼肠孤病毒。
3.脱壳
脱壳是病毒侵入后,病毒的囊膜和/或衣壳被除去而释放出病毒核酸的过程。病毒脱壳包括脱囊膜和脱衣壳两个过程。没有囊膜的病毒,则只有脱衣壳的过程。
某些病毒在细胞表面脱囊膜,如疱疹病毒的囊膜可与细胞膜融合,同时在细胞质内释放核衣壳,痘病毒的囊膜则在吞饮泡内脱落。
动物病毒穿入宿主细胞并脱壳的过程有所不同,可发生在细胞膜、内吞小体及核膜上。某些病毒(如腺病毒),可能因宿主细胞酶的作用或经某种物理因素脱壳。新城疫病毒等副黏病毒在细胞膜穿入并脱壳。流感病毒等病毒在吸附细胞后,细胞将其吞饮,又称为病毒包饮,形成内吞小体,病毒在内吞小体进行脱壳。
4.生物合成
病毒脱壳后,释放核酸,这时在细胞内查不到病毒颗粒,故称为隐蔽期或黑暗期。病毒的生物合成发生在隐蔽期,非常活跃,包括mRNA 的转录、蛋白质及DNA 或RNA 的合成等。隐蔽期实际上是病毒增殖过程中最主要的阶段,此时,病毒的遗传信息向细胞传达,宿主细胞在病毒遗传信息的控制下合成病毒的各种组成成分及其所需的酶类,包括病毒核酸转录或复制时所需的聚合酶。最后由新合成的病毒成分装配成完整的病毒粒子。
生物合成发生的部位因病毒种类而异,多数DNA 病毒及逆转录病毒发生在细胞核,少数(如痘病毒、非洲猪瘟病毒)发生在细胞质,虹彩病毒及嗜肝DNA 病毒在细胞核和细胞质均有。
5.组装与释放
组装就是在病毒感染的细胞内,将分别合成的病毒核酸和蛋白质组装为成熟病毒粒子的过程。病毒的组装与释放显示了病毒的成熟。成熟的部位因病毒而异,可在细胞质、细胞核、核膜、细胞膜、内质网膜或高尔基体膜。如黄病毒、冠状病毒、动脉炎病毒和布尼亚病毒在高尔基体膜或粗面内质网膜成熟。
(1)无囊膜病毒。无囊膜结构的、简单的二十面体病毒产生的壳粒可自我组装,形成衣壳,进而包装核酸形成衣壳,如微RNA 病毒、乳头瘤病毒和多瘤病毒等。微RNA 病毒等的壳粒在自我组装前要经过酶的加工。
腺病毒由DNA 一端的包装序列与某种蛋白质结合,从而使DNA 进入事先装配好的空衣壳内,衣壳蛋白再经酶的加工,产生成熟的病毒颗粒。大多数无囊膜的病毒蓄积在细胞质或细胞核内,当细胞完全裂解时,释放出病毒颗粒。
(2)有囊膜病毒。有囊膜的病毒以出芽的方式成熟,有细胞膜出芽及胞吐两种形式。有囊膜的DNA 病毒(如单纯疱疹病毒),在核内装配成核衣壳,移至核膜上,以出芽方式进入胞浆中,获取宿主细胞核膜成分成为囊膜,并逐渐从胞浆中释放到细胞之外。另一部分能通过核膜裂隙进入胞浆,获取一部分胞浆膜而成为囊膜,沿核周围与内质网相通部位从细胞内逐渐释放。有囊膜的RNA 病毒(如副流感病毒),其RNA 与蛋白质在胞浆中装配成螺旋状的核衣壳,宿主细胞膜上在感染过程中已整合有病毒的特异抗原成分(如血凝素与神经氨酸酶)。当成熟病毒以出芽方式通过细胞膜时,就带有这种胞膜成分,并产生刺突。
二、病毒的培养
病毒缺乏完整的酶系统,又无核糖体等细胞器,所以不能在无生命的培养基上生长,必须在活细胞内增殖。因此,实验动物、禽胚以及体外培养的组织和细胞就成为人工培养病毒的场所,其中细胞培养是用于病毒分离和培养最常用的方法,而病毒的人工培养,是病毒实验研究以及制备疫苗和特异性诊断制剂的基本条件。
(一)动物接种
病毒经注射、口服等途径进入易感动物体后可大量增殖,并使动物产生特定反应。动物接种分本动物接种和实验动物接种两种方法。实验用动物应该是健康的,血清中无相应病毒的抗体,并符合其他要求。当然,理想的实验动物是无菌动物或SPF(无特定病原体)动物。常用的实验动物有小鼠、家兔、豚鼠、鸡等。
动物接种尽管是培养病毒的一种古老方法,但也是一种现在生产中常用的方法。动物接种培养病毒主要用于病原学检查、传染病的诊断、疫苗生产及疫苗效力检验等。
(二)禽胚培养
禽胚是正在孵育的禽胚胎。禽胚组织分化程度低,病毒易于在其中增殖,来自禽类的病毒大多可在相应的禽胚中增殖,其他动物病毒也可在禽胚内增殖,感染的胚胎组织中病毒含量高,培养后易于采集和处理,禽胚来源充足,操作简单。由于优点较多,禽胚是目前较常用的病毒培养方法。但禽胚中可能带有垂直传播的病毒,也有卵黄抗体干扰的问题,因此最好选择SPF 胚。
禽胚中最常用的是鸡胚,病毒在鸡胚中增殖后,可根据鸡胚病变和病毒抗原的检测等方法判断病毒增殖情况。病毒导致禽胚病变常见的有以下4 个方面:一是禽胚死亡,胚胎不活动,照蛋时血管变细或消失;二是禽胚充血、出血或出现坏死灶,常见在胚体的头、颈、躯干、腿等处或通体出血;三是禽胚畸形;四是禽胚绒毛尿囊膜上出现痘斑。然而,许多病毒缺乏特异性的病毒感染指征,必须应用血清学或病毒学相应的检测方法来确定病毒的存在和增殖情况。
接种时,不同病毒可采用不同的接种途径,并选择日龄合适的禽胚。常用的鸡胚接种途径及相应的日龄为:绒毛尿囊膜接种,主要用于痘病毒和疱疹病毒的分离与增殖,用10~13日龄鸡胚;尿囊腔接种,主要用于正黏病毒和负黏病毒的分离与增殖,用9~12 日龄鸡胚;卵黄囊接种,主要用于虫媒披膜病毒及鹦鹉热衣原体和立克次氏体等的增殖,用6~8 日龄鸡胚;羊膜腔接种,主要用于正黏病毒和负黏病毒的分离与增殖,此途径比尿囊腔接种更敏感,但操作较困难,且鸡胚易受伤致死,选用10~11 日龄鸡胚。
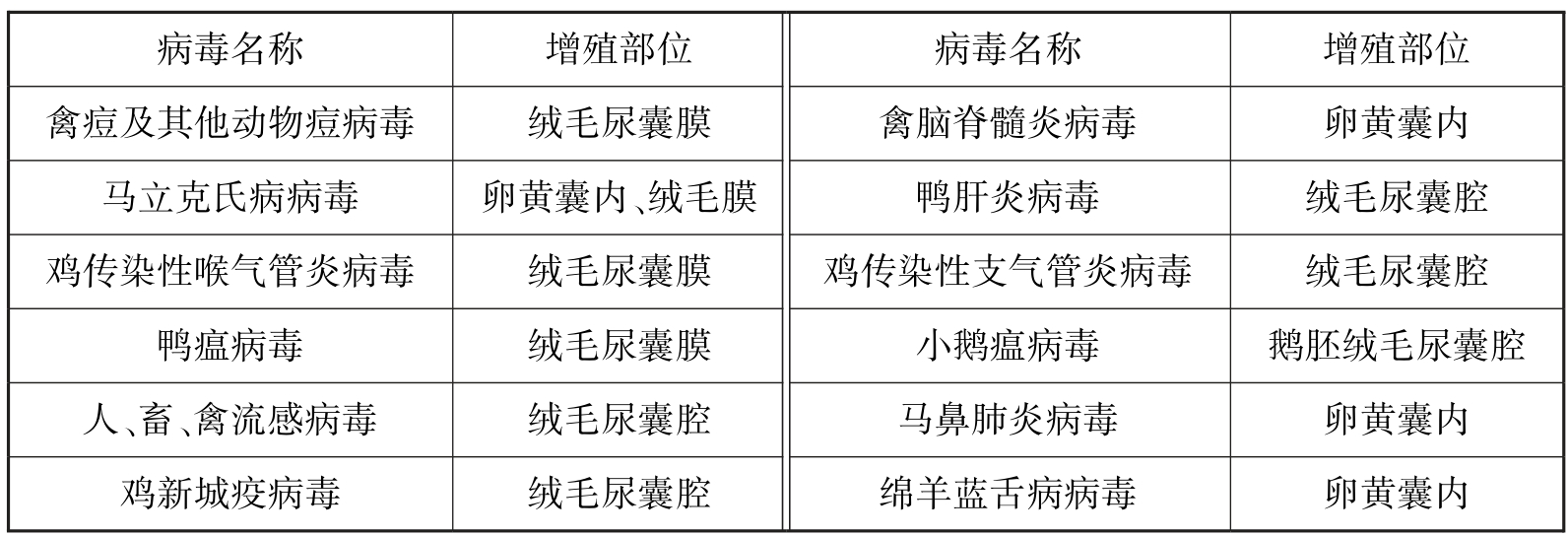
鸡胚接种部位见图2.9,适于鸡胚接种的病毒见表2.2。
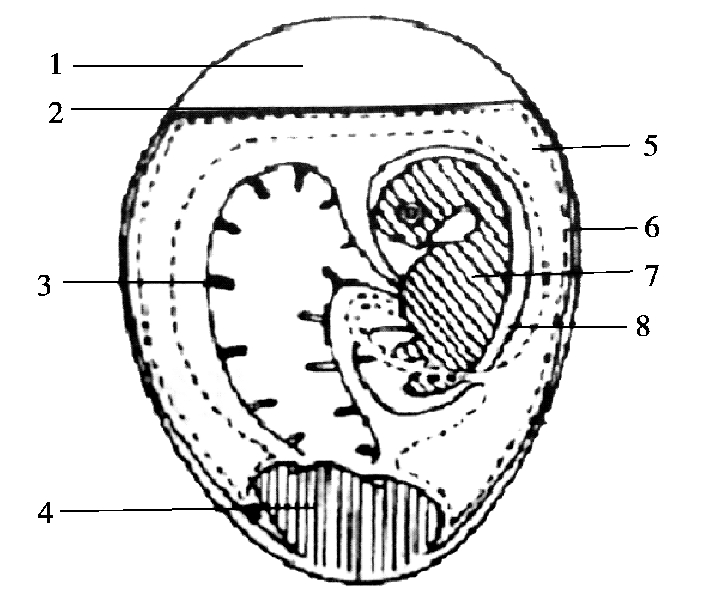
图2.9 鸡胚接种部位
1—气室;2—壳膜;3—卵黄囊;4—蛋清;5—尿囊腔;6—绒毛尿囊膜;7—胚体;8—羊膜腔
表2.2 适于鸡胚接种的病毒
接种后的鸡胚一般37 ℃孵育,相对湿度60%。根据接种途径不同,收获相应的材料:绒毛尿囊膜接种时收获接种部位的绒毛尿囊膜;尿囊腔接种时收获尿囊液;卵黄囊接种时收获卵黄囊及胚体;羊膜腔接种时收获羊水。
禽胚接种在基层生产中应用相当广泛,常用于家禽传染病的诊断、病毒病原性研究以及生产诊断抗原和疫苗等方面。
(三)组织培养
组织细胞培养是用体外培养的组织块或单层细胞分离增殖病毒。组织培养即将器官或组织块于体外细胞培养液中培养存活后接种病毒,观察组织功能的变化,如气管黏膜纤毛上皮的摆动等。
体外培养动物组织,在100 多年前已获成功,直到20 世纪50 年代采用了将组织细胞分散的技术,使组织培养变为细胞培养,得以应用于病毒学研究、诊断及疫苗制备的方面。组织培养和细胞培养在此领域基本是同义词,前者包括后者。
细胞培养是用细胞分散剂将动物组织细胞消化成单个细胞的悬液,适当洗涤后加入营养液,使细胞贴壁生长成单层细胞。病毒感染细胞后,大多数能引起细胞病变,称为病毒的致细胞病变作用(CPE),借助倒置显微镜即可观察到,表现为多种形式(如细胞圆缩、肿大、形成合胞体或空泡等)。还有的细胞不发生病变,但培养物出现红细胞吸附及血凝现象(如流感病毒等)。有时还可用免疫荧光技术等血清学试验检查细胞中的病毒。兽医上通常用的细胞有CEF(鸡胚成纤维细胞)、DEF(鸭胚成纤维细胞)、PK-15 株(猪肾上皮细胞)、Vero(非洲绿猴肾细胞)、K-L 株(中国仓鼠肺)等,细胞培养多用于病毒的分离、培养和检测中和抗体,在病毒的诊断和研究中发挥了很大的作用。
细胞培养的类型包括原代细胞、二倍体细胞株和传代细胞系。细胞培养的方法有静置培养和旋转培养、悬浮培养和微载体培养。组织细胞培养病毒有许多优点:一是离体活组织细胞不受机体免疫力影响,很多病毒易于生长;二是便于人工选择多种敏感细胞供病毒生长;三是易于观察病毒的生长特征;四是便于收集病毒作进一步检查。因此,细胞培养是病毒研究、疫苗生产和病毒病诊断的良好方法。但此法成本和技术水平要求较高,操作复杂,在基层单位尚未广泛应用。
三、病毒的其他特性
(一)干扰现象
在两种病毒感染同一种细胞时,可以发生一种病毒抑制另一种病毒复制的现象,称为干扰现象。干扰现象可以发生在异种病毒之间,也可发生在同种病毒不同型或株之间,甚至在病毒高度复制时,也可发生自身干扰,灭活病毒也可干扰活病毒的增殖,最常见的是异种病毒之间的干扰现象。
病毒之间产生干扰的原因有以下几方面:
1.占据或破坏细胞受体
两种病毒感染同一细胞,需要细胞膜上相同的受体,先进入的病毒首先占据细胞受体或将受体破坏,使另一种病毒无法吸附和穿入易感细胞,增殖过程被阻断。
2.争夺酶系统、生物合成原料及场所
两种病毒可能利用不同的受体进入同一细胞,但它们在细胞中增殖所需的原料、关键性酶及合成场所是一致的,而且是有限的。因此,先入者为主,强者优先,一种病毒占据有利增殖条件而正常增殖,另一种病毒则增殖受到抑制。
3.干扰素的产生
病毒之间存在干扰现象的最主要原因是先进入的病毒可诱导细胞产生干扰素,抑制病毒的增殖。
干扰素是机体活细胞受到病毒感染或干扰素诱生剂刺激后产生的一种低分子量的糖蛋白。它释放到蛋白外被其他细胞吸收,吸收了这种干扰素的细胞便产生一种物质,即抗病毒蛋白质,具有抑制病毒复制的作用。具有强的种属特异性。
干扰素按照化学性质可分为以下3 类:①α 干扰素,主要由白细胞和其他多种细胞在受到病毒感染后产生的,人类的α 干扰素至少有22 个亚型,动物的较少;②β 干扰素,由成纤维细胞和上皮细胞受到病毒感染时产生,只有1 个亚型;③γ 干扰素,由T 淋巴细胞和NK 细胞在受到抗原或有丝分裂原的刺激产生,是一种免疫调节因子,主要作用于T 细胞、B 细胞和NK 细胞,增强这些细胞的活性,促进抗原的清除。
干扰素对热稳定,60 ℃1 h 一般不能灭活,在pH 值为3~10 稳定,但对胰蛋白酶和木瓜蛋白酶敏感。
干扰素的生物学活性有:①抗病毒作用。广谱抗病毒、非特异性的、具有明显的动物种属特异性;②免疫调节作用。主要是γ 干扰素的作用,γ 干扰素可作用于T 细胞、B 细胞和NK 细胞,增强它们的活性;③抗肿瘤作用。抑制肿瘤病毒的增殖,抑制肿瘤细胞的生长,调节机体的免疫机能,通过调节癌细胞基因的表达,实现抗肿瘤的作用。
(二)抵抗力
灭活,病毒受理化因素的作用失去感染性。
1.物理因素
耐干燥。高温能杀死病毒。多数55 ℃30 min 可灭活。耐低温,0 ℃以下低温有利于病毒存活,加入乳糖或脱脂乳冻干可长期保存病毒,但不能反复冻融。大量紫外线和长时间日光照射能杀灭病毒。
2.化学因素
用50%甘油缓冲生理盐水保存病毒。大多数病毒对碱敏感,常用2%氢氧化钠溶液消毒环境,对高锰酸钾、次氯酸盐、酒精、强酸碱敏感。0.125%甲醛能有效降低病毒的致病力,但不影响其抗原性,常用于制备灭活疫苗。对盐类稳定(MgCl2、Na2SO4 作为正副黏病毒和疱疹病毒的稳定剂)。
3.脂溶剂
脂溶剂能破坏病毒囊膜而使其灭活。常用乙醚、氯仿等脂溶剂处理病毒,以检查其有无囊膜。
(三)滤过特性与离心
病毒微小,能通过孔径为0.02 μm 的滤膜过滤器,细菌不能透过,利用这一特性,可将病毒、细菌分开。病毒质量极轻,高速离心也难以下沉,以3 000~4 000 r/min 离心,病毒处在上清液中。
(四)病毒的血凝现象
许多病毒表面有血凝素,能与鸡、豚鼠的红细胞表面受体结合,而出现红细胞凝集现象,简称病毒的血凝现象。这种血凝现象是非特异性的,当病毒与相应的抗病毒抗体结合后,能使红细胞的凝集现象受到抑制,称为病毒血凝抑制现象。能阻止病毒凝集红细胞的抗体称为红细胞凝集抑制抗体,其特异性很高。例如,用于诊断鸡新城疫、流感、流行性乙型脑炎、EDS-76、鸡传染性鼻炎、牛瘟、细小病毒病、狂犬病等。
