任务四 免疫检测
一、体液免疫检测
血清学试验
抗原与抗体的特异性结合既会在体内发生,也可以在体外进行,体外进行的抗原抗体反应习惯上称作血清学反应。抗原和抗体的体外反应是应用最为广泛的一种免疫学技术,为疾病的诊断、抗原和抗体的鉴定及定量提供了良好的方法。
1.血清学反应的一般规律
(1)敏感性。抗原抗体的结合具有高度的敏感性,不仅可定性检测,还可以定量检测微量、极微量的抗原或抗体,其敏感度大大超过当前所应用的化学分析方法。
(2)特异性和交叉性。抗原抗体的结合实质上是抗原表位与抗体超变区中抗原结合位点之间的结合。由于两者在化学结构和空间构型上呈互补关系,因此抗原与抗体的结合具有高度的特异性。例如,白喉抗毒素只能与其相应的外毒素结合,而不能与破伤风外毒素结合。但较大分子的蛋白质常含有多种抗原表位。如果两种不同的抗原分子上有相同的抗原表位,或抗原、抗体间构型部分相同,皆可出现交叉反应。
(3)最适比与带现象。在抗原抗体特异性反应时,生成结合物的量与反应物的浓度有关。无论是在一定量的抗体中加入不同量的抗原,还是在一定量的抗原中加入不同量的抗体,只有在两者分子比例合适时才出现最强的反应。以沉淀反应为例,若向一排试管中加入一定量的抗体,然后依次向各管中加入递增量的相应可溶性抗原,根据所形成的沉淀物及抗原抗体的比例关系可绘制出反应曲线,曲线的高峰部分是抗原抗体分子比例合适的范围,称为抗原抗体反应的等价带。
在此范围内,抗原抗体充分结合,沉淀物形成快而多。反应最快,沉淀物形成最多,上清液中几乎无游离抗原或抗体存在,表明抗原与抗体浓度的比例最为合适,称为最适比。当抗原或抗体过量时,由于其结合价不能相互饱和,就只能形成较小的沉淀物或可溶性抗原抗体复合物,无沉淀物形成,称为带现象。抗体过量时,称为前带;抗原过剩时,称为后带。
(4)可逆性。抗原与抗体结合有高度特异性,这种结合虽相当稳定,但为可逆反应。抗原与抗体的结合是分子表面的结合,结合条件为0~40 ℃,pH 值为4~9。抗原抗体复合物的解离取决于两方面的因素:一是抗体对相应抗原的亲和力;二是环境因素对复合物的影响。解离后的抗原或抗体均能保持未结合前的结构、活性及特异性。在环境因素中,凡是减弱或消除抗原抗体亲和力的因素都会使逆向反应加快,复合物解离增加。如pH 值改变,过高或过低的pH 值均可使离子间静电引力消失。对亲和力本身较弱的反应体系而言,仅增加离子强度即可解离抗原抗体复合物。
(5)抗原抗体反应的阶段性。第一阶段为抗原抗体特异性结合,需时短,仅几秒到几分钟的时间;第二阶段为可见反应阶段,需时较长,数分钟到数日,表现为凝集、沉淀、细胞溶解等。
(6)用已知测未知。在血清学试验中,只能有一种材料是未知的。
2.血清抗体的制备原则
用抗原反复多次注射同一动物体,能够产生含有高效价的血清抗体,含有抗体的血清被称为免疫血清或抗血清。由于抗原分子具有多种抗原决定簇,每一种决定簇可激活具有相应抗原受体的B 细胞产生针对某一抗原决定簇的抗体。因此,将抗原注入机体所产生的抗体是针对多种抗原决定簇的混合抗体,故称为多克隆抗体。
(1)动物的选择。最常用来做试验的抗体来源是血清。供免疫用的动物有哺乳类和禽类,常选用家兔、山羊、绵羊、马、骡和豚鼠等。动物种类的选择主要是根据抗原的特性和所要获得抗体的量和用途来确定。如马匹常用于制备大量抗毒素血清,但其沉淀素抗体的等价带较窄,用于免疫电泳不理想;豚鼠适用于制备抗酶类抗体和供补体结合试验用的抗体,但抗血清产量较少;对于难以获得的抗原,且抗体需要量少,可用纯系小鼠制备。免疫用动物应适龄、健壮,最好为雄性。由于动物个体间的免疫应答能力差异较大,每批免疫最好同时使用数只动物。
(2)抗原及佐剂。不同抗原的免疫原性强弱不一,这取决于其分子质量、化学活性基团、立体结构、物理性状和弥散速度等。抗原的免疫剂量依照给予抗原的种类、免疫次数、注射途径、受体动物的种类、免疫周期及所要求的抗体特性等的不同而异。剂量过低不能形成足够强的免疫刺激,但剂量过高又有可能造成免疫耐受。在一定范围内,抗体效价随注射抗原的剂量而增高,蛋白质抗原的免疫剂量比多糖类抗原范围大。一般来说,小鼠首次抗原剂量为50~400 μg/次;大鼠为100~1 000 μg/次;兔为200~1 000 μg/次。加强免疫的剂量为首次剂量的1/5~2/5。如需制备高度特异性的抗血清,可选用低剂量抗原短程免疫法;反之,欲获得高效价的抗血清,宜采用大剂量抗原长程免疫法。
佐剂是指那些与抗原一起或先于抗原注入机体后可增强机体对该抗原的免疫应答能力或改变免疫应答类型的物质。佐剂是非特异性的免疫增强剂。
对可溶性抗原常需加用佐剂,以增强抗原的免疫原性或改变免疫反应的类型,以刺激机体产生较强的免疫应答。如用可溶性蛋白质抗原免疫家兔或山羊,在加用佐剂时一次注入量一般为0.5~1 mg/kg;如不加佐剂,则抗原剂量应加大10~20 倍。佐剂有弗氏佐剂、脂质体佐剂及氢氧化铝佐剂等。其中最常用的是弗氏佐剂,根据其组成分为完全弗氏佐剂(CFA)和不完全弗氏佐剂(IFA)两种。IFA 通常由羊毛脂1 份、石蜡油5 份组成。IFA 中加入1~20 mg/mL 的卡介苗即为CFA。
(3)免疫方案。通常根据抗原性质、免疫原性及动物的免疫反应性决定注射途径、免疫次数、间隔时间等。抗原注射途径可根据不同抗原及试验要求,选用皮内、皮下、肌内、静脉或淋巴结内等不同途径。一般常采用背部、足掌、淋巴结周围、耳后等处皮内或皮下多点注射。初次免疫与第二次免疫的间隔时间多为2~4 周。
常规免疫方案为抗原加CFA 皮下多点注射进行基础免疫;再以免疫原加IFA 做2~5 次加强免疫,每次间隔2~3 周。皮下或腹腔注射加强免疫。完成免疫程序后,先取少量血清测试抗体效价,如达到要求,即可进行心脏穿刺(豚鼠及家兔)、颈静脉或颈动脉放血(家兔、羊及马匹)。待血液凝固后,离心沉淀分离出血清,应注意避免溶血,血红蛋白会干扰如补体结合试验等反应。有时为了诊断目的,可以用其他的分泌物,如阴道黏液、乳、初乳或乳清来做试验,后者是加凝乳酶于初乳中而得到的。在掌握了更多的关于IgA 型抗体在诊断上的重要性以后,也可以用粪便和唾液来作为抗体制剂。
(4)血清的保存。做免疫学试验时,虽然血清不需要无菌,但应该避免污染,因为试验往往是在适于细菌繁殖的温度下进行的。细菌繁殖会干扰试验,甚至破坏抗体。若条件许可,血清应在-20 ℃的冰箱中保存。如果适当地避免细菌污染,血清可在普通冰箱中或在工作台上保存数天。为防止细菌污染,血清中最好加入少量防腐剂,如0.1%叠氮钠、0.01%柳硫汞、0.25%石炭酸或等量的中性甘油,但需注明血清样品已加入的防腐剂名称,因为有些防腐剂可以干扰要进行的试验。也可将抗血清冷冻干燥后保存。
3.影响血清学反应的因素
影响抗原抗体反应的因素很多,既有反应物自身的因素,也有环境条件因素。
(1)抗体。抗体是血清学反应中的关键因素,它对反应的影响可来自以下几个方面。
①抗体的来源。不同动物的免疫血清,其反应性也存在差异。家兔等多数实验动物的免疫血清具有较宽的等价带,通常在抗原过量时才易出现可溶性免疫复合物;人和马免疫血清的等价带较窄,抗原或抗体的少量过剩便易形成可溶性免疫复合物;家禽的免疫血清不能结合哺乳动物的补体,并且在高盐浓度(NaCl 50g/L)溶液中沉淀现象才表现明显。
②抗体的浓度。血清学反应中,抗体的浓度往往是与抗原相对而言。为了得到合适的浓度,在许多实验之前必须认真滴定抗体的水平,以求得最佳实验结果。
③抗体的特异性与亲和力。抗体的特异性与亲和力是血清学反应中的两个关键因素,但这两个因素往往难以两全其美。例如,早期获得的动物免疫血清特异性较好,但亲和力偏低;后期获得的免疫血清一般亲和力较高,但长期免疫易使免疫血清中抗体的类型和反应性变得复杂;单克隆抗体的特异性毋庸置疑,但其亲和力较低,一般不适用于低灵敏度的沉淀反应或凝集反应。
(2)抗原。抗原的理化性状、抗原决定簇的数目和种类等均可影响血清学反应的结果。例如可溶性抗原与相应抗体可产生沉淀反应,而颗粒性抗原的反应类型是凝集;单价抗原与抗体结合不出现可见反应;粗糙型细菌在生理盐水中易发生自凝,这些都需要在实验中加以注意。
(3)电解质。抗原与抗体发生特异性结合后,抗原抗体结合物,若溶液中无电解质参加,仍不出现可见反应。电解质是抗原抗体反应系统中不可缺少的成分,它可使免疫复合物出现可见的沉淀或凝集现象。为了促使沉淀物或凝集物的形成,一般用浓度8.5 g/L的NaCl溶液作为抗原和抗体的稀释剂与反应溶液。特殊需要时也可选用较为复杂的缓冲液,例如在补体参与的溶细胞反应中,除需要等渗NaCl 溶液外,加入适量的Mg2+和Ca2+可得到更好的反应结果。如果反应系统中电解质浓度低甚至无,抗原抗体不易出现可见反应,尤其是沉淀反应。但如果电解质浓度过高,则会出现非特异性蛋白质沉淀,即盐析。
(4)酸碱度。适当的pH 值是血清学反应取得正确结果的另一影响因素。抗原抗体反应必须在合适的pH 值环境中进行。蛋白质具有两性电离性质,因此每种蛋白质都有固定的等电点。血清学反应一般在pH 值6~9 进行,超出这个范围,不管过高还是过低,均可直接影响抗原或抗体的反应性,导致假阳性或假阴性结果。但是不同类型的抗原抗体反应又有不同的pH 值合适范围,这是许多因素造成的。
(5)温度。抗原抗体反应的温度适应范围比较宽,一般在15~40 ℃均可以正常进行。但若温度高于56 ℃,可导致已结合的抗原抗体再解离,甚至变性或破坏。在40 ℃时,结合速度慢,但结合牢固,更易于观察。常用的抗原抗体反应温度为37 ℃。但每种试验都可能有其独特的最适反应温度,例如冷凝集素在4 ℃左右与红细胞结合最好,20 ℃以上反而解离。
(6)振荡。适当的机械振荡能增加分子或颗粒间的相互碰撞,加速抗原抗体的结合反应,但强烈的振荡可使抗原抗体复合物解离。
(7)时间。时间本身不会对抗原抗体反应主动施加影响,但是实验过程中观察结果的时间不同可能会看到不同的结果,这一点往往被忽略。时间因素主要由反应速度来体现,反应速度取决于抗原抗体亲和力、反应类型、反应介质、反应温度等因素。例如,在液相中抗原抗体反应很快达到平衡,但在琼脂中就慢得多。另外,所有免疫试验的结果都应在规定的时间内观察。
(8)杂质和异物。试验中若有与反应无关的杂质、异物存在,会抑制反应的进行或引起非特异性反应,所以,每次血清学试验都应设阳性对照和阴性对照试验。
4.血清学反应的应用
血清学检测是一种特异性的诊断方法。根据抗原抗体结合形成免疫复合物的性状与活性特点,对样品中的抗原或抗体进行定性、定位或定量的检测,广泛用于临床检测,以进行疾病诊断和流行病学调查。
(1)抗原抗体的定性检测。
①检测抗体。抗体检测可用于评价人和动物免疫功能的指标。抗体用于临床治疗或实验研究时也需做纯度测定。临床上检测抗病原生物的抗体、抗过敏原的抗体、抗HLA 抗原的抗体、血型抗体及各种自身抗体,对有关疾病的诊断有重要意义。
用于研究动物免疫状态的技术,都是以检查与测定血清中和其他体液中的抗体为基础的。其中的大多数是在体外进行的,而且有肉眼可见其结果的免疫反应,如沉淀、凝集或溶解等。被检出的免疫球蛋白,可能是在免疫应答中所产生的全部或其中一部分,这要看所用的检验方法如何而定。
动物血清中存在抗体,说明该动物曾经与同源抗原接触过。抗体的出现意味着动物现在正患病或过去患过病,或意味着动物接种疫苗已经产生效力。如果在一个时期内测定抗体几次,就有可能判明出现的抗体是由哪种情况产生的。如果抗体水平迅速升高,表明感染正在被克服。如果抗体水平下降,表示这些抗体可能是传染病或接种疫苗的残余抗体。接种疫苗后测定抗体,可以明确人工免疫疗效的程度,而作为以后是否需要再接种疫苗的参考。
②检测抗原。可作为抗原进行检测的物质分为以下4 类。
各种微生物及其大分子产物:用于传染病诊断、微生物的分类及鉴定,以及对菌苗、疫苗的研究。
生物体内各种大分子物质:包括各种血清蛋白(如各类免疫球蛋白、补体的各种成分)、可溶性血型物质、多肽类激素、细胞因子及癌胚抗原等均可作为抗原进行检测,在对这些成分的生物学作用的研究以及各种疾病的诊断有重要意义。
人和动物细胞的表面分子:包括细胞表面各种分化抗原(如CD 抗原)、同种异型抗原(如血型抗原或MHC 抗原)、病毒相关抗原和肿瘤相关抗原等。检测这些抗原对各种细胞的分类、分化过程及功能研究,对各种与免疫有关的疾病的诊断及发病机制的研究,均有重要意义。
各种半抗原物质:某些药物、激素和炎症介质等属于小分子的半抗原,可以分别将它们偶联到大分子的载体上,组成人工结合的完全抗原。用其免疫动物,制备出各种半抗原的抗体,应用于各种半抗原物质的检测,例如对血液中药物浓度的监测,或对违禁药品的检测,都是应用半抗原检测的方法。
(2)抗原的定位检测。利用免疫组织化学技术,采用已知的抗体对相应抗原定位测定。它把抗原抗体反应的特异性和组织化学的可见性巧妙地结合起来,借助显微镜(包括荧光显微镜、电子显微镜)的显像和放大作用,在细胞、亚细胞水平检测各种抗原物质,如蛋白质、多糖、酶、激素、病原体以及受体等,并可在原位显示相应的基因和基因表达产物。
(3)抗原或抗体的定量检测。对抗原或抗体进行定量检测时,反应中加入抗原和抗体的浓度与形成免疫复合物的浓度呈函数关系。
根据免疫复合物产生的多少来推算样品中抗原(或抗体)的含量。在一定的反应条件下,加入一定量的已知抗体(或抗原),反应产生的免疫复合物多少与待检样品中含有相应抗原(或抗体)的量成正比。也就是抗体浓度一定时,免疫复合物越多则样品中的抗原量也越多。可用实验性标准曲线推算出样品中抗原(或抗体)的含量。如免疫单向扩散试验、免疫比浊试验和酶联免疫检测等都属于这类方法。
抗原或抗体效价滴定。当抗原抗体复合物形成的多少不能反映抗原抗体反应强弱时,就不能以检测反应强度来对抗原或抗体进行定量。在实际工作中,把浓度低的反应成分(抗原或抗体)的浓度固定,把浓度高的另一种反应成分做一系列稀释。
免疫组化技术对抗原检测。免疫组化技术近年来得到迅速发展。20 世纪50 年代还仅限于免疫荧光技术,60 年代以后逐渐发展建立起高度敏感,且更为实用的免疫酶技术。特别是过氧化物酶-抗过氧化物酶技术,这是一种具有较高敏感性的新方法。胶体金(银)技术、胶体铁技术也逐渐受到人们的重视。与此同时,亲和细胞化学在免疫组化中占有重要位置,特别是与基因探针、核酸分子杂交、原位PCR 等技术相结合,使免疫组织化学进入一个新的发展阶段。图像分析、流式细胞仪的应用,使免疫细胞化学定量分析技术提高到了更精确的水平。
二、凝集试验
某些微生物颗粒性抗原的悬液与含有相应的特异性抗体的血清混合,在一定条件下,抗原与抗体结合,凝集在一起,形成肉眼可见的凝集物,这种现象称为凝集(图4.11),或直接凝集。凝集中的抗原称为凝集原,抗体称为凝集素。凝集反应是早期建立起来的4 个古典的血清学方法(凝集反应、沉淀反应、补体结合反应、中和反应)之一,在微生物学和传染病诊断中有广泛的应用。按操作方法分为试管法、玻板法、玻片法和微量法等。
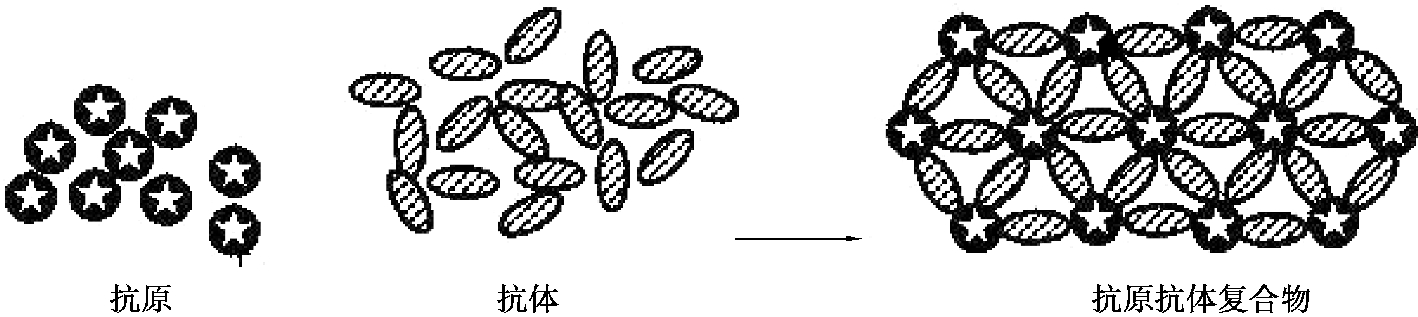
图4.11 凝集试验示意图
(一)直接凝集试验
直接凝集试验是指颗粒性抗原与相应抗体直接结合,在电解质的参与下凝聚成团块的现象。按操作方法可分为平板凝集试验和试管凝集试验。
1.平板凝集试验
平板凝集试验(图4.12)是一种定性试验,可在玻板或载玻片上进行。将含有已知抗体的诊断血清与待检菌悬液各一滴在玻片上混合均匀,数分钟后,若出现颗粒状或絮状凝集,即为阳性反应。反之,也可用已知的诊断抗原悬液检测待检血清中有无相应的抗体。此法简便快速,适用于新分离细菌的鉴定、分型和抗体的定性检测。如大肠杆菌和沙门氏菌等的鉴定,布氏杆菌病、鸡白痢、禽伤寒和败血霉形体病的检疫,也可用于血型的鉴定等。
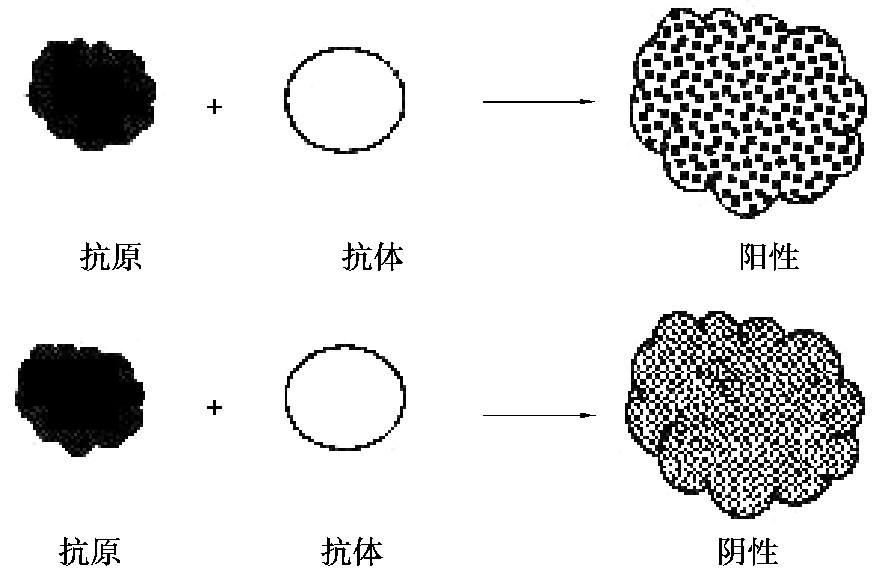
图4.12 平板凝集试验示意图
2.试管凝集试验
试管凝集试验是一种定性和定量试验,可在小试管中进行。操作时将待检血清用生理盐水或其他稀释液作倍比稀释,然后每管加入等量抗原,混匀,37 ℃水浴或放入恒温箱中数小时,观察液体澄清度及沉淀物,根据不同凝集程度记录结果。以出现50%以上凝集的血清最高稀释倍数为该血清的凝集价,也称效价或滴度。本试验主要用于检测待检血清中是否存在相应的抗体及其效价,如布氏杆菌病的诊断与检疫。
(二)间接凝集试验
将可溶性抗原(或抗体)先吸附于与免疫无关的小颗粒的表面,再与相应的抗体(或抗原)结合,在有电解质存在的适宜条件下,可出现肉眼可见的凝集现象(图4.13)。用于吸附抗原(或抗体)的颗粒称为载体。常用的载体有动物红细胞、聚苯乙烯乳胶、硅酸铝、活性炭和葡萄球菌A 蛋白等。抗原多为可溶性蛋白质,如细菌、立克次氏体和病毒的可溶性抗原、寄生虫的浸出液、动物的可溶性物质、各种组织器官的浸出液、激素等,亦可为某些细菌的可溶性多糖。吸附抗原(或抗体)后的颗粒称为致敏颗粒。
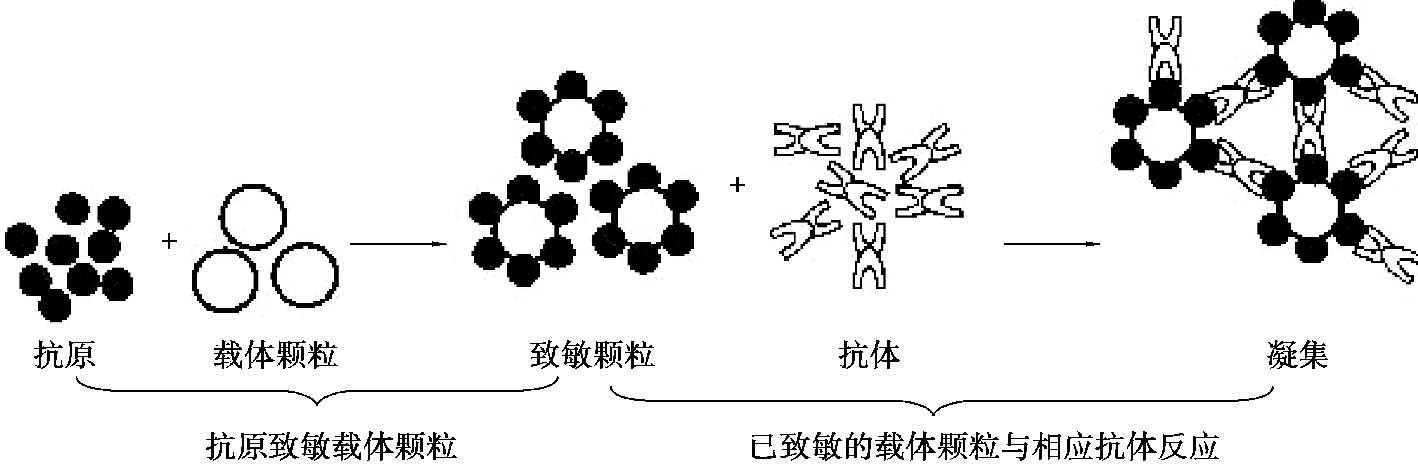
图4.13 间接凝集反应原理示意图
间接凝集试验根据载体的不同,可分为间接血凝试验、乳胶凝集试验、协同凝集试验和炭粉凝集试验等。
1.间接血凝试验
以红细胞为载体的间接凝集试验,称为间接血凝试验。吸附抗原的红细胞称为致敏红细胞。致敏红细胞与相应抗体结合后,能出现红细胞凝集现象。用已知抗原吸附于红细胞上检测未知抗体称为正向间接血凝试验,用已知抗体吸附于红细胞上鉴定未知抗原称为反向间接血凝试验。常用的红细胞有绵羊、家兔、鸡及人的O 型红细胞。由于红细胞几乎能吸附任何抗原,而且红细胞是否凝集容易观察,因此,利用红细胞作载体进行的间接凝集试验已广泛应用于血清学诊断的各个方面,如多种病毒性传染病、霉形体病、衣原体病、弓形体病等的诊断和检疫。
间接血凝抑制试验:抗体与游离抗原结合后就不能凝集抗原致敏的红细胞,从而使红细胞凝集现象受到抑制,这一试验称为间接血凝抑制试验。通常是用抗原致敏的红细胞和已知抗血清检测未知抗原或测定抗原的血凝抑制价。血凝抑制价即抑制血凝的抗原最高稀释倍数(图4.14)。
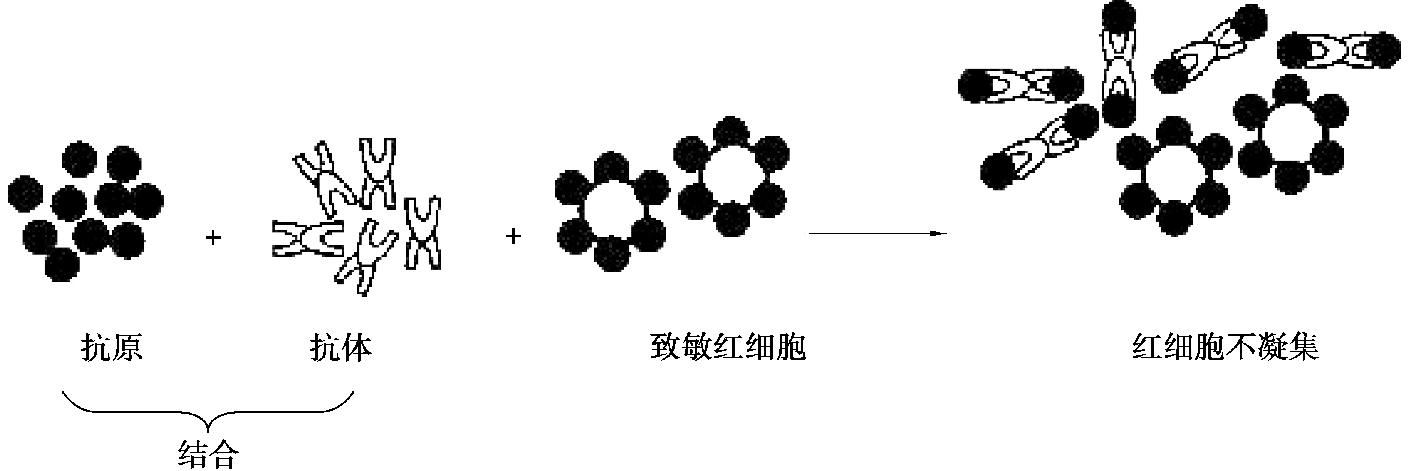
图4.14 间接血凝抑制反应原理示意图
2.乳胶凝集试验
以乳胶颗粒作为载体的间接凝集试验,称为乳胶凝集试验。该试验既可检测相应的抗体,也可鉴定未知的抗原,而且方法简便、快速,在临床诊断中广泛应用于伪狂犬病、流行性乙型脑炎、钩端螺旋体病、猪细小病毒病、猪传染性萎缩性鼻炎、禽衣原体病、山羊传染性胸膜肺炎、囊虫病等的诊断。
3.协同凝集试验
葡萄球菌A 蛋白是大多数金黄色葡萄球菌的特异性表面抗原,能与多种哺乳动物IgG分子的Fc 片段相结合,结合后的IgG 仍保持其抗体活性。当这种覆盖着特异性抗体的葡萄球菌与相应抗原结合时,可以相互连接引起协同凝集反应,在玻板上数分钟内即可判定结果。目前已广泛应用于快速鉴定细菌、霉形体和病毒等。
4.炭粉凝集试验
以极细的活性炭粉作为载体的间接凝集试验,称为炭粉凝集试验。反应在玻板上或塑料反应盘进行,数分钟后即可判定结果。通常是用抗体致敏炭粉颗粒制成碳素血清,用以检测抗原,如马流产沙门氏菌;也可用抗原致敏炭粉,用以检测抗体,如腺病毒感染、沙门氏菌病、大肠杆菌病、囊虫病等的诊断。
三、沉淀试验
可溶性抗原与相应抗体结合,在适量电解质存在下,经过一定时间,出现肉眼可见的白色沉淀,称为沉淀试验。参与试验的抗原称为沉淀原,主要是蛋白质、多糖、类脂等,如细菌的外毒素、内毒素、菌体裂解液、病毒悬液、病毒的可溶性抗原、血清和组织浸出液。反应中的抗体,称为沉淀素。
常用的沉淀试验有环状沉淀试验、絮状沉淀试验、琼脂扩散试验和免疫电泳试验等。
1.环状沉淀试验(https://www.daowen.com)
环状沉淀试验是一种快速检测溶液中的可溶性抗原或抗体的方法。即将可溶性抗原叠加在小口径试管中的抗体表面,数分钟后在抗原抗体相接触的界面出现白色环状沉淀带,即为阳性反应。本法主要用于抗原的定性试验,如炭疽病的诊断(Ascoli 氏试验)、链球菌的血清型鉴定和血迹鉴定等(图4.15)。
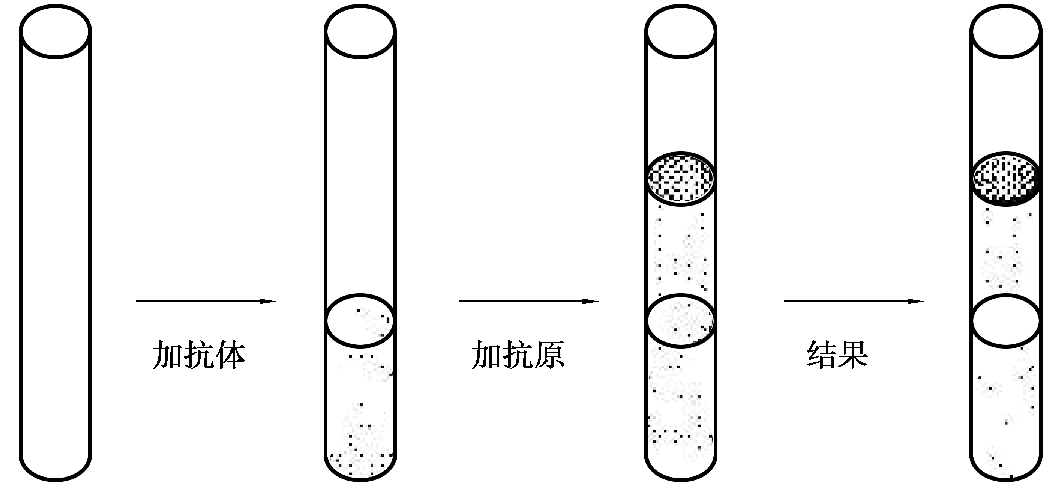
图4.15 环状沉淀反应原理示意图
2.絮状沉淀试验
抗原与抗体在试管内混合,在电解质存在下,抗原抗体复合物可形成絮状物。当比例最适时,出现反应最快和絮状物最多。本法常用于毒素、类毒素和抗毒素的定量测定。
3.琼脂扩散试验
琼脂扩散试验简称琼扩。抗原抗体在含有电解质的琼脂凝胶中扩散,当两者在比例适当处相遇时,即发生沉淀反应,出现肉眼可见的沉淀带,称为琼脂扩散试验。
琼脂扩散试验有单向单扩散、单向双扩散、双向单扩散和双向双扩散4 种类型。最常用的是双向双扩散。
(1)单向单扩散。单向单扩散,即在冷至45 ℃左右质量分数为0.5%~1%的琼脂中加入一定量的已知抗体,混匀后加入小试管中,凝固后将待检抗原加于其上,置密闭湿盒内,于37 ℃温箱或室温扩散数小时,抗原在含抗体的琼脂凝胶中扩散,在比例最适处出现沉淀带。此沉淀带的位置随着抗原的扩散而向下移动,直至稳定。抗原浓度越大,则沉淀带的距离也越大,因此可用于抗原定量。
(2)单向双扩散。单向双扩散在小试管内进行。先将含有抗体的琼脂加于管底,中间加一层不含抗体的同样浓度的琼脂,凝固后加待检抗原,置密闭湿盒内,于37 ℃温箱或室温扩散数日。抗原抗体在中间层相向扩散,在比例最适处形成沉淀带。此法主要用于复杂抗原的分析,目前较少应用。
(3)双向单扩散。双向单扩散,即在冷至45 ℃左右质量分数为2%的琼脂中加入一定量的已知抗体,制成厚2~3 mm 的琼脂凝胶板,在板上打孔,孔径3 mm,孔距10~15 mm,于孔内滴加抗原后,置密闭湿盒内,37 ℃温箱或室温进行扩散。抗原在孔内向四周辐射扩散,与琼脂凝胶中的抗体接触形成白色沉淀环,环的大小与抗原浓度呈正比。本法可用于抗原的定量和传染病的诊断,如马立克氏病的诊断。
(4)双向双扩散。双向双扩散,即用质量分数为1%的琼脂制成厚2~3 mm 的凝胶板,在板上按规定图形、孔径和孔距打圆孔,于相应孔内滴加抗原、阳性血清和待检血清,放于密闭湿盒内,置37 ℃温箱或室温扩散数日,观察结果。
当用于检测抗原时,将抗体加入中心孔,待检抗原分别加入周围相邻孔,若均出现沉淀带且完全融合,说明是同种抗原;若两相邻孔沉淀带有部分相连并有交角,表明二者有共同抗原决定簇;若两相邻孔沉淀带互相交叉,说明二者抗原完全不同(图4.16)。
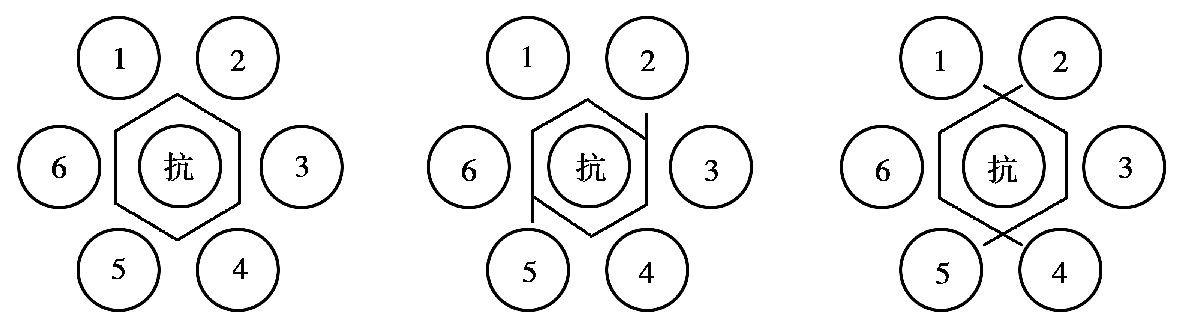
图4.16 双向双扩散用于检测抗原结果判定
抗—抗体;1、2、3、4、5、6—被检抗原
当用于检测抗体时,将已知抗原置于中心孔,周围1、2、3、4 孔分别加入待检血清,其余两对应孔加入标准阳性血清,若待检血清孔与相邻阳性血清孔出现的沉淀带完全融合,则判为阳性;若待检血清孔无沉淀带或出现的沉淀带与相邻阳性血清孔出现的沉淀带相互交叉,判为阴性;若待检血清孔无沉淀带,但两侧阳性血清孔的沉淀带在接近待检血清孔时向内弯曲,判为弱阳性,而向外弯曲,则判为阴性(图4.17)。
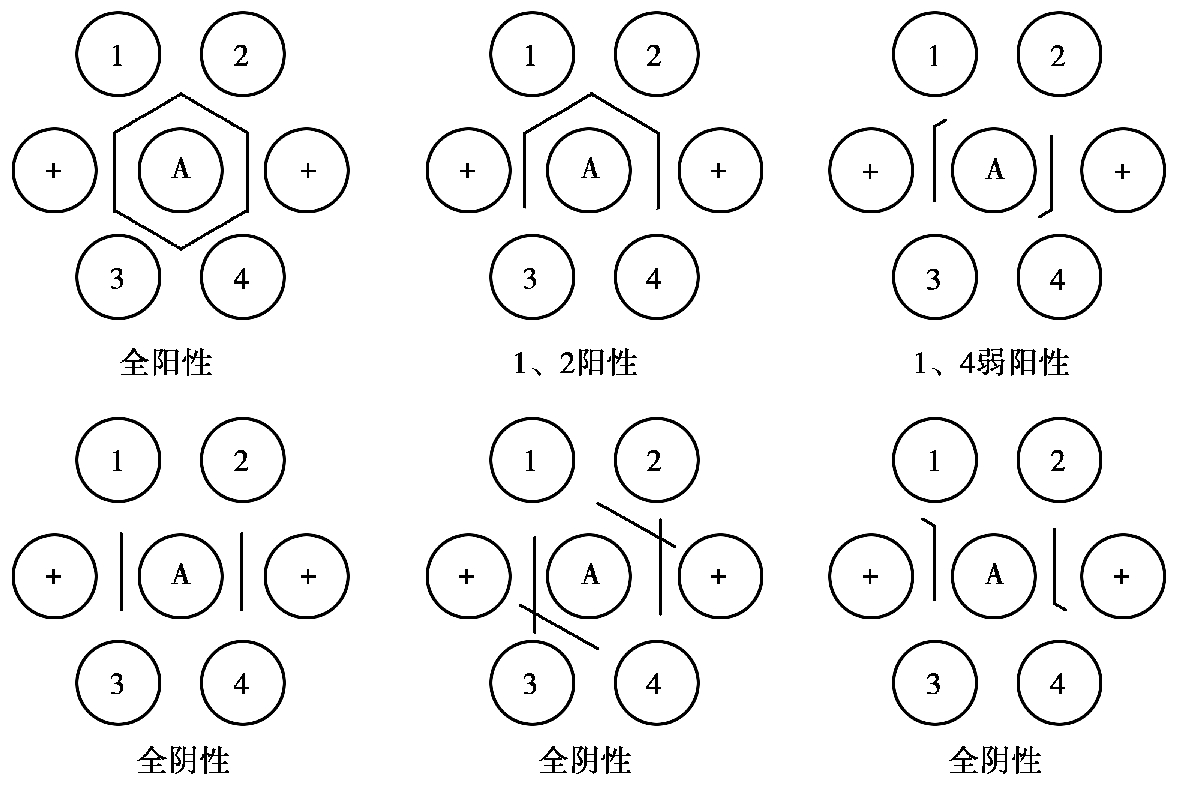
图4.17 双向双扩散用于检测抗体结果判定
A—抗原;+—阳性血清;1、2、3、4—被检血清
本法应用广泛,已普遍用于传染病的诊断和抗体的检测,如鸡马立克氏病、鸡传染性法氏囊炎、禽流感、霉形体病、鸡传染性喉气管炎、伪狂犬病、牛地方性白血病、马传染性贫血和蓝舌病等。
4.免疫电泳技术
免疫电泳技术是将琼脂双扩散与琼脂电泳技术两种方法结合起来的一种血清学检测技术。临床上应用比较广泛的有对流免疫电泳和火箭免疫电泳。
(1)对流免疫电泳。对流免疫电泳是在电场的作用下,利用抗原抗体相向扩散的原理,使抗原抗体在电场中定向移动,限制了双向双扩散时抗原、抗体向多方向的自由扩散,可以提高试验的敏感性,缩短反应时间。试验时,在pH 值为8.6 的琼脂凝胶板上打孔,两孔为一组,孔径为3 mm,抗原、抗体孔间距为4~5 mm。将抗原加入负极端孔内,抗体加入正极端孔内,用2~4 mA/cm 电流电泳1 h 左右,观察结果,在两孔之间出现沉淀带的为阳性反应。沉淀带出现的位置与抗原抗体的泳动速度及含量有关,当二者平衡时所形成的沉淀带在两孔之间,呈一直线。若二者泳动速度悬殊,则沉淀带位于对应孔附近,呈月牙形。当抗原或抗体含量过高时,可使沉淀带溶解。因此,对每份检样应选2~3 个稀释度进行试验(图4.18)。
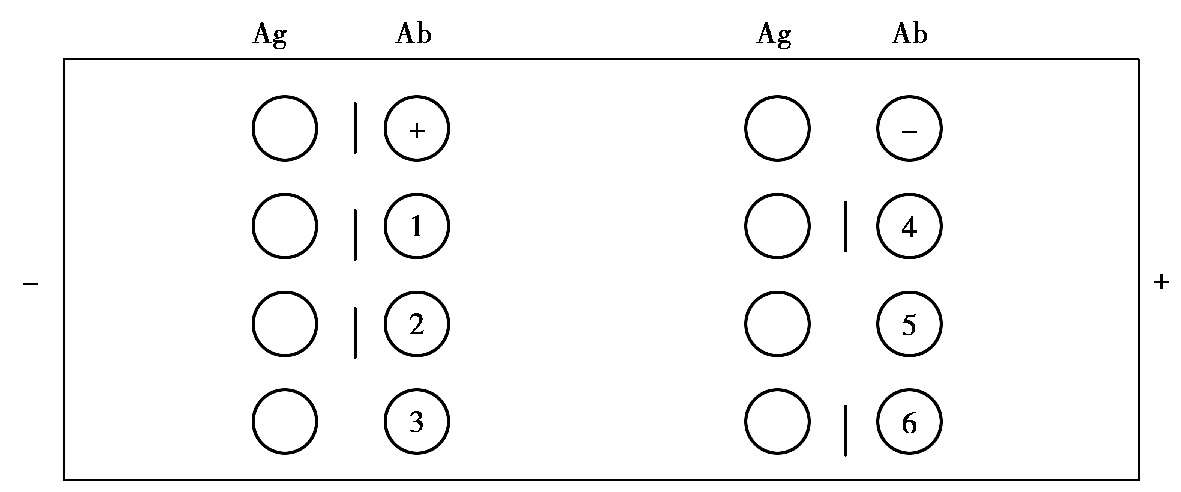
图4.18 对流免疫电泳示意图
Ag—抗原;Ab—抗体;+—阳性血清;-—阴性血清;1、2、3、4、5、6—待检血清
(2)火箭免疫电泳。火箭免疫电泳是单向单扩散和电泳技术相结合的一种血清学试验。它是让抗原在电场的作用下,在含有抗体的琼脂中定向泳动,二者比例合适时形成类似火箭样的沉淀峰。沉淀峰的高度与抗原的浓度成正比(图4.19)。
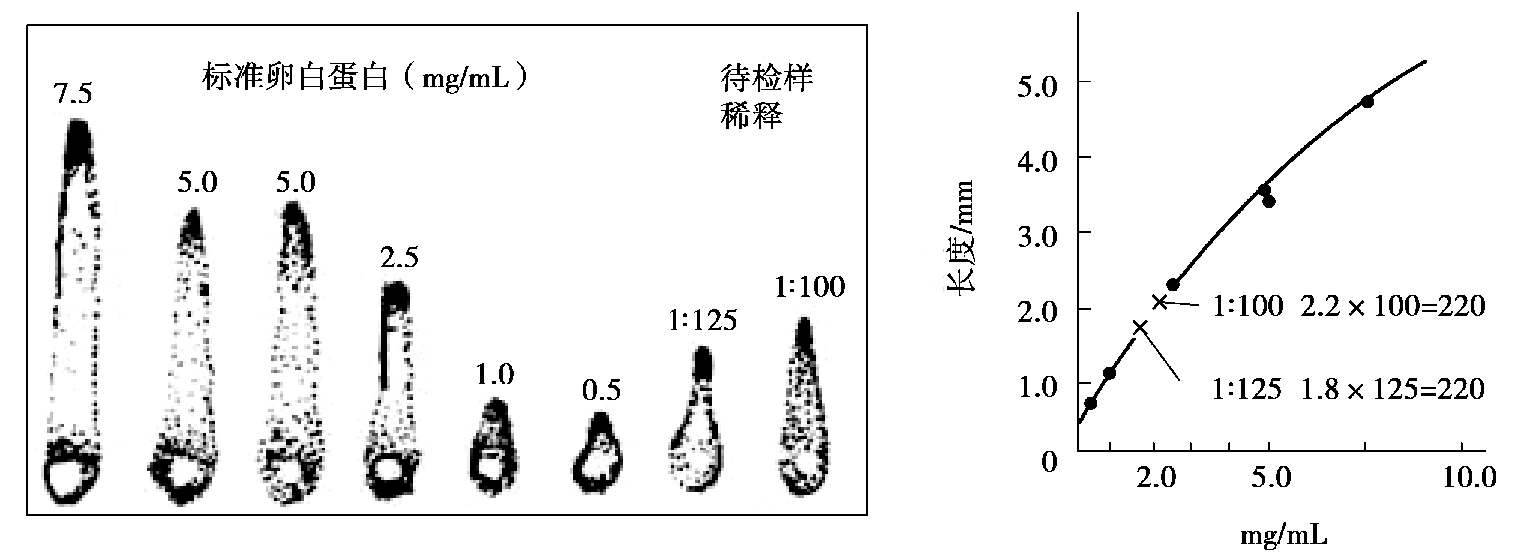
图4.19 火箭免疫电泳
琼脂凝胶中抗血清量1∶15,抗原量每孔2 μL,2.5 mA/cm 电泳5 h
试验时,在冷至56 ℃左右的巴比妥缓冲液琼脂中加入一定量的已知抗体,制成琼脂凝胶板。在板的负极端打一排孔,孔径3 mm,孔距8 mm,然后滴加待检抗原和已知抗原,以2~4 mA/cm 电流电泳1~5 h。若抗原与抗体比例合适,则孔前出现顶端完全闭合的火箭状沉淀峰;抗原大量过剩时或不形成沉淀峰,或沉淀峰不闭合;抗原中等过剩时沉淀峰呈圆形;当二者比例不适当时,常不能形成火箭状沉淀峰。
四、补体结合试验
补体结合试验是应用可溶性抗原如蛋白质、多糖类、脂质、病毒等,与相应抗体结合后,其抗原抗体复合物可以结合补体。但这一反应肉眼看不到,只有在加入一个指示系统即溶血系统的情况下,才能判定。参与反应的抗体主要是IgG 和IgM。
(一)补体结合试验的原理
补体结合试验有溶菌和溶血两大系统,含抗原、抗体、补体、溶血素和红细胞5 种成分。补体没有特异性,能与任何一组抗原抗体复合物结合,如果与细菌及相应抗体形成的复合物结合,就会出现溶菌反应;而与红细胞及溶血素形成的致敏红细胞结合,就会出现溶血反应。
试验时,首先将抗原、待检血清和补体按一定比例混匀后,保温一定时间,然后再加入红细胞和溶血素,作用一定时间后,观察结果。不溶血为补体结合试验阳性,表示待检血清中有相应的抗体,抗原抗体复合物结合了补体,加入溶血系统后,由于无补体参加,因此不溶血。溶血则为补体结合试验阴性,说明待检血清中无相应的抗体,补体未被抗原抗体复合物结合,当加入溶血系统后,补体与溶血系统复合物结合而出现溶血反应(图4.20)。
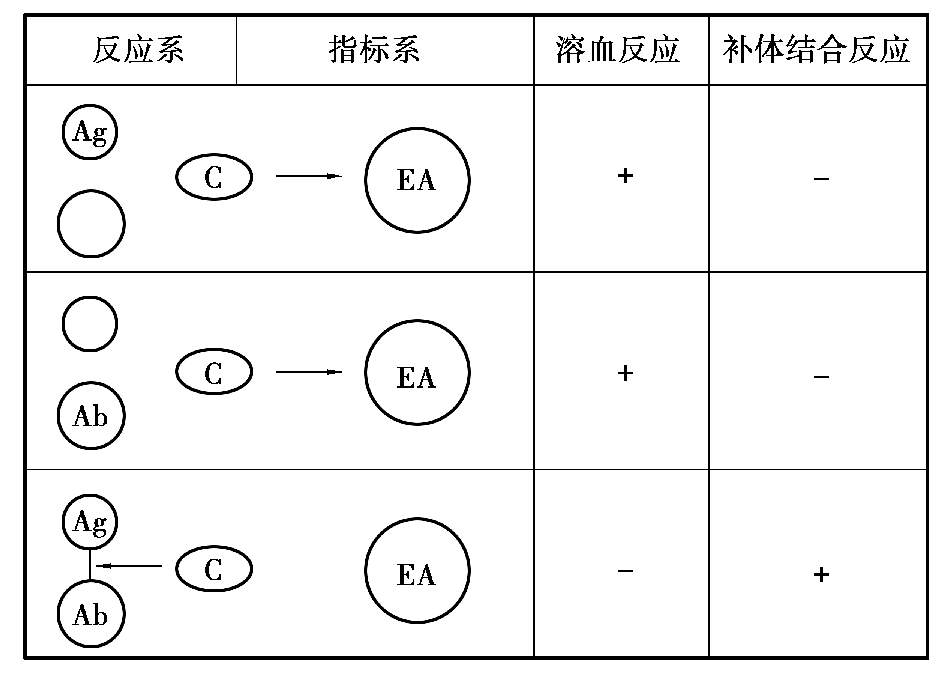
图4.20 补体结合反应原理示意图
Ag—抗原;Ab—抗体;C—补体;EA—致敏红细胞
(二)补体结合试验的应用
补体结合试验可用于检测未知抗原或抗体,生产上用于多种传染病(如口蹄疫、水泡病、副结核病、山羊传染性胸膜肺炎、禽衣原体病等)的诊断及抗原的定型。但由于操作较烦琐,影响因素较多,已逐渐被其他简易敏感的试验所替代。
五、中和试验
病毒或毒素与相应抗体结合后,丧失了对易感动物、鸡胚和易感细胞的致病力,称为中和试验。本试验具有高度的特异性和敏感性,并有严格量的要求。
(一)毒素和抗毒素中和试验
由外毒素或类毒素刺激机体产生的抗体,称为抗毒素。抗毒素能中和相应的毒素,使其失去致病力。主要有以下两种方法。
体内中和试验,一种是将一定量的抗毒素与致死量的毒素混合,在恒温下作用一定时间后,接种实验动物,同时设不加抗毒素的对照组。如果试验组的动物被保护,而对照组的动物死亡,即证明毒素被相应抗毒素中和。在兽医临床上,常用于魏氏梭菌和肉毒梭菌毒素的定型。做此试验时,首先要测定毒素的最小致死量或半数致死量。另一种是在细胞培养上进行的毒素中和试验和溶血毒素中和试验。方法同第一种。
(二)病毒中和试验
病毒免疫动物所产生的抗体,能与相应病毒结合,使其感染性降低或消失,从而丧失致病力。应注意,抗体只能在细胞外中和病毒,对已进入细胞的病毒则无作用。而且抗体并不都有中和活性,有些抗体与病毒结合后不能使其失活,如马传染性贫血病毒与相应抗体结合后,仍保持高度的感染力。试验有体内和体外两种方法。
1.体内中和试验
体内中和试验也称保护试验,即先给实验动物接种疫苗或抗血清,间隔一定时间后,再用一定量病毒攻击,视动物是否得到保护来判定结果。常用于疫苗免疫原性的评价和抗血清的质量评价。
2.体外中和试验
体外中和试验是将病毒悬液与抗病毒血清按一定比例混合,在一定条件下作用一段时间,然后接种易感动物、鸡胚或易感细胞,根据接种后动物、鸡胚是否得到保护,细胞是否有病变来判定结果。此试验常用于病毒性传染病的诊断,如口蹄疫、猪水疱病、蓝舌病、牛黏膜病、牛传染性鼻气管炎、鸡传染性喉气管炎、鸭瘟和鸭病毒性肝炎等的诊断。此外,还可用于新分离病毒的鉴定和定型等。
六、免疫标记技术
抗原抗体的结合具有高度特异性,其反应强度与抗原或抗体的量有关。在反应量不足或抗原为半抗原、抗体为单价抗体时,肉眼不易察出。有一些物质即使在含量极微时,仍能用某种特殊的理化测试仪器将其检测出来。如将这些物质标记在抗体或抗原分子上,它就能追踪抗原或抗体并与之结合,通过化学或物理的手段使不可见的反应放大、转化为可见的、可测知的、可描记的光、色、电、脉冲等信号。根据抗原抗体结合的特异性和标记分子的敏感性建立的试验技术,称为免疫标记技术。主要有荧光抗体技术、酶标记抗体技术、放射免疫技术等。这些技术可用于检测抗原或抗体,其特异性和敏感性远远高于常规的血清学技术。以下着重介绍荧光抗体技术和酶标记抗体技术。
(一)荧光抗体技术
荧光抗体技术,又称免疫荧光技术,是用荧光色素对抗体或抗原进行标记,再与相应抗原或抗体结合,然后在荧光显微镜下观察荧光以分析示踪相应的抗原或抗体的方法。本法既有免疫学的特异性和敏感性,又有借助显微镜观察的直观性与精确性,已广泛应用于细菌、病毒、原虫等的鉴定和传染病的快速诊断。
1.荧光色素的选择
用于标记抗体或抗原的荧光色素必须具有活性基团,使之易与蛋白质稳定结合;能发射可见的荧光颜色,荧光效率高;性质较稳定,不影响抗体或抗原的免疫活性以及抗原与抗体的特异性结合。目前,广泛用于标记抗体或抗原的荧光色素主要是异硫氰酸荧光素(FITC)。此外,还有四乙基罗丹明(RB 200)、四甲基异硫氰酸罗丹明(TMRITC)和三氯三嗪基氨基荧光素(DTAF)等。
2.(标)片的制备
根据被检样品的性质不同,可采取不同的制备方法。细菌培养物、感染动物的组织或血液、脓汁、粪便和尿沉渣等,可制备涂片或压印片,感染组织还可制备冰冻切片或低温石蜡切片。对于病毒,也可用生长在盖玻片上的单层细胞培养物做标本。标本的固定,常用丙酮和95%的乙醇。固定后的标本应随即用PBS 反复冲洗,干燥后即可染色。
3.染色方法
荧光抗体染色方法有直接法和间接法。
(1)直接法。用荧光抗体直接检查抗原。即直接滴加相应荧光抗体于标本区,置湿盒内,于37 ℃温箱染色30~60 min 后取出,用0.01 mol/LPBS(pH 值为7.2~7.4)充分漂洗3次,每次3~5 min,再用蒸馏水漂洗2 次,每次1~2 min,吹干,然后滴加缓冲甘油封片,即可于荧光显微镜下观察(图4.21)。
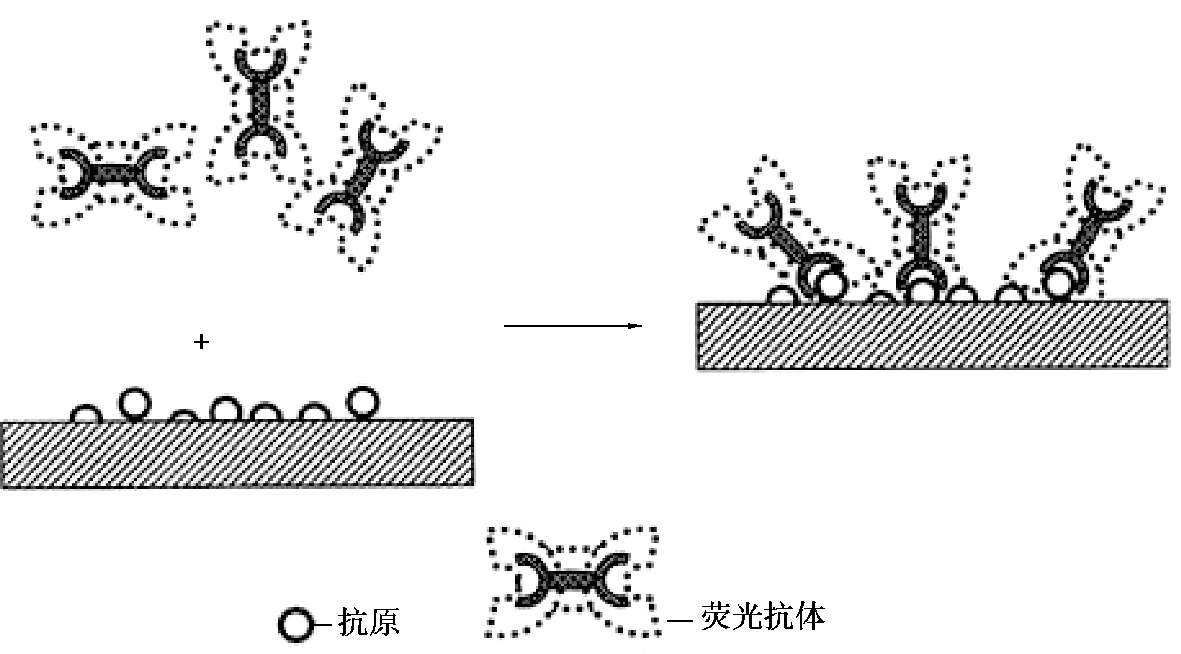
图4.21 直接荧光抗体染色法示意图
(2)间接法。先将已知未标记的抗体加到未知抗原上,或用未知未标记抗体加到已知抗原上,再加相应的荧光抗体。如抗原与抗体发生反应,则抗体被固定,并与荧光抗体结合,发出荧光,从而可鉴定未知的抗原或抗体。试验时,于标本区滴加未标记的相应抗体;置湿盒内,于37 ℃温箱作用30~60 min,取出后以0.01 mol/LPBS(pH 值为7.2~7.4)充分漂洗3次,每次3~5 min;再用蒸馏水漂洗2 次,每次1~2 min,吹干;然后滴加荧光抗体,置湿盒内,于37 ℃温箱染色30 min;再如前漂洗、吹干,滴加缓冲甘油封片、镜检。
间接法的优点是比直接法敏感,对一种动物而言,只需制备一种荧光抗体,即可用于多种抗原或抗体的检测,镜检所见的荧光也比直接法明亮。
4.荧光显微镜检查
用FITC 标记抗体染色标本在荧光显微镜的蓝紫光或紫外光的照射下,抗原所在部位发出黄绿色荧光。
(二)酶标记抗体技术
酶标记抗体技术又称免疫酶技术,是利用抗原抗体结合的特异性和酶的高效特异的催化作用显色而建立起来的免疫检测技术。常用的标记酶是辣根过氧化物酶(HRP),其作用底物为过氧化氢,催化时需要供氢体,无色的供氢体氧化后生成有色产物,使不可见的抗原抗体反应转化为可见的呈色反应。常用的供氢体有3,3′k-二氨基联苯胺(DAB)和邻苯二胺(OPD),前者反应后形成不溶性的棕色物质,适用于免疫酶组化法;后者反应后形成可溶性的橙色产物,敏感性高,易被酸终止反应,呈现的颜色可数小时不变,是ELISA 中常用的供氢体。下面主要介绍免疫酶组化技术、酶联免疫吸附试验和斑点酶联免疫吸附试验。
1.免疫酶组化技术
免疫酶组化技术又称免疫酶染色法,是将免疫酶应用于组织化学染色,以检测组织和细胞中或固相载体上抗原或抗体的存在及其分布位置的技术。方法有直接法和间接法两种(图4.22)。
(1)直接法。用酶标记抗体直接处理含待检抗原的标本,洗涤后浸于含有过氧化氢和DAB 的显色液中作用,然后在普通光学显微镜下观察颜色反应,抗原所在部位呈棕黄色。
(2)间接法。含待检抗原的标本先用未标记的抗血清处理,洗涤后加相应的酶标记抗抗体,洗涤,然后浸于含有过氧化氢和DAB 的显色液中作用,普通光学显微镜下观察颜色反应,抗原所在部位呈棕黄色。
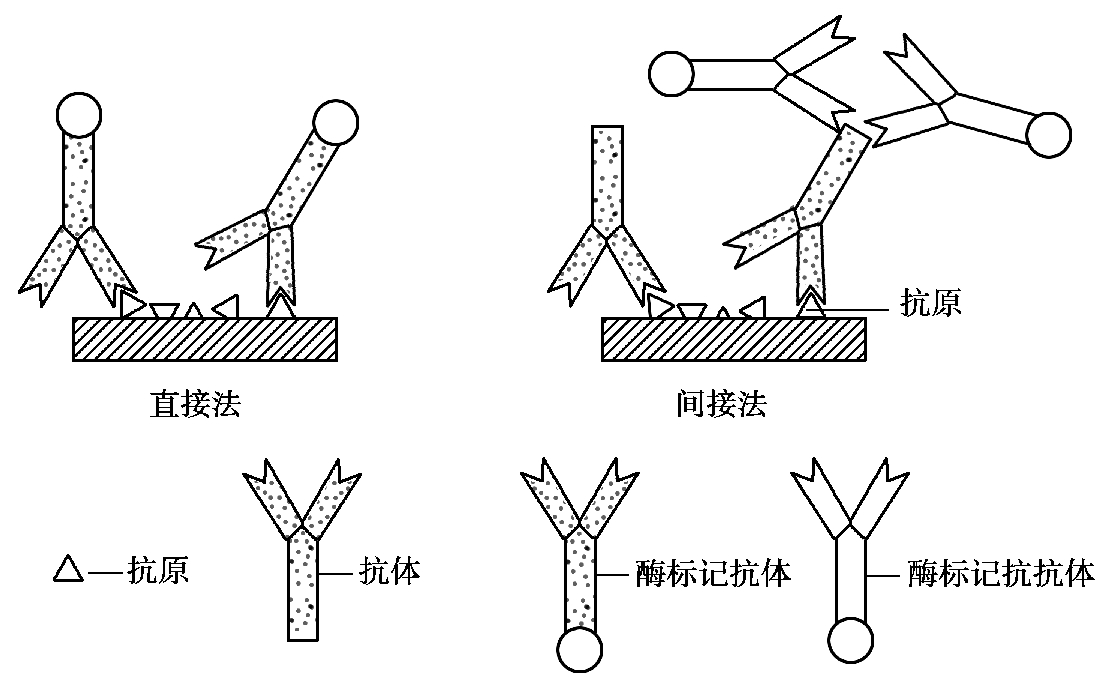
图4.22 酶标记抗体法示意图
2.酶联免疫吸附试验
酶联免疫吸附试验,简称ELISA,为一种固相免疫酶测定技术,是当前应用最广、发展最快的一项新技术。其基本过程是将抗原或抗体吸附于固相载体的表面,酶标记物与相应的抗体或抗原反应后,形成酶标记抗原抗体复合物,在遇到相应底物时,复合物上的酶催化底物使其水解、氧化或还原成可溶性或不溶性的有色物质,可用肉眼或酶标测定仪判定结果。颜色的深浅与相应的抗体或抗原含量成正比,因此,可对抗体或抗原进行定量测定。目前多采用ELISA 试剂诊断盒进行检测。本试验广泛用于猪瘟、猪传染性胃肠炎、猪呼吸与繁殖综合征、流行性乙型脑炎、伪狂犬病、弓形虫病、旋毛虫病和鸡新城疫等传染病的诊断。
3.斑点酶联免疫吸附试验
斑点酶联免疫吸附试验是近几年创建的一项免疫酶新技术,不仅保留了常规ELISA 的优点,而且还弥补了抗原或抗体对载体包被不牢等缺点,以其独特的优势,广泛用于猪瘟、猪伪狂犬病、猪细小病毒病、牛副结核、马传染性贫血等多种传染病的抗原和抗体的检测以及杂交瘤细胞的筛选。其原理是以纤维素薄膜为固相载体,在膜上进行免疫酶反应。先将抗原或抗体吸附在纤维素膜的表面,通过相应的抗体或抗原和酶标记物的一系列反应,形成酶标记抗原抗体复合物,加入底物后,结合物上的酶催化底物使其水解、氧化成另一种带色物质,沉着于抗原抗体复合物吸附部位,呈现出肉眼可见的颜色斑点,试验结果可通过颜色斑点的出现与否和色泽深浅进行判定。
免疫酶技术是血清学试验中最为完善的一类免疫检测技术,可用于抗原或抗体的定性、定量和定位分析,而且具有敏感、特异、简便、快速、易标准化和商品化等优点。
