一、摩尔
2026年01月14日
一、摩尔
物质的量像长度、质量、时间、电流等物理量一样,也是一种物理量,它的符号为n。通过物质的量可以把物质的宏观量(如质量、体积)与分子、原子或离子等微观粒子的数目联系起来。物质的量是表示物质所含粒子数目多少的物理量,基本单位是摩尔,简称“摩”,符号为 mol。
国际上规定,1 mol任何物质所含的粒子的数目和0.012 kg 12C(一种碳原子)中所含的原子数目相等。实验表明,0.012 kg 12C中约含有6.02×1023个 12C原子,6.02×1023 mol-1被称为阿伏伽德罗[1]常数,用符号NA表示。也就是说,任何含有6.02×1023个粒子的集合体,其物质的量都是1 mol。例如:
1 mol O2含有6.02×1023个O2分子;
1 mol O含有6.02×1023个O原子;
1 mol H2O含有6.02×1023个H2O分子;
1 mol Na+含有6.02×1023个Na+。
由此可知,物质的量(n)、阿伏伽德罗常数(NA)以及粒子数目(N)之间存在着如下关系:(https://www.daowen.com)
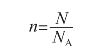
根据此式可以进行物质的量与粒子数目之间的换算。例如,可以得出0.5 mol水分子中含有3.01×1023个水分子,1 mol氧原子和1 mol铁原子所含有的原子个数一样。
应当注意:①描述物质的量时,必须指明粒子的种类;②物质的量是一个集合体,不可分开。
练一练
1.1 mol NaCl中含有__________Na+和___________Cl-。
2.9.03×1023个H2O中,含有__________mol的H2O分子、___________mol的O原子、__________mol的H原子。
3.1.5 mol 12C中有____________个12C原子。
