任务解析
2026年01月14日
任务解析
一、乙炔的制备
1.实验室制取乙炔的化学反应如下:
![]()
2.本实验反应装置不用启普发生器,而是用圆底烧瓶和分液漏斗。原因如下:
(1)碳化钙与水反应较剧烈,难以控制反应速率。
(2)当关闭启普发生器导气管上的活塞使液态水和固体电石分离后,电石与水蒸气的反应还在进行,不能达到“关之即停”的目的。
(3)反应放出大量的热,启普发生器是厚玻璃仪器,容易因受热不均而炸裂。
(4)生成物Ca(OH)2微溶于水,易形成糊状泡沫,堵塞导气管与球形漏斗。
3.实验中用块状电石是为了减小电石的表面积,使反应慢一点,以得到平稳的乙炔气流。(https://www.daowen.com)
4.实验中常用饱和食盐水代替水的目的是降低水的含量,得到平稳的乙炔气流。
5.纯净的乙炔是无色、无味的气体。用电石和水反应制取的乙炔,常闻到有恶臭气味,这是因为在电石中含有少量硫化钙、砷化钙、磷化钙等杂质,与水作用时生成的H2S、AsH3、PH3等气体有特殊的气味。硫酸铜溶液则可以除去H2S、PH3等杂质。
6.浓硫酸和碱石灰的作用是干燥乙炔。碱石灰除了能够吸收水分,还可以吸收乙炔中的杂质H2S。
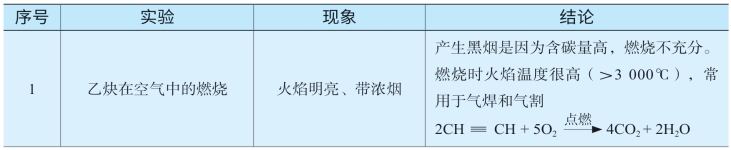
二、乙炔的性质实验
表6-7 乙炔的性质实验
(续表)