任务解析
2026年01月14日
任务解析
一、溴苯的制备
1.制备溴苯的实验原理:
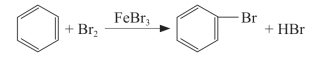
2.此反应生成了HBr,HBr极易溶于水,溶液显酸性,从而使石蕊溶液变红;而HBr溶于水后游离出的Br-与AgNO3反应,生成AgBr浅黄色沉淀。
3.生成的HBr最终由NaOH溶液吸收。
![]()
4.实验中当打开F,关闭C时,由于三颈烧瓶中继续反应生成的HBr极易溶于水,迅速被广口瓶内的水吸收,随着反应减慢,导致三颈烧瓶内的气压过低,水倒吸入三颈烧瓶中。又因为三颈烧瓶中生成的溴苯不溶于水,且密度大于水,从而与倒吸进来的水出现分层现象,上层为水,下层为溴苯。
5.溴苯的提纯:纯净的溴苯是无色的液体,若将三颈烧瓶中液体倒入盛有水的烧杯中,烧杯底部是油状的褐色液体,说明溴苯中溶有溴。可以加入NaOH溶液,摇匀、静置,杂质溶解在了上部水层里,用分液漏斗分液,即可得到较纯净的溴苯。(https://www.daowen.com)
二、苯的性质实验
1.苯与酸性高锰酸钾溶液不发生化学反应,由于苯难溶于水,因此两者混合会出现分层,上层是无色的苯,下层还是紫色的酸性高锰酸钾溶液。
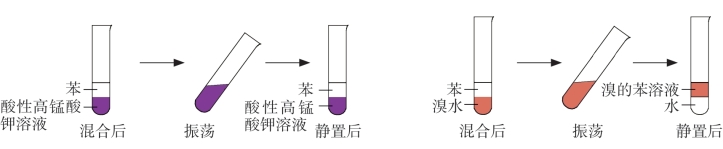
图6-23 苯滴入酸性高锰酸钾溶液和溴水中
2.苯和溴水也不发生化学反应,但由于溴在苯中的溶解度大于其在水中的溶解度,所以苯能将溴水中的溴萃取出来,两者混合也发生分层,下层的溴水层褪色,上层的苯层变为红棕色。
想一想
若将苯滴入溴的四氯化碳溶液中,会发生什么现象?
