原子核外电子排布
想一想
我们已经知道,原子是由原子核和核外电子构成的,原子核体积很小,仅占原子体积的几千亿分之一,电子是质量很小的带负电荷的微粒,它们在原子这样小的空间做高速运动。那么,它们的运动跟普通物体有什么区别?有什么特殊的规律?
1.电子云
科学研究发现,电子的运动不遵循宏观物体所具有的运动规律,它没有确定的运动轨道,我们不能测定或计算它在某一时刻所在的位置,也不能描述它的运动轨迹。于是,科学家采用统计的方法描述电子在原子核外某一区域出现的机会。若用小黑点代表电子出现过的地方,小黑点的疏密程度就代表电子在核外出现概率的大小,在化学上称之为电子云。
需要注意的是,电子云中许许多多的小黑点并不代表电子本身,它只是形象地表明电子在核外空间出现的统计情况。
2.原子核外电子的排布规律
在含有多个电子的原子中,由于电子的能量并不相同,因此它们在原子核外是分层排布的。能量低的电子通常在离核较近的区域内运动,能量高的电子通常在离核较远的区域运动。我们通常用电子层来表明这种离核远近的不同区域。电子层由内向外依次分为七层,用符号n表示,则n=1、2、3、4、5、6、7,也可以依次用K、L、M、N、O、P、Q等符号来表示。n值越小,表明电子离原子核越近,其能量越低;n值越大,表明电子离原子核越远,其能量越高。
科学研究发现,核外电子总是先排布在能量最低的电子层上,只有当能量最低的电子层排满后,才依次排入能量较高的电子层上。即按照K、L、M……电子层的顺序,先后依次排满电子。

图5-5 氢原子的电子云
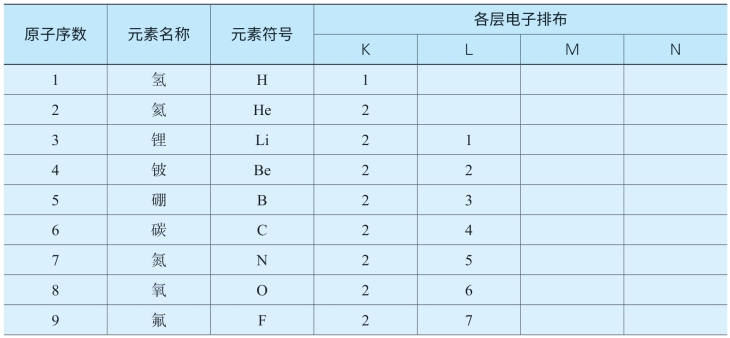
表5-3 原子序数为1~20的元素原子核外电子的排布
(续表)
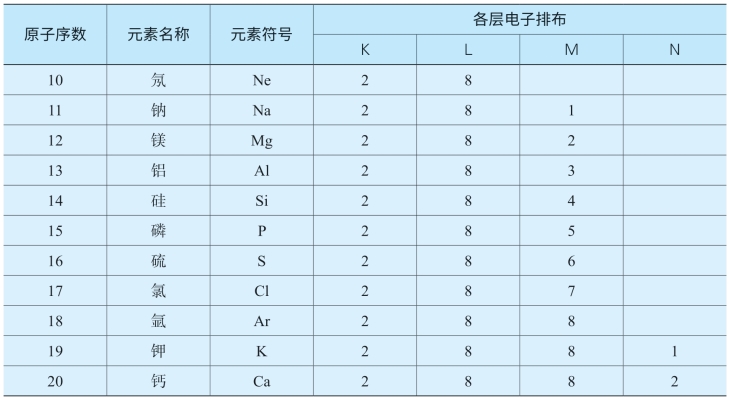
从上表可以看出,核外电子分层排布是有一定规律的,我们可以将其归纳如下:
1.各电子层最多容纳的电子数目为2n2。
K层(n=1)可容纳电子数为2×12=2个;(https://www.daowen.com)
L层(n=2)可容纳电子数为2×22=8个;
M层(n=3)可容纳电子数为2×32=18个;
N层(n=4)可容纳电子数为2×42=32个。以此类推。
2.最外层电子数目不超过8个(K层为最外层时不超过2个)。
3.次外层电子数目不超过18个,倒数第三层电子数目不超过32个。
以上规律是相互联系的,不能孤立地理解。例如,当M层不是最外层时,最多可以排布18个电子,但当它是最外层时,则最多可以排布8个电子。
资料在线
电子亚层
在同一电子层中,电子能量还有微小的差异,电子云形状也不相同,根据这些差别把一个电子层分为一个或n个电子亚层。K 层只包含一个s亚层;L层包含s和p两个亚层;M层包含s、p、d三个亚层;N层包含s、p、d、f四个亚层。不同亚层的电子云形状不同,s亚层的电子云形状为球形对称;p亚层的电子云为无柄哑铃形(纺锤形);d亚层的电子云为十字花瓣形等。同一电子层不同亚层的能量按s、p、d、f顺序能量逐渐升高。
知道了原子的核电荷数和电子层排布规律之后,我们可以据此画出原子结构示意图。通常,用小圆圈代表原子核,+X表示核电荷数,弧线表示电子层,弧线上的数字表示该电子层上的电子数目。例如,
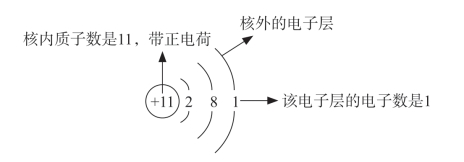
图5-6 钠原子的原子结构示意图
现将1~18号元素的原子结构示意图表示如下:
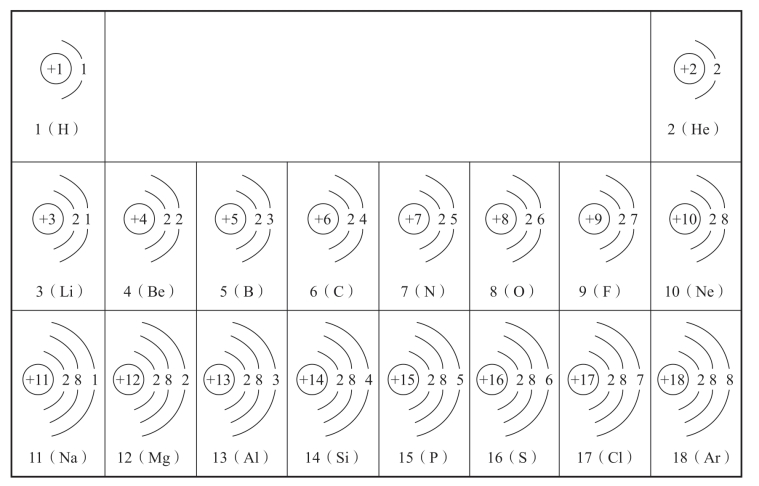
图5-7 1~18号元素原子结构示意图
练一练
根据以上所学,尝试画出19、20号元素的原子结构示意图。
