实验步骤
一、铁及其化合物的性质
1.铁与酸和盐溶液的置换反应
向2支试管中分别加入3 mL稀盐酸和硫酸铜溶液,再各投入一枚去锈的铁钉,观察现象,写出反应的化学方程式。
2.铁的氢氧化物制备与性质
向一支试管中加入少量FeCl3溶液,再滴入NaOH溶液。观察并描述发生的现象。
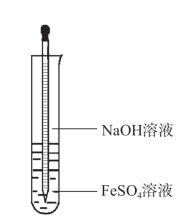
图4-20 氢氧化亚铁的生成
向另一支试管中加入少量新制备的FeSO4溶液,用胶头滴管吸取NaOH溶液,将滴管伸入试管底部(如图4-20),慢慢挤出NaOH溶液,观察发生的现象。实验后立即用稀盐酸、蒸馏水洗净滴管。
3.Fe3+的检验
向2支试管中分别加入3 mL FeSO4溶液和3 mL FeCl3溶液,各滴入几滴KSCN溶液,观察并记录实验现象。
4.铁盐和亚铁盐的相互转化(https://www.daowen.com)
在盛有3 mL FeCl3溶液的试管里,加入适量盐酸酸化,然后再加入少量铁粉,振荡试管(注意观察溶液颜色的变化),待充分反应后,滴加几滴KSCN溶液,观察实验现象。把上层清液倒入另一支试管里,再逐滴滴入新制备的氯水,待充分反应后,再滴加几滴KSCN溶液,观察溶液颜色的变化。请解释实验现象并写出反应的化学方程式。
5.自行设计实验检验补铁药品中是否存在铁元素并确定其价态提示:
(1)Fe3+与SCN-反应溶液呈红色。
(2)Fe2+可以被氯气、高锰酸钾等氧化剂氧化成Fe3+。
二、铜及其化合物的性质
1.铜丝加热
取一段光亮的铜丝,观察它的颜色。然后用坩埚钳夹住铜丝,在酒精灯上加热,观察铜丝的变化,写出有关反应的化学方程式。
2.氢氧化铜的性质
取一支试管,加入2 mL CuSO4溶液,再逐滴加入NaOH溶液,至产生大量沉淀时,将溶液分成两份,一份逐滴加入稀盐酸溶液,一份继续逐滴加入NaOH溶液,观察现象并解释。
3.CuSO4与CuSO4·5H2O的转化
取适量CuSO4·5H2O于试管中,用酒精灯加热,观察现象。
