实验步骤
2026年01月14日
实验步骤
一、钠的性质
1.用镊子从试剂瓶中取一小块金属钠(黄豆粒大小),用滤纸吸干表面的煤油后,用小刀切去一端的外皮,观察钠的颜色,并注意新切面发生的变化,根据实验总结钠的物理性质。
2.将一小块金属钠放在石棉网上加热,当钠开始燃烧时停止加热,观察火焰的颜色和产物的颜色、状态。写出有关反应的化学方程式。
3.将上述钠燃烧的产物转入干燥的试管中,逐滴加入少量水,观察是否有气泡生成,用带火星的木条放在试管口,检验生成的气体。反应停止后,向试管中滴入几滴酚酞溶液,观察溶液颜色的变化。解释现象,写出有关反应的化学方程式。
4.在一个盛有水的烧杯里滴入几滴酚酞溶液,然后把一小块黄豆粒大小的金属钠放入水中,立即用表面皿盖住烧杯,观察发生的现象和溶液颜色的变化。解释现象并写出有关反应的化学方程式。
二、碳酸钠与碳酸氢钠
1.在试管中加入约0.3 g碳酸钠,按图连接好装置,加热,观察澄清石灰水的变化。换另一支盛有同样质量的碳酸氢钠的试管,加热,观察澄清石灰水的变化。(https://www.daowen.com)
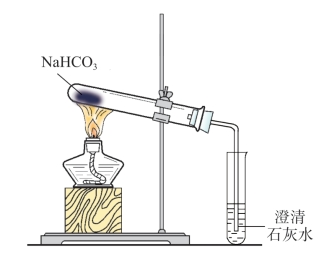
图4-1 碳酸氢钠加热分解
三、金属离子的检验
取一根焊接在玻璃棒上,顶端弯成小圈的铂丝(或光洁无锈的铁丝),放在酒精灯外焰灼烧,直到与火焰的颜色相同为止。用铂丝依次蘸取氯化钠、氯化钾、氯化铜、氯化钙等溶液在外焰上灼烧,观察火焰的颜色。注意:
1.每种溶液实验完后,都要将铂丝用稀盐酸洗净,重新灼烧到跟原来的火焰颜色相同时,再蘸取另一种溶液。
2.在观察钾盐溶液的火焰颜色时,要透过蓝色钴玻璃,可以滤去黄色的光,避免钾盐里钠杂质所造成的干扰。
