人体化学反应中的蛋白质
人体化学反应中的蛋白质
1.蛋白质与生命
蛋白质是生命活动的重要物质基础,被誉为“生命的基础”。有生命的地方,就有蛋白质。恩格斯曾深刻论述了蛋白质与生命现象之间不可分割的关系。他说:“生命是蛋白质的存在方式”,“无论是什么地方,只要我们遇到生命,我们就会发现生命是和某种蛋白质相联系的,而且无论在什么地方,只要我们遇到不处于解体过程中的蛋白质,我们也无例外地发现生命现象。”
既然蛋白质与生命现象之间有着如此深切的联系,那么,只要深入研究蛋白质,就可以回答:生命,究竟是怎么回事?胰岛素,正是被人们选择作为突破口的一种蛋白质。原来,在人和动物的胰脏里,存在着一种小岛似的细胞,它分泌出一种激素,即为胰岛素。这种激素很重要,它能促进体内碳水化合物,如糖类、淀粉等的新陈代谢,并控制血液里糖的含量。人体内如缺少胰岛素,就会得糖尿病。在医学上,胰岛素是治疗糖尿病的特效药。
要想合成蛋白质就必须要知道蛋白质的结构。胰岛素是人们最先知道分子结构的蛋白质,早在19世纪初,人们就已认识到,氨基酸是组成蛋白质的基本单位,蛋白质分子是由许多氨基酸以肽键结合成的长链高分子化合物。英国科学家桑格及其共同工作者于1945年开始研究胰岛素的结构,经过10年的努力,终于测出了牛胰岛素中全部氨基酸的排列顺序。
牛胰岛素和人胰岛素的分子结构极为相似,都是由51个氨基酸组成的,两者前50个氨基酸的成分、顺序都相同,只是最后1个氨基酸不同。牛胰岛素的分子是由2条分子链组成的:一条叫A链,一条叫B链。A链由21个氨基酸组成,B链由30个氨基酸组成。两条链之间,由2对硫原子连在一起,A链中还有自己的1对硫原子。1个牛胰岛素分子,总共含有777个原子!然而,它却是现在已知蛋白质中最小的一个。
1958年底,中国科学院生物化学研究所首先进行了胰岛素的拆合工作,即将胰岛素中3个硫硫键拆开后,再通过硫硫键的结合,使之重新成为天然胰岛素活力相同的分子。天然胰岛素的拆合成功,把人工合成胰岛素的工作简化到分别合成21肽和30肽。即使这样,人工合成胰岛素仍是相当艰难的。因此,中国科学院生化研究所的科研人员前后花费了6年多的时间,在1965年9月17日,才终于向世界骄傲地宣布:世界上首批用人工方法合成的结晶牛胰岛素诞生了!这点雪白的结晶体,其结晶形状与天然胰岛素相同,生物活力与天然胰岛素相等。
1971年,我国科学工作者又分别完成了分辨率为2.5埃和1.8埃的胰岛素晶体立体结构的测定工作。近年来,又抽提、结晶了鸡、乌凤蛇和鲢鱼的胰岛素,另外还合成了29肽的结晶高血糖素,在合成蛋白质方面取得了一系列新成就。

人工合成的蛋白质晶体模型
生命究竟是怎么回事?人们对这个既具体又抽象的问题研究了几千年,也争论了几千年。地球上的原始生命是从哪儿来的?谁也无法回到远古年代的环境中去观察生命发生的具体过程。人工合成蛋白质的成功,为我们在现代实验室里人工模拟当时的环境条件,论证生命出现的可能性和必然性提供了一条可行的途径。
蛋白质的合成、分解及转化也是生命活动的基本特征。蛋白质生物合成的原料是氨基酸,其合成过程十分复杂,几乎涉及细胞内所有种类的RNA和几十种蛋白质因子,反应所需的能量由ATP和GTP提供。蛋白质合成的场所是在核糖体内进行的,所以把核糖体称为蛋白质合成的工厂。
蛋白质的合成要求100多种大分子物质参与和相互协作。这些大分子物质包括rRNA、tRNA、核糖体、多种活化酶及各种蛋白质因子。
2.mRNA与遗传密码
(1)mRNA
mRNA的概念是在1965年由F.Jacob和J.Monod首先提出来的。因为当时已经知道编码蛋白质的遗传信息载体DNA是在细胞核中,而蛋白质的合成是在细胞质中,于是就推测,应该有一种中间信使在细胞核中合成后,携带遗传信息进入细胞质中指导蛋白质的合成。后来经过许多科学家的试验,发现了除rRNA和tRNA之外的第三种RNA,它起着这种遗传信息传递的功能,被称为信使RNA(mRNA)。即遗传信息由DNA经转录传递给mRNA,然后由mRNA翻译成特异的蛋白质。mRNA的半衰期很短,很不稳定,一旦完成其使命后很快就被水解掉。
不同的mRNA的分子大小差别很大,这和以它为模板所合成的蛋白质的分子大小不均一有关。原核生物的mRNA往往携带者1种以上蛋白质分子的信息,但大多数真核细胞的mRNA只编码1条多肽链。
(2)遗传密码
实验证明,蛋白质不是通过复制方式来完成的,而是按照DNA分子结构来合成的。没有DNA,蛋白质的合成就没有了依据,但是如果没有蛋白质,DNA就无法体现它的遗传功能:虽然DNA的遗传可以不要蛋白质外衣而单独行动,但在DNA繁殖,并建设机体时却必须有蛋白质的参与。有人把DNA比作蓝图。蛋白质就是蓝图实现后的产品,或把DNA比作模板,蛋白质就是建筑构件。这正形象地说明了蛋白质与DNA的关系。例如,鸡蛋里面有蛋清、蛋黄,并没有鸡毛、鸡冠,也没有鸡心、鸡肝,但是有DNA分子。DNA的基因采取“分工负责、协调统一”的方法进行“流水作业”,有的“负责”鸡毛那段,有的“承包”鸡冠那段……“默默地各负其责,分工合作”。然后,蛋白质再按照DNA的分子结构来进行“组装”,“依样画葫芦”地长出了鸡毛、鸡冠、鸡心等,成为一只完整的鸡,并且有它父母的性状。
但是,蛋白质究竟是怎样按照DNA的分子结构来合成的呢?它又是什么样的物质材料?
研究证明,蛋白质的物质材料是氨基酸。氨基酸有20多种,它们的结构像一列长长的火车,每一节车厢就是一种氨基酸,这些车厢首尾相连,就构成了蛋白质这列火车。
蛋白质分子最小的只含有几十个氨基酸,较大的却含有千百个氨基酸。每一种蛋白质的氨基酸都按一定的顺序排列起来,正如每一种DNA都具有特定的核苷酸顺序一样。那么,这两种平行的序列是互不相干,还是大有关系呢?
科学家在研究这二者关系时,通过了一系列的假定推理。他们首先设想:是核苷酸的碱基序列决定了氨基酸序列,因此,在每个位置上,核苷酸都要同氨基酸对应起来。但是,由于核苷酸家族很小,只有4种,而氨基酸却有20多种,“门不当,户不对”,核苷酸人丁稀少,氨基酸却成员众多,二者怎么才能一一地配对,以实现它们的完美结合呢?于是,科学家又假定开来:他们先是假定2个核苷核与1个氨基酸对应,那么4种核苷酸就有16种排列方式,即AA、TT、CC、GG、AT、AC、AG、TC、TG、TA、CA、CT、CG、GA、GT、GC。但是氨基酸有20多种,还是有“富裕人员”,有“单身俱乐部成员”。于是,科学家又假定3个核苷酸与1个氨基酸对应,那就有64种排列方式,便足够同氨基酸对应了。随着科学的发展,科学家们的这一假想后来得到了科学的证实,并已经研究出了每3个核苷酸与相应氨基酸的对应关系。于是,每3个核苷酸愉快地携伴搭乘上一节氨基酸车厢,蛋白质这列火车也就咣啷咣啷地向前开去,充满了生命的活力与节奏。
①遗传密码的解读
踏上蛋白质“火车”的氨基酸车厢的成员们,已开始了愉快的旅行。但是,倘若要问一问每节车厢中的成员们是怎样组合在一起的,这就不能不让人联想到日常生活中的打电报了。日常通讯中用“、”、“—”两个符号,可以组成从“0”到“9”这10个数,每4个数按不同顺序编码,分别代表成千上万个汉字,就可以担负起各式各样的电报内容,完成通讯任务。
DNA由4种不同的核苷酸组成,其中3个核苷酸就组成了如同电报中的密码子。若干个密码子又组成1个基因,许许多多基因连在一起成为DNA,就组成一个庞大的信息群,代表成千上万的遗传信息。4种核苷酸类似打电报的10个数字,密码子就像电报中的汉字,而基因就是电报中的一句话,DNA就是电报的全文。
DNA分子结构图
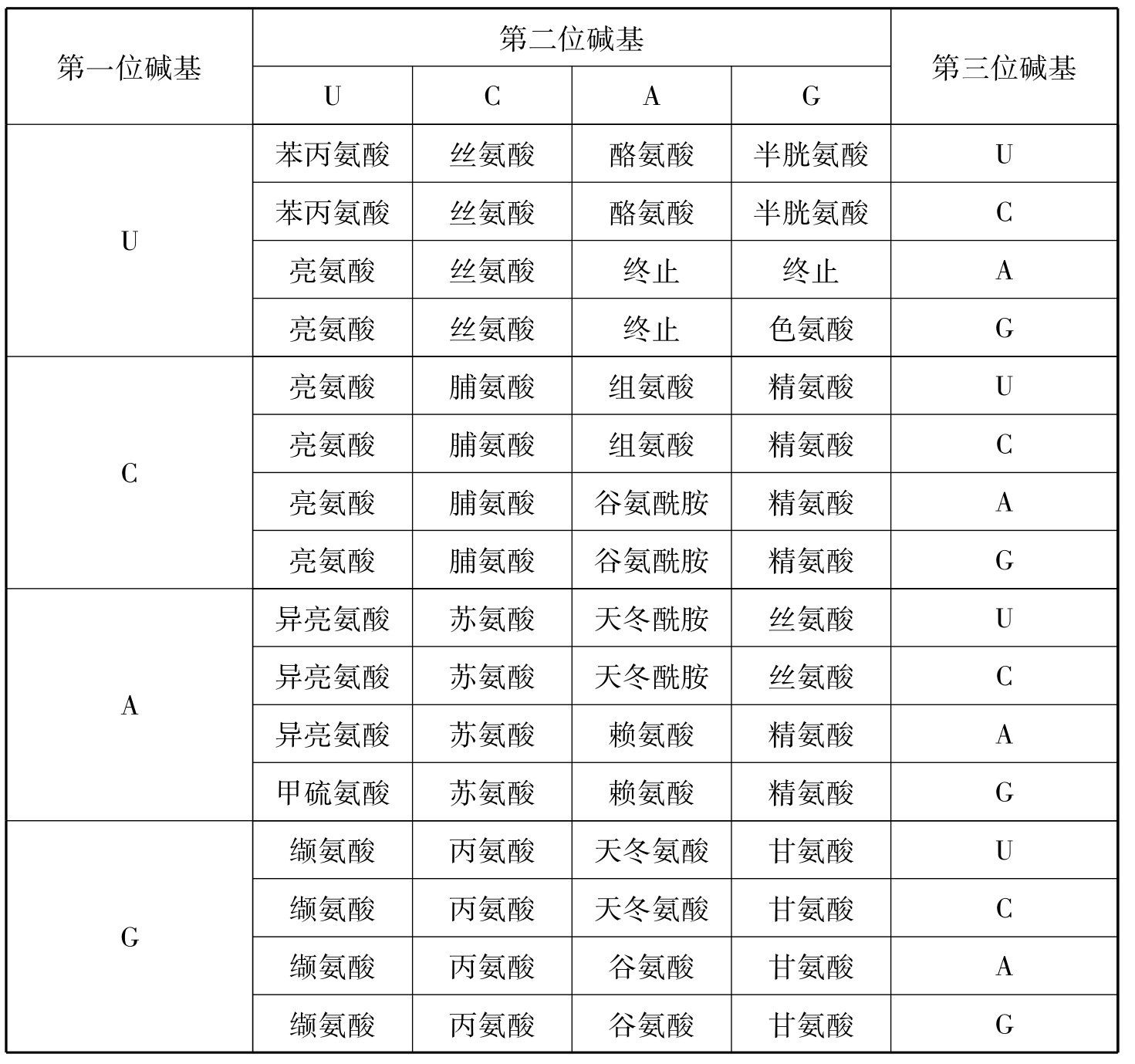
现在的问题在于:密码子怎样破译,也就是说,什么样的密码子代表哪一类的氨基酸。1961年8月,生物化学家尼伦伯格宣布他破译了一个密码子,在生物界引起一场轰动,在此后的5年里,人们成功地破译了全部密码表中的64个密码子。DNA分子和双螺旋结构使科学家把DNA的多核苷酸链中核苷酸顺序和蛋白质的多肽链中的氨基酸顺序联系起来考察它们之间的关系,得出3个核苷酸组成1个密码子,DNA链上每3个核苷酸组成的1个密码子编码相对应蛋白质多肽链中的1种氨基酸。同时,任何氨基酸在进入到多肽链中去之前,必须先装配在一种所谓接受器的小分子RNA上,然后接受器带领氨基酸去和蛋白质合成的RNA作碱基互补配对,从而使氨基酸按照编码的要求依次合成一个一个蛋白质分子。将人工合成的只含有尿嘧啶核苷酸(u)的多核苷酸中只加入一种用同位素14C标记的氨基酸,结果发现只在苯丙氨酸的一组试验中会出现全是苯丙氨酸构成的多肽链,显然,经过同位素14C的侦查,苯丙氨酸的一个密码子全是由u所组成。后来,科学家经过实验证明密码子是以三联形式(即每个密码子氨基酸由3个碱基决定)代表着20多种氨基酸,同时还证明了密码子是由一个固定的点开始,顺一定的方向读下去,被翻译成相应的氨基酸。
那么。苯丙氨酸的密码子应是“UUU”,后来又破译了编码赖氨酸的密码子是“AAA”,编码脯氨酸的密码子是CCC。以后,由于人工合成了一系列的含有2种或3种不同核苷酸的多聚核苷酸,利用它作为“侦查员”,破译工作就更快了。例如,用多聚核苷酸作为“侦查员”,在体外的蛋白质分子体系中,通过观察多种标记的氨基酸参入到多肽链中去的比例,即可推算出某些密码子的组成。
遗传密码表
②遗传密码的特性
1)密码的无标点性。密码的无标点性是指2个密码子之间没有任何核苷酸加以隔开。因此要正确阅读密码必须从一个正确的起点开始,按一定的读码框架连续读下去,直至遇到终止密码子为止。若插入或删去1个碱基,就会使这以后的读码发生错误,这种突变称为移码突变。
2)遗传密码的不重叠性。假设mRNA上的核苷酸序列为ABCDEFGHIJKL……按不重叠读码规则,每3个碱基编码1个氨基酸,碱基不重复使用,即ABC编码第一个氨基酸,DEF编码第二个氨基酸,GHI编码第三个氨基酸,依次类推。若按完全重叠规则读码,则为ABC编码第一个氨基酸,BCD编码第二个氨基酸,CDE编码第三个氨基酸等等。
目前已经证明,在绝大多数生物中读码规则是不重叠的。但是在少数大肠杆菌噬菌体的RNA基因组中,部分基因的遗传密码是重叠的。
3)密码子的简并性。大多数氨基酸都是由几个不同的密码子编码的,如UCU、UCC、UCA、UCG、AGU及AGC六个密码子都编码丝氨酸,这一现象称密码子的简并性。编码相同氨基酸的密码子被称为同义密码子。只有色氨酸和甲硫氨酸仅有1个密码子。
密码的简并性具有重要的生物学意义。一是可以减少有害的突变。如果每个氨基酸只有1个密码子,那么20个密码子即可编码20种氨基酸的了,剩下的44个密码子都将是无意义的,将会导致肽链合成的终止。这样造成终止突变的可能性会大大提高。而肽链终止的突变常会导致蛋白质的失活。二是即使DNA上碱基组成有变化,仍可保持由此DNA编码的多肽链上氨基酸序列不变。细菌DNA中(G+C)含量变动很大(30%~70%),但是GC含量很不相同的细菌,却可以编码出相同的多肽,所以密码简并性在物种的稳定上起一定作用。(https://www.daowen.com)
4)密码子的第三个碱基的专一性较第一、二个碱基低。密码的简并性往往只涉及第三位碱基,如丙氨酸有4组密码子:GCU、GCC、GCA和GCG,它们的前2位碱基都相同,均为GC,只是第三位不同。已经证明,密码子的专一性主要取决于前2位碱基,第三位碱基的重要性不大。例如丙氨酸是由三联体GCU、GCC、GCA和GCG来编码的,头2个碱基GC是所有丙氨酸密码子共用的,而第三个可以是任何碱基。
5)起始密码子和终止密码子。64个密码子中,有1个密码子AUG既是甲硫氨酸的密码子,又是肽链合成的起始密码子。另外3个密码子UAG、UAA和UGA不编码任何氨基酸,而是多肽合成终止密码子。这3个密码子不能被tRNA阅读,只能被肽链释放因子识别。
6)遗传密码的基本通用性。多年来,遗传密码被认为是通用的,即各种高等和低等的生物(包括病毒、细菌及真核生物等)共用同一套遗传密码。后来的研究发现,线粒体mRNA中,一些密码子有不同的含义,如哺乳动物的线粒体中,UGA不再是终止密码子,而编码色氨酸,AGA、AGG为终止密码,而不编码精氨酸。另外,某些生物细胞基因组密码也有一定的变异,如原核生物的支原体中,UGA也被用于编码色氨酸。因此标准的遗传密码尽管被广泛采用,但并非绝对通用的。
3.tRNA
在蛋白质合成中,氨基酸本身不能识别mRNA上的密码子,它需要由特异的tRNA分子携带到核糖体上,并由tRNA去识别在mRNA上的密码子,因此tRNA是多肽链和mRNA之间的接合器。
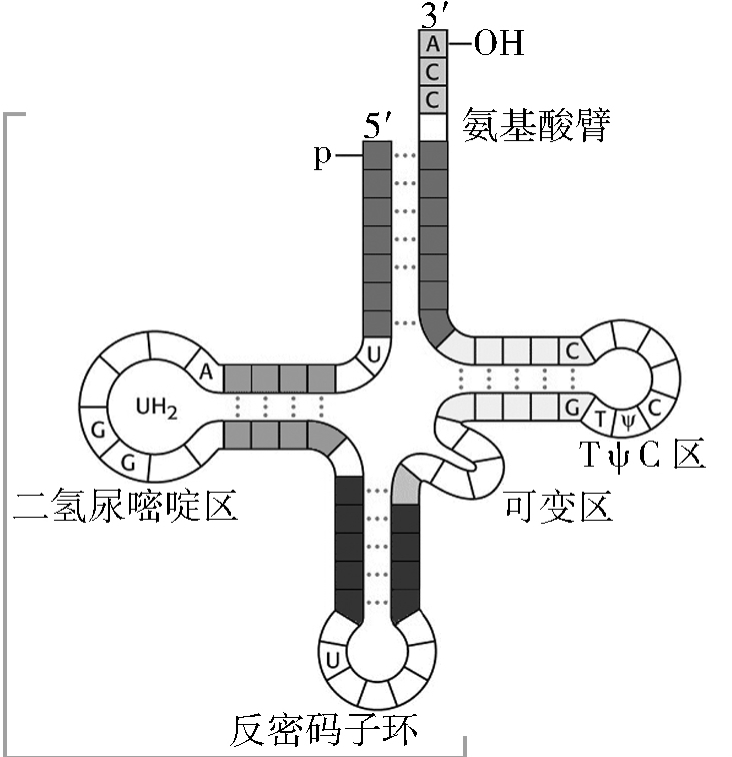
tRNA
tRNA含有2个关键的部位,一个是3'末端的氨基酸结合部位,tRNA分子的3'末端的碱基顺序是—CCA,“活化”的氨基酸的羧基与tRNA3'末端腺苷的核糖3'—OH连接,形成氨酰—tRNA,这一过程由特异的氨酰—tRNA合成酶催化完成,由ATP提供氨基酸活化所需要的能量。大多数氨基酸都有几种tRNA作为运载工具,这些携带相同氨基酸而反密码子不同的一组tRNA称为同功受体tRNA。在书写时,将所携带氨基酸写在tRNA的右上角,如tRNAAla及tRNAcys分别表示转运丙氨酸和半胱氨酸的tRNA。一种氨酰—tRNA合成酶可以识别一组同功受体tRNA。
tRNA分子中另一个关键部位是与mRNA的结合部位,这一部位位于tRNA的反密码子环上,由3个特定的碱基组成,称为反密码子。反密码子按碱基配对原则,反向识别mRNA链上的密码子。氨基酸一旦与tRNA形成氨酰—tRNA,进一步的去向就由tRNA来决定了。tRNA凭借自身的反密码子与mRNA分子上的密码子相识别而把所带的氨基酸送到肽链的一定位置上。Chapeville和Lipmann(1962)做了一个巧妙的实验来证明这一点:将放射性同位素标记的半胱氨酸在半胱氨酰—tRNA合成酶催化下,与tRNA形成半胱氨酰—tRNA。然后,用活性镍作催化剂,使半胱氨酸转变成丙氨酸,形成丙氨酰—tRNAcys。然后将它放到网织红细胞无细胞体系中进行蛋白质合成。分析后,发现丙氨酸插入了本应由半胱氨酸所占的位置。
一种tRNA分子往往能够识别1种以上的同义密码子,Crick提出了“摆动假说”来解释这一现象。他认为配对时,密码子的第一、第二位碱基严格配对,第三位碱基可以有一定的变动。配对的摆动性是由tRNA反密码子环的空间结构决定的。
4.核糖体
1955年,PaulZameenik通过实验确认核糖体是蛋白合成的场所。他将放射性同位素标记的氨基酸注射到小鼠体内,经短时间后取出肝脏,制成匀浆,离心后分成细胞核、线粒体、微粒体和可溶部分。发现微粒体中的放射性强度最高,若将微粒体部分进一步分级分离,可在核糖体中大量回收到所掺入的放射性同位素标记的氨基酸,这说明核糖体是合成蛋白质的部位。
(1)核糖体的结构
核糖体是一个巨大的核糖核蛋白体。原核细胞核糖体能解离成1个大亚基和1个小亚基;真核细胞核糖体比原核细胞的更大更复杂,它也能解离成1个大亚基和1个小亚基。
在原核和真核细胞蛋白质合成时,往往都会有多个核糖体结合在一个mRNA转录本上,从而形成念珠状结构,称为多聚核糖体。2个核糖体之间有一段裸露的mRNA。多聚核糖体的出现是由于一旦一个活跃的核糖体通过了mRNA上的起始位点,第二个核糖体就能在那个位点起始翻译,这样提高了翻译的效率。
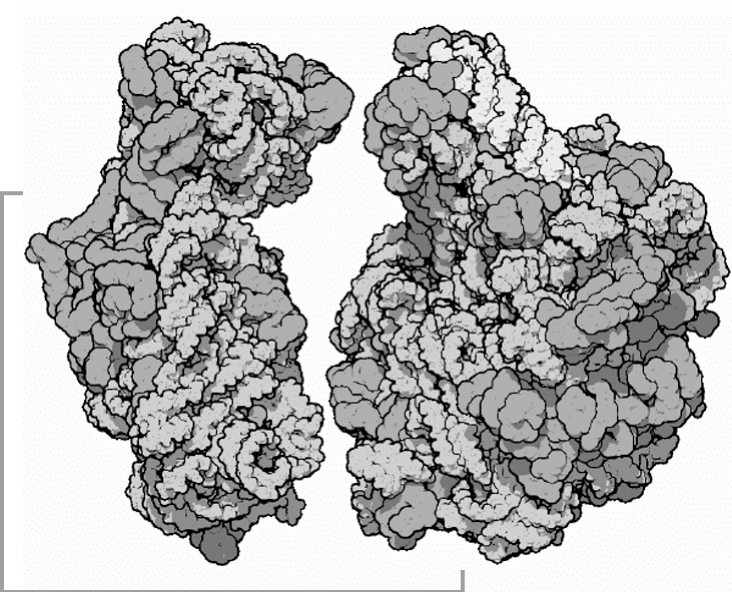
核糖体
(2)核糖体的化学组成
原核细胞核糖体中的小亚基含有21种蛋白质,还含有1分子rRNA(核糖体RNA)。大亚基含有34种蛋白质及大小不等的2分子rRNA。真核细胞核糖体中的小亚基有30多种蛋白质及1分子rRNA。大亚基中有50多种蛋白质及大小不等的2分子rRNA(见下表)。哺乳类动物核糖体的大亚基中还有1分子rRNA(比上面提到的真核细胞核糖体中较小的rRNA稍大一些)。真核细胞中的叶绿体和线粒体也有自己的核糖体。
核糖体的化学组成

①核糖体RNA(rRNA)。大肠杆菌核糖体内的rRNA有很多短的双螺旋区。目前对rRNA的生物学功能还缺少了解。有人认为,核糖体RNA主要起结构作用,为核糖体蛋白质正确的装配和定位提供了骨架。但也有例外,16SrRNA在识别mRNA上的多肽合成起始位点中起重要作用。
②核糖体蛋白。大肠杆菌所有核糖体蛋白的氨基酸序列已经阐明,它们的大小范围在46~557个残基之间。这些蛋白质的大多数互相之间不存在序列上的相似性,但富含碱性氨基酸赖氨酸和精氨酸,并含有很少的芳香族氨基酸,这种情况对与多聚阴离子RNA分子的结合是有利的。
5.肽链合成后的折叠与修饰
大多数蛋白质的肽链在合成时或合成后,还必须经过若干折叠及修饰过程,才能成为成熟的有一定生理功能的蛋白质分子。
(1)多肽链的折叠
多肽链的折叠是指从多肽链氨基酸序列形成正确的三维结构的过程。肽链的折叠从核糖体出现新生的多肽链即可开始。蛋白质的氨基酸序列规定蛋白质的三维结构,但生物体内蛋白质的折叠仍然需要催化剂的帮助。现已发现,蛋白质二硫键异构酶和肽基脯氨酸异构酶参与蛋白质的折叠过程。前者能加速蛋白质正确二硫键的形成,后者则加速脯氨酸亚氨基肽键的顺—反异构化。在蛋白质中有一部分脯氨酸亚氨基的肽键是顺式构型,需要被异构化为反式。另外,还有一个被称为分子伴侣的蛋白质家族涉及蛋白质折叠,它们通过抑制新生肽链不恰当的聚集,并排除与其他蛋白质不合理的结合,协助多肽链的正确折叠。目前被确认的分子伴侣有热休克蛋白60、70等。
(2)多肽链的修饰
多肽链的修饰可以在肽链折叠前、折叠期间或折叠后进行,也可以在肽链延伸期间或终止后进行。有些修饰对多肽链的正确折叠是重要的,有些修饰与蛋白质在细胞内的转移或分泌有关。
多肽链
①末端氨基的去甲酰化和N—甲硫氨酸的切除。原核细胞多肽N末端的甲酰甲硫氨酸的甲酰基可在去甲酰酶的催化下被除去。在原核和真核细胞中多肽N末端的甲硫氨酸(有时与少数几个氨基酸一起)均可被氨肽酶除去。原核细胞究竟采取去甲酰基还是去甲酰甲硫氨酸,常决定于邻近氨基酸。如果第二个氨基酸是Arg、Asn、Asp、Glu、Ile或Lys,则以前者为主;如果第二个氨基酸是Ala、Gly、Pro、Thr或Val,则以后者为主。
②一些氨基酸残基侧链被修饰。有些氨基酸没有相应的遗传密码,而是在肽链从核糖体释放后经化学修饰形成的。如胶原蛋白中含有大量的羟脯氨酸和羟赖氨酸,分别是脯氨酸和赖氨酸经羟化而成的。有些蛋白质中的天冬酰胺、丝氨酸和苏氨酸发生糖基化形成糖蛋白,丝氨酸磷酸化成为磷酸丝氨酸。
③二硫键的形成。多肽链的半胱氨酸残基可在蛋白质二硫键异构酶的作用下形成二硫键,肽链内或肽链间都可形成二硫键,二硫键在维持蛋白质的空间构象中起了很重要的作用。
④多肽链的水解断裂。许多具有一定功能的蛋白质如酶、激素蛋白,在体内常以无活性的前体肽的形式产生。这些前体在一定情况下经体内蛋白酶的水解切去部分肽段,才能变成有活性的蛋白质。如胰岛素原变成胰岛素,胰蛋白酶原变为胰蛋白酶等。
