酶催化作用的特点
酶催化作用的特点
1.酶催化的专一性
酶催化的专一性是指酶对它所催化的反应及其底物有严格的选择性,即一种酶只能催化一种或一类反应。如蛋白质、脂肪和淀粉均可被一定浓度的酸或碱水解,其中的酸碱对这三种物质的催化无选择性,而酶水解则有选择性,蛋白酶只能水解蛋白质,脂肪酶只能水解脂肪,而淀粉酶只作用于淀粉。酶催化的专一性是酶与非酶催化剂最重要的区别之一。
(1)酶专一性的类型
根据酶对底物选择的严格程度,酶的专一性可分为结构专一性和立体专一性两种主要的类型。
①结构专一性。根据不同酶对不同结构底物专一性程度的不同,又可分为绝对专一性和相对专一性。
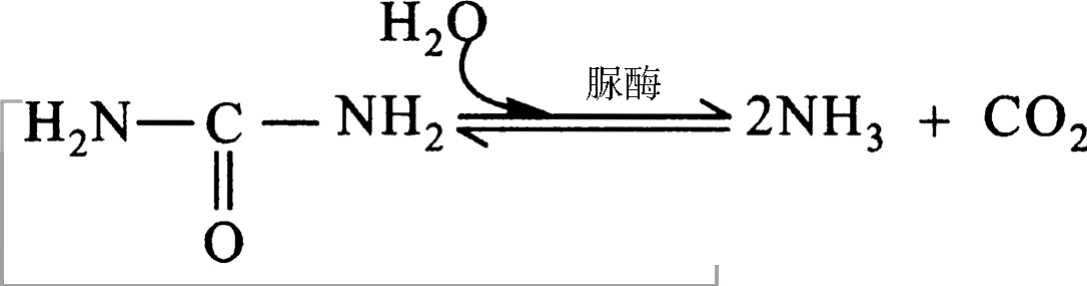
a.绝对专一性,指酶只作用于一种底物,底物分子上任何细微的改变酶都不能作用,如脲酶只能催化尿素水解:
b.相对专一性,指酶对底物结构的要求不是十分严格,可作用于一种以上的底物。有些具有相对专一性的酶作用于底物时,对所作用化学键两端的基团要求程度不同,对其中一个要求严格,而对另一个则要求不严,这种特性称为基团专一性(族专一性)。如a-D-葡萄糖苷酶,不仅要求水解α-糖苷键,而且α-糖苷键的一端必须是葡萄糖残基,而对键的另一端R基团要求不严。因此,凡是具有α-D-葡萄糖苷的化合物均可被该酶水解。
②立体专一性。当底物具有立体异构体时,酶只作用于其中的一个。这种专一性包括立体异构专一性和几何异构专一性。
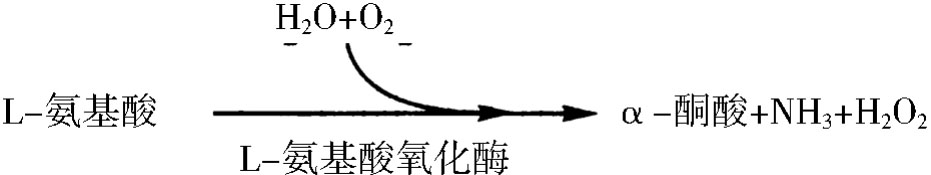
a.旋光异构专一性,如L-氨基酸氧化酶只催化L-氨基酸的氧化脱氨基作用。对D-氨基酸无作用。
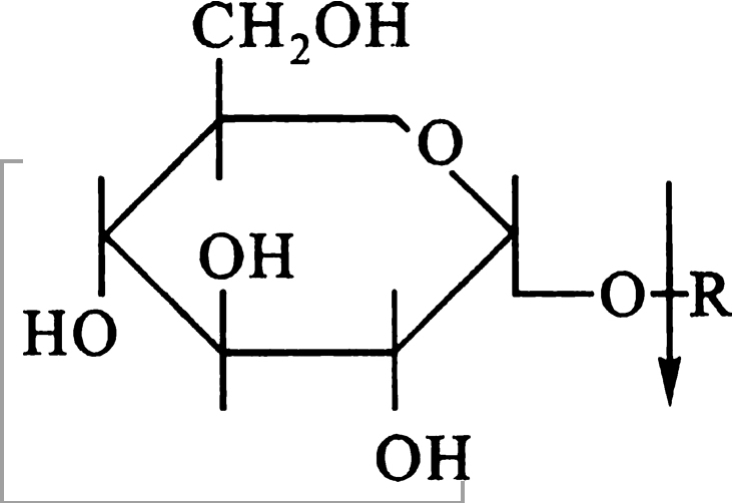
α-葡萄糖苷
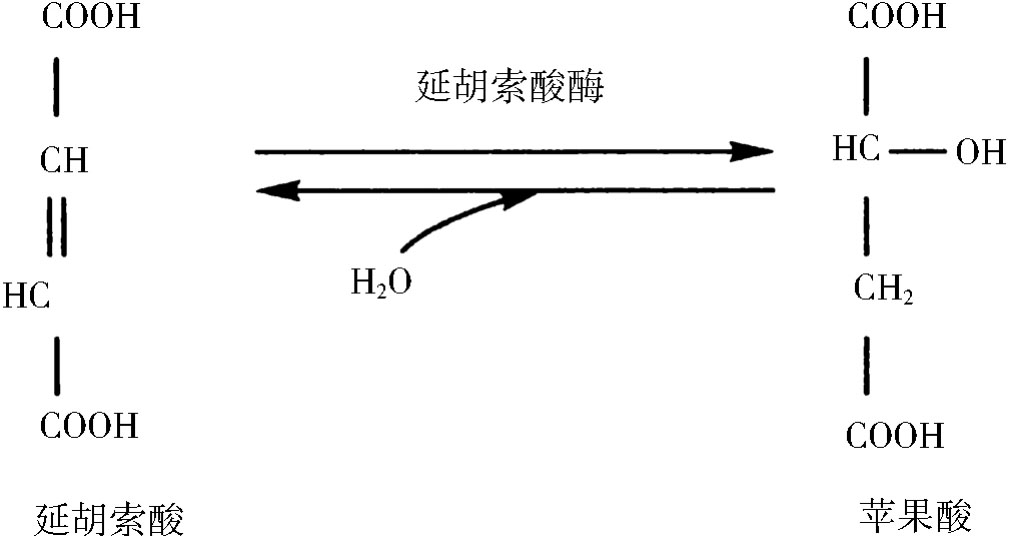
b.几何异构专一性,当一种底物有几何异构体时,酶只选择其中一种进行作用,如延胡索酸酶可催化延胡索酸加水生成苹果酸,而不能催化顺丁烯二酸加水。
 (https://www.daowen.com)
(https://www.daowen.com)
此外,对于酶的立体专一性,还表现在酶能区分从有机化学观点来看属于对称分子中的2个等同的基团,只催化其中的一个,而不催化另一个。如酵母醇脱氢酶在催化时,辅酶的尼克酰胺环C4上只有一侧可以加氢或脱氢,另一侧则不被作用。
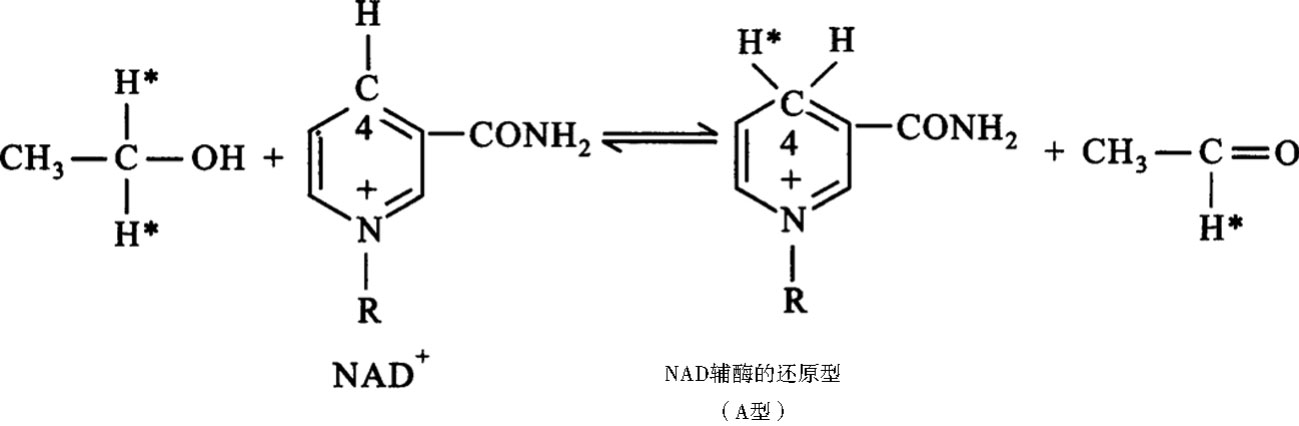
需要指出的是酶的专一性既表现在底物上,也表现在产物方面,即一种酶只能催化形成特定的产物。
(2)酶作用专一性的机理
酶作用的专一性问题很早就引起了科学家们的注意,并提出了多个假说来解释这种专一性。
①锁钥学说。1894年,德国有机化学家EmilFisher发现水解糖苷的酶能区分糖苷的立体异构体。他认为酶像一把锁,底物分子或分子的一部分结构犹如钥匙一样,能专一性地插入到酶的活性中心部位,因而发生反应。这一学说曾因无法解释酶促可逆反应而受冷落。但近年来,随着对氨酰—tRNA合成酶的研究,发现它对大量的非常相似的底物进行高精度的识别,如异亮氨酰—tRNA合成酶选择异亮氨酸而不选择亮氨酸作为底物,于是又导致用锁钥学说来解释许多研究过程巾的酶作用的专一性问题。
②三点附着学说。它是A.Ogster在研究甘油激酶催化甘油转变为磷酸甘油时提出来的。该学说认为酶具有立体专一性,对于对称分子中的2个等同的基团,其空间排布是不同的。可以被酶识别,这是由于这些基团与酶活性中心的有关基团需要达到3点都相互匹配,酶才能作用于这个底物。
以上两种学说都把酶和底物之间的关系认为是刚性的,属于刚性模板学说。它们只能解释底物与酶结合的专一性,不能解释催化的专一性。而事实上专一性应包含2层意义,即结合专一性和催化专一性,就像有的钥匙能插入锁孔中,但不一定能把锁打开。
③诱导契合学说。1958年Koshland提出,酶能催化可逆反应在于酶和底物之间的结合是一个诱导契合的过程。该学说的要点是:酶活性中心的结构具有柔性,即酶分子本身的结构不是固定不变的;当酶与其底物结合时,酶受到底物的诱导,其构象发生相应的改变,从而引起催化部位有关基团在空间位置上的改变,以利于酶的催化基团与底物敏感键正确地契合,形成酶—底物中间复合物。近年来各种物理、化学方法和X射线衍射、核磁共振、差示光谱等技术都证明了酶和底物结合时酶分子有构象的改变,从而支持了诱导契合学说。
2.酶催化的高效性
在生物体内,酶促反应的速率通常为无催化状态时的1016倍,远远超过了非酶催化剂所达到的速率。如尿素在脲酶催化下的水解:
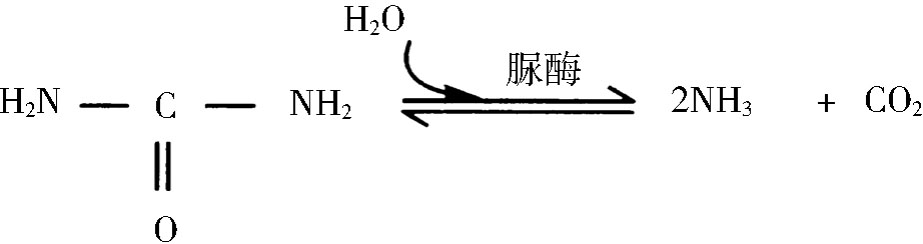
常温(20℃)下,该酶促反应的速率常数为3×104/秒,而无催化剂时尿素水解的速率常数为3×10-10/秒。若把两者的比值看作酶的催化能力,则脲酶的催化能力为1014。
3.酶活性的可调节性
酶的另一重要特征是其催化活性受到多种因素的调节控制,从而使生命活动中的各个化学反应具有有序性,这也是区别于化学催化剂的重要特征。例如酶活性的激素调节是一类由激素通过与细胞膜或受体结合,而对某些酶的专一性进行调节的。
