白 血 病
第二节 白 血 病
病史摘要
病例一
患儿,女,6岁,以“四肢乏力2年余,右侧颈部淋巴结肿大5个月余,伴发热、咳嗽1个月余”为主诉平诊入院。现病史:2年前无明显诱因出现四肢乏力,未在意,未治疗,5个月前在美容机构除疤后出现右侧颈部淋巴结肿大,无压痛、粘连,无发热咳嗽,8天前出现四肢多发散在瘀斑,2天前出现眼角散在瘀点至当地医院查血常规:白细胞29.99×109/L,红细胞2.02×1012/L,血红蛋白61 g/L,血小板9×109/L。为进一步治疗,遂来我院,门诊以“急性白血病”收入我科。自发病以来,食欲欠佳,睡眠正常,大便正常,小便正常,体重无明显减轻,患者无传染病史,无高血压、糖尿病、冠心病,无献血史,无药物过敏史。
体格检查:贫血貌,躯干和四肢可见散在瘀点、瘀斑,触诊发现除颈部淋巴结肿大外,全身其余浅表淋巴结均有不同程度肿大,肝肋下1 cm、脾肋下2 cm。体温:37.6℃,脉搏112次/分,呼吸20次/分,血压111/80 mm Hg。
辅助检查:血常规示白细胞29.99×109/L,红细胞2.02×1012/L,血红蛋白61 g/L,血小板9×109/L,镜下涂片进行白细胞分类计数发现成熟淋巴细胞占比80%、幼稚淋巴细胞占比11%。
病例二
男性,40岁,于10天前无明显诱因发热,体温38.2℃,伴全身酸痛,轻度咳嗽,咳少许白色黏痰,同时发现刷牙时牙龈出血,曾在当地验血“有异常”(具体不详),自服感冒药无效来诊。病后进食少,睡眠差,二便正常,体重无明显变化。既往体健,无结核病史,无药物过敏史。无烟酒嗜好,家族中无类似病史。
体格检查:T 38.2℃,P 98次/分,R 20次/分,BP 120/80 mm Hg。急性热病容,前胸和下肢皮肤散在出血点,浅表淋巴结未触及,巩膜无黄染,咽充血(+),扁桃体(—)。胸骨轻压痛,心(—),肺叩诊清音,右下肺闻及少许湿啰音,腹平软,肝脾肋下未触及,下肢不肿。
辅助检查:血红蛋白95 g/L,网织红细胞0.5%,白细胞3.8× 109/L,原幼细胞占48%,血小板30×109/L;尿常规(—);粪常规(—)。
诊断解析
病例一
根据患儿血常规检查的结果显示白细胞升高,并且以淋巴细胞为主,同时发现了幼稚淋巴细胞,且伴有血红蛋白浓度和血小板计数的下降,基本符合急性淋巴细胞白血病的外周血血象特征。同时患儿淋巴结和肝脾肿大的体格检查结果,贫血貌,躯干和四肢可见散在瘀点、瘀斑,且起病急的病史资料也符合急性淋巴细胞白血病的临床特征。下一步就需要进行骨髓细胞学的检验,以及一系列细胞化学染色、细胞免疫分析和染色体检查以进一步明确诊断和疾病分型。
病例二
根据患者的外周血涂片镜检发现原幼细胞占48%,是急性白血病的典型特征,此外该患者还有以下病史特征:中年男性,急性病程;有发热伴出血倾向10天、咳嗽(肺感染)的表现;贫血,皮肤散在出血点,胸骨轻压痛;无既往特殊病史。这些病史特征均支持急性白血病的诊断。后续进行骨髓检查、X线胸片、腹部B超、肝肾功能以及一系列细胞化学染色、细胞免疫分析和染色体检查以进一步明确诊断和疾病分型。
知识拓展
白血病是一类造血干细胞的克隆性疾病,是造血系统恶性肿瘤。其特征为造血组织中一系或多系血细胞异常增生伴分化成熟障碍和凋亡减少,并在骨髓、肝、脾、淋巴结等各脏器广泛浸润,外周血中白细胞有质和量的异常,红细胞与血小板数量减少,导致贫血、出血、感染、浸润等征象。
1. 临床表现
(1) 正常骨髓造血功能受抑表现
1) 贫血:急性起病可无贫血。
2) 发热:半数为早期表现,可低热、高热合并感染。感染可发生在各个部位:以口腔炎、牙龈炎、咽峡炎;肺感染、肛周炎、肛旁脓肿常见。
致病菌:①细菌:革兰阴性杆菌,如铜绿假单胞菌、肺炎克雷伯杆菌、大肠埃希菌多见,革兰阳性球菌,如金黄色葡萄球菌、表皮葡萄球菌、粪链球菌、肠球菌等。②真菌:白细胞功能低下、长期使用抗生素。白念珠菌、曲霉等。常存在于呼吸道、消化道等。③病毒:单纯疱疹病毒、带状疱疹病毒、巨细胞病毒。
3) 出血:皮肤、鼻、口、月经、眼底、肺、消化道、颅内出血。急性早幼粒细胞白血病DIC出血表现重。急性白血病(AL)多死于出血(62.24%),87%颅内出血死亡。
(2) 白血病细胞增殖浸润
1) 淋巴结和肝脾肿大:急性淋巴细胞白血病(ALL)多淋巴结肿大,T—急性淋巴细胞白血病纵隔淋巴结大,肝脾多中度大,慢性粒细胞白血病(CML)急变可脾大明显。
2) 骨骼和关节:胸骨压痛,儿童关节骨骼疼痛,骨髓坏死时可剧痛。
3) 眼部:粒细胞AL眼眶部骨膜浸润(绿色瘤),可眼球突出、复视、失明。
4) 口腔、皮肤:M4、M5可牙龈增生肿胀;皮肤表现为灰色斑丘疹,局部隆起变硬,呈紫蓝色结节。
5) 中枢神经系统白血病(CNSL):常出现在ALL缓解期,初诊患者相对少见。浸润部位多发生在蛛网膜、硬脑膜,其次为脑实质、脉络膜或脑神经。重症者有头痛、呕吐、项强、视神经乳头水肿,甚至抽搐、昏迷等颅内压增高的典型表现。
6) 睾丸:血睾屏障。多为单侧无痛性肿大。
7) 其他:心、肺、消化道、泌尿生殖系症状等。
2. 发病情况
(1) 发病率2.76/10万,占恶性肿瘤总发病率的5%左右,以儿童和青少年居多;死亡率占男性第六位和女性第八位,在儿童及35岁以下的人群中则占到了第一位。
(2) AL>CL(慢性白血病);ANLL(急性非淋巴细胞白血病)>ALL,CML>CLL(慢性淋巴细胞)。
(3) 男性>女性;成人ANLL多见,儿童ALL多见。
(4) CML随年龄增长发病率增高。CLL 50岁以后发病明显增多,我国CLL比欧美少见,为5%∶25%~ 30%。
3. 病因及发病机制
(1) 病毒:成人T—白血病(淋巴瘤)可由T淋巴细胞病毒1型(HTLV—1)所致,其他也可由EB病毒、HIV病毒引起,病毒感染后整合并潜伏在宿主细胞促使某些理化因素激活表达诱导白血病。
(2) 电离辐射:X线、γ射线、电离辐射等引起骨髓抑制、免疫力下降、DNA突变、断裂、重组,导致发病。
(3) 化学因素:苯类及含苯的有机溶剂;药物如乙双吗啉;烷化剂。
(4) 遗传因素:家族史。
(5) 其他血液病转化:MDS、淋巴瘤、多发性骨髓瘤、CML急变。
以上各病因的主要发病机制为:各种原因所致单个细胞原癌基因决定性的突变导致克隆性的异常造血细胞生成(由理化因素引起);遗传易感、免疫力低下、病毒感染、染色体畸变;通过遗传学改变可能涉及一个或多个癌基因激活,抑癌基因失活,从而导致白血病。
4. 白血病的分类 白血病细胞丧失了正常细胞的增殖、分化能力,按白血病细胞分化程度和自然病程分为急性和慢性白血病两大类。①急性白血病:病情发展迅速,骨髓及外周血中的白血病细胞为分化差的原始和早期幼稚细胞,其自然病程多在6个月以内。据受累细胞系列分为:急非淋(ANLL)和急淋(ALL)。②慢性白血病:病程发展缓慢,骨髓及外周血中的白血病细胞主要是较晚期的幼稚细胞和成熟细胞,自然病程多在1年以上。根据受累细胞系列分为:慢粒(CML)、慢淋(CLL)和少见类型。
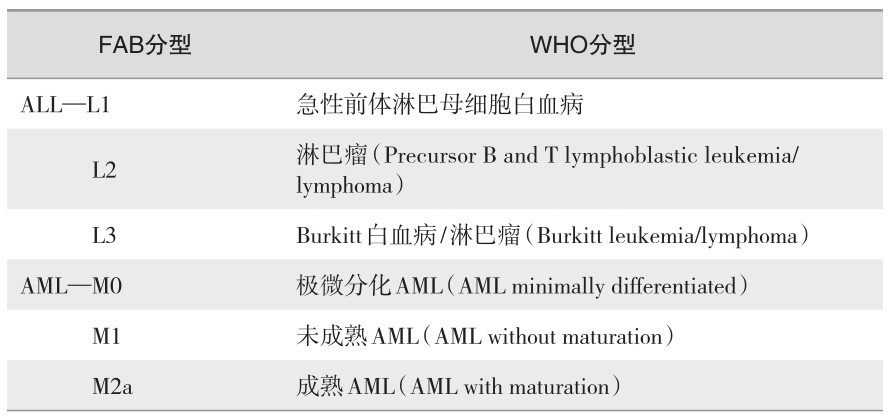
由于白血病细胞起源、分化和生物学行为不同,构成了白血病的异质性,因此急性白血病的全面、正确分型是准确、及时治疗的前提。传统的白血病诊断和分型主要依据骨髓涂片中血细胞形态和分类及化学染色检查来确定。根据白血病自然病程长短将白血病分为急性和慢性两大类;按细胞起源不同又可分为髓细胞系、淋巴细胞系以及特殊类型等不同类型白血病。随着血液病在发病机制、诊断方法以及治疗手段等方面的进展,急性白血病的诊断技术也有了很大发展,急性白血病的分型基本上分三个阶段。分别为:FAB分型1976 (M)、MIC分型1986(MIC)和WHO分型2001(MICM)。
(1) 急性白血病FAB分型:FAB分型法依据白血病细胞的形态学将急性白血病分为急性淋巴细胞白血病(ALL)和急性髓细胞白血病(AML)两大类型。ALL根据细胞大小及形态又分为L1 ~ L3三种亚型;AML按细胞类型不同又分为M0 ~ M7八种亚型,如下:
1) M0(急性髓细胞白血病微分化型):骨髓原始细胞>30%,无嗜天青颗粒及Auer小体,核仁明显,CD33或CD13髓系标志(+),淋巴系表达(-),髓过氧化物酶(MPO)<3%,血小板抗原(-)。
2) M1(急性粒细胞白血病未分化型):原粒细胞≥90% NEC, MPO(+)>3%。
3) M2(急性粒细胞白血病部分分化型):① M2a:原粒细胞30%~ 89%,粒细胞>10%,单核细胞<20%。② M2b:骨髓中原始及早幼粒细胞增多,但以异常的中性中幼粒细胞为主,有明显的核质发育不平衡,核仁常见,此类细胞>30%。
4) M3(急性早幼粒细胞白血病):以颗粒增多的异常早幼粒细胞增生为主,>30% NEC,胞核大小不一,胞质中有大小不等的颗粒。M3a:粗颗粒型;M3b:细颗粒型。
5) M4(急性粒—单核细胞白血病):原始细胞>30% NEC,粒系30%~ 80%,单核细胞>20%。① M4a:原始+早幼粒细胞增生为主,原幼单+单核细胞>20% NEC。② M4b:原幼单核细胞增生为主,原粒+早幼粒>20% NEC。③ M4c:原始细胞既有粒系又有单核系细胞特征,>30% NEC。④ M4Eo:嗜酸颗粒粗大的嗜酸粒细胞>5% NEC。
6) M5(急性单核细胞白血病):单核细胞(原+早+成)≥80% NEC。M5a:原幼单≥80%。M5b:原幼单<80%。
7) M6(急性红白血病):骨髓中幼红细胞≥50%。
8) M7:急性巨核细胞白血病:骨髓中巨核细胞系异常增生,以原、幼巨核细胞为主,其中原始巨核细胞≥30%,可见原始巨核细胞和小巨核细胞。小巨核细胞类似淋巴细胞,体积较小,直径多为10 μm,胞质圆形或椭圆形,边缘不整齐,呈云雾状或毛刺状;核染色质粗糙,可见核仁;胞质量较少,呈不透明的灰蓝色或嗜多色性,一般无颗粒。血片中也可见小巨核细胞以及畸形和巨型的血小板。
未分化型(M7a):外周血有原巨核(小巨核)细胞;骨髓中原巨核细胞>30%(非红系),须有组化电镜或单克隆抗体证实。骨髓细胞少,往往干抽。活检有原始和巨核细胞增多,网状纤维增多。
分化型(M7b):骨髓及外周血中以单圆核和多圆核病态巨核细胞为主。
(2) 白血病MICM分型:1986年FAB协作组提出了MICM分型法:M:形态学(morphology),I:免疫学(immunology),C:细胞遗传学(cytogenetics),M:分子生物学(Molecular biology)。该分型法以形态学为基础,免疫学和细胞遗传学作补充,相互结合,使分型更趋精确。由于形态学不能区分T、B细胞,M0、M7或形态偏差,采用I、C、M协助诊断。
免疫学髓细胞早期分化抗原:CD34、CD33、CD31、CD13、HLA—DR;髓细胞晚期分化抗原:CD15、CD14、CD11b、CD11c;T细胞标志:Cy CD3、CD7、CD2、CD1、CD5、CD4、CDIa;非T细胞标志:Cy CD22、CD19、CD10、CD20、CD24。
以下是临床常见的几个MICM分型:AML、ALL、CML—t(9;22)BCR/ABL基因,M2—t(8;21)AML/ETO基因,M3—t(15;17) PML/RARα基因,M4E0—Cinv(16)CBFβ—MYH11基因,L3(B-cell)—t(8;14)MYC-Ig H基因。
(3) WHO分型:髓系疾病:骨髓增殖性疾病(MPD)、骨髓增生异常(MD)、骨髓增生异常综合征(MDS)、急性髓系白血病(AML)。淋巴系肿瘤:B淋巴系统恶性肿瘤、T淋巴细胞、NK细胞肿瘤和霍奇金淋巴瘤。未将ALL单独分类,认为ALL和淋巴瘤均为淋巴系统恶性肿瘤,但仍保留ALL的概念。这一分类是以独立的疾病为基础,反映了造血组织肿瘤分型的最新进展并突出分子生物学检测与临床之间的关系(表2—11)。
表 2—11 白血病FAB分型和WHO分型对比
(续表)
诊断思路
白血病的诊断主要就是根据患者的临床表现、外周血象、骨髓象,再结合化学染色、免疫组化及相关基因检测来开展。
1. 急性淋巴细胞白血病
(1) 临床表现:除急性白血病一般表现,淋巴结肿大较为显著,其次为肝、脾、骨骼浸润,骨关节及胸骨压痛较明显,较易并发中枢神经系统白血病。(https://www.daowen.com)
(2) 血象
1) 白细胞多数增高,也可正常或降低;细胞分类以原始及幼稚淋巴细胞为主,可达90%以上,易见篮状细胞。中性粒细胞减少或缺如。
2) 红细胞、血红蛋白减少,一般为正细胞正色素性贫血,有时可见幼红细胞。
3) 血小板多减少。
(3) 骨髓象
1) 有核细胞增生极度活跃或明显活跃。
2) 淋巴细胞系增生显著,以原始和幼稚淋巴细胞增生为主,≥30%,高者可达90%以上,并伴有形态异常。白血病细胞胞体大小不等;胞核形态不规则,可有凹陷、折叠、切迹等畸形;核仁增多、增大;胞质染较深蓝色,可有空泡。根据骨髓中淋巴细胞特征,可将ALL分为L1型、L2型、L3型三种亚型。
3) 粒系、红系细胞增生均明显受抑。
4) 巨核细胞明显减少或消失,血小板少见。
5) 骨髓涂片中易见篮状细胞。
(4) 急性淋巴细胞白血病(ALL)分型:L1:原始和幼稚淋巴细胞以小细胞(直径≤12 μm)为主,核形多规则,染色质较粗而一致,胞质少,过氧化物酶或苏丹黑染色阴性。L2:原始和幼稚淋巴细胞以大细胞(直径>12 μm)为主,有时大小不等。核形不规则,染色质疏松而不一致,胞质常较多,有些细胞深染。L3:原始和幼稚淋巴细胞以大细胞为主,大小较一致。核形较规则,染色质均匀细点状。胞质较多,深蓝色,空泡多明显,呈蜂窝状。
(5) 细胞化学染色
1) 过氧化物酶(POX)与苏丹黑B(SB)染色:各阶段淋巴细胞均为阴性,原始细胞阳性率应<3%。
2) 糖原染色(PAS):原始淋巴细胞多呈红色粗大颗粒状或块状阳性反应,PAS积分明显增高。
3) 中性粒细胞碱性磷酸酶(NAP)染色NAP积分增高。
(6) 中枢神经系统白血病(CNSL)的检查:ALL较易并发CNSL,所以ALL患者也应注意做CNSL的相关检查。CNSL在临床上的主要诊断依据为:①有中枢神经系统的症状和体征,如头痛、呕吐、颈项强直、昏迷等。②有脑脊液改变,如压力增高、白细胞增多、涂片找到白血病细胞、蛋白质含量增多等。③排除其他原因造成的类似症状和脑脊液改变。
2. 急性髓细胞白血病 急性髓细胞白血病(AML)是造血系统髓系细胞的恶性肿瘤,将原始细胞≥20%即归于AML范畴内。常见于青壮年、中老年人,患者肝、脾浸润较明显。
多应用细胞形态为主的FAB分类法可分为以下几类:
(1) 急性髓细胞白血病微分化型(M0型)
1) 骨髓中原始细胞>30%,可达90%。原始细胞处于较早期的分化阶段,形态学上识别困难。细胞圆形,大小不等;核圆形,染色质细致,核仁明显;胞质量少,嗜碱性,透明无颗粒及Auer小体,易被误诊为ALL中的L1或L2型。
2) 细胞化学染色:①过氧化物酶(POX)与苏丹黑B(SB)染色,原始细胞为阴性或阳性率<3%。② PAS及特异性酯酶染色:阴性或弱阳性。
3) 免疫学检验:可表达髓系分化抗原CD13、CD33、CD11b的一种,不表达T、B系特异抗原,可表达无系列特异性未成熟标志CD34、Td T、HLA—DR。
4) 其他检查:可有染色体异常,有淋巴细胞免疫标志时常见t(9;22),电镜下可见细胞质中髓过氧化物酶(MPO)阳性。
(2) M1急性粒细胞白血病未分化型
1) 骨髓中原粒细胞(Ⅰ+Ⅱ型)≥90%(非红系),早幼粒细胞很少,中性中幼粒细胞以下阶段不见或罕见。原始粒细胞核大,染色质细致,核仁多且清晰,胞质染淡蓝色,可见Auer小体(Ⅰ型:典型原粒细胞,胞质中无颗粒;Ⅱ型:有原粒细胞的特征,胞质量少,有少量细小的颗粒)。
2) 细胞化学染色:过氧化物酶(POX)与苏丹黑B(SB)染色,原始细胞阳性率应>3%。特异性酯酶染色:阳性。
3) 免疫学检验:表达HDLA—DR、CD13、CD33、CD34、MPO。
(3) M2急性粒细胞白血病部分分化型:分两型,其中M2b曾被称为亚急性粒细胞白血病。
1) M2a骨髓中原粒细胞(Ⅰ+Ⅱ型):30%~<90%(非红系),早幼粒细胞以下阶段>10%,单核细胞<20%;细胞形态不规则,核形多不规则,半数病例的细胞胞质中可见Auer小体。M2b型:骨髓中原始粒和早幼粒细胞增多,以异常的中性中幼粒细胞增生为主,≥30%;该细胞胞核与胞质发育极不平衡,核染色质细致疏松,核仁1 ~ 2个,大而明显,胞质量丰富,染粉红色,含有大量细小粉红色中性颗粒,可见Auer小体。
2) 细胞化学染色:POX与SB染色阳性。PAS染色:原始粒细胞阴性,早幼粒细胞为弱阳性;特异性酯酶染色:阳性;非特异性酯酶染色:可呈阳性,不被Na F抑制。NAP染色:积分明显降低。
3) 免疫学检验:表达HDLA—DR、CD13、CD33、CD34、CD57。
4) 其他检查:90% M2b型患者有t(8;21)染色体异位。
(4) M3急性早幼粒细胞白血病:血象和骨髓象中出现大量异常增生的早幼粒细胞为主要特征,骨髓中以异常早幼粒细胞为主,≥30%(非红系),此类细胞大小不等,外形多不规则,胞核略小,常偏位且形态不一,可见双核、花瓣状、折叠、扭曲等多种形态,核仁1 ~ 3个,有的被颗粒遮盖而不清楚,胞质较丰富,染蓝色或灰蓝色,易见Auer小体,有的胞质中含有多条的Auer小体呈交叉状排列,形似柴捆,称之为“柴捆细胞”。此外,胞质中还含大量大小不等的紫红色嗜天青颗粒,分布于胞质。由于颗粒大小不等,又分为两型,即:①粗颗粒型(M3a):嗜苯胺蓝颗粒粗大,密集甚或融合,可有较多的Auer小体,有时呈柴束状排列。②细颗粒型(M3b):嗜苯胺蓝颗粒密集而细小。
(5) M4急性粒—单核细胞白血病(AMMo L):是一种粒细胞系和单核细胞系同时发生恶性增生的白血病,白血病细胞具有粒系和单核细胞特征或兼具两者特征,约占AML发病率的15%,除粒系、单核系增生外,20%的患者可有异常的嗜酸性粒细胞增多。
此型白血病骨髓中及外周血中有粒系及单核细胞系两种细胞均增生,按原粒和单核细胞系形态不同,可分为四种类型:① M4a:原始和早幼粒细胞增生为主,原幼单和单核细胞>20%(非红系)。② M4b:原幼单核细胞增生为主,原始和早幼粒细胞>20%(非红系)。③ M4c:原始细胞既具粒系,又具单核细胞系形态特征者>30%。④ M4Eo:除上述特点外,有异常嗜酸性粒细胞(颗粒粗大而圆,着色较深)增多,占5%~ 30%。
(6) M5:急性单核细胞白血病外周血可出现一定数量的原始、幼稚单核细胞,骨髓中以原始、幼稚单核细胞增生为主,此类细胞体积较大,外形不规则;胞核形态不一,可呈肾形、马蹄形、“S”形、“山”形等,可见胞核扭曲、折叠;核染色质细致疏松如细网状,核仁1 ~ 3个,大而清楚;胞质丰富,染深蓝或灰蓝色,可见空泡和Auer小体。根据分化程度,分两型:①未分化型(M5a):骨髓中原始单核细胞(非红系)≥80%。②部分分化型(M5b):骨髓中原始和幼稚单核细胞>30%(非红系),原单核细胞<80%。
(7) M6:急性红白血病临床上M6通常依次经过红血病期、红白血病期、白血病期三个阶段。红细胞系和粒系(或单核系)同时异常增生;原始粒(或原始单+幼稚单核细胞)≥30%(NEC)。红系增生明显,>50%,以中、晚幼红细胞为主,幼红细胞大小不均,胞核与胞质发育不平,出现胞体巨大,外形不规则,胞质丰富,核染色质细致的类巨幼样改变和核形不规则,核凹陷、扭曲,双核、多核,核碎裂和巨型核等副幼红细胞改变。血片中原粒(Ⅰ、Ⅱ型)或原单核细胞>5%,骨髓非红系中原粒或原、幼单核细胞>20%。
(8) M7:急性巨核细胞白血病骨髓中巨核细胞系异常增生,以原、幼巨核细胞为主,其中原始巨核细胞≥30%,可见巨型原始巨核细胞和小巨核细胞。小巨核细胞类似淋巴细胞,体积较小,直径多为10 μm,胞质圆形或椭圆形,边缘不整齐,呈云雾状或毛刺状;核染色质粗糙,可见核仁;胞质量较少,呈不透明的灰蓝色或嗜多色性,一般无颗粒。血片中也可见小巨核细胞和畸形、巨型的血小板。未分化型(M7a):外周血有原巨核(小巨核)细胞;骨髓中原巨核细胞>30%(非红系),须有组化电镜或单克隆抗体证实。骨髓细胞少,往往干抽。活检有原始和巨核细胞增多,网状纤维增多。分化型(M7b):骨髓及外周血中以单圆核和多圆核病态巨核细胞为主。
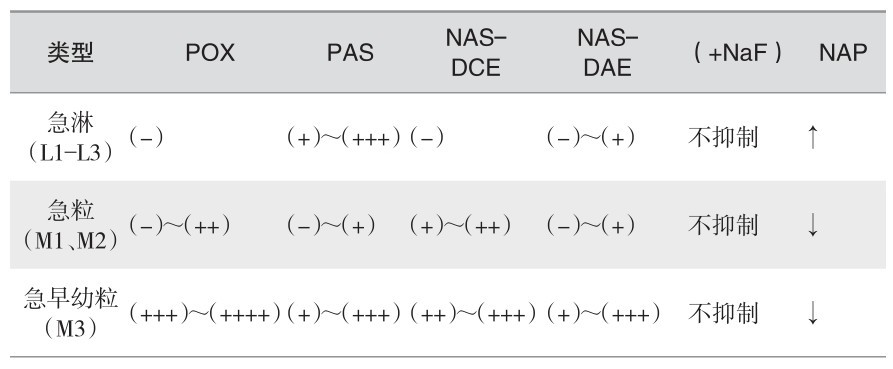
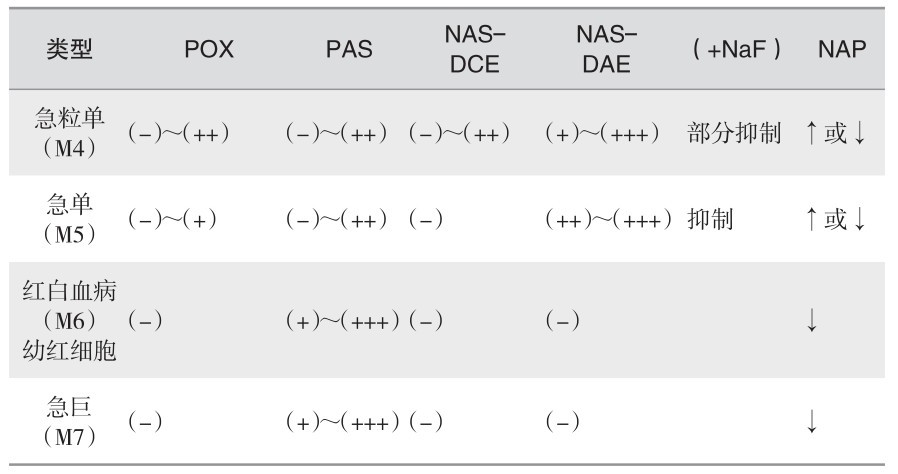
(9) 各型急性白血病细胞的化学染色特征:见表2—12。
表 2—12 各型急性白血病细胞的化学染色特征
(续表)
2. 慢性白血病
(1) 慢性粒细胞白血病:本病是造血干细胞的异常克隆性增殖性疾病,占CL的95%以上,在我国白血病中的发病率仅次于急粒和急淋,排第三位,好发于20 ~ 50岁,男性略多于女性。自然病程:慢性期、加速期、急变期。
1) 临床表现:本病起病缓慢,可出现低热、乏力、盗汗,最突出体征是脾肿大。
2) 血象:①白细胞总数显著升高。早期多在50×109/L以下,进展期可升至(100 ~ 300)×109/L,最高可达1 000×109/L。以中性中幼粒以下阶段为主,嗜酸性细胞、嗜碱性粒细胞也增高,嗜碱性粒细胞可高达10%~ 20%,为慢粒特征之一。原始粒细胞一般<10%,随病情进展,原始粒细胞比例增多,加速期可>10%,急变期>20%。粒细胞大小不一,核质发育不平衡,可出现退行性变,偶见Auer小体。②红细胞晚期可减少,为正细胞正色性贫血,可见有核红细胞。③血小板早期增多或正常,加速期及急变期可进行性下降,血小板大小不均,可见巨大、畸形血小板。
3) 骨髓象:①有核细胞增生极度活跃,粒红比值显著上升,可达10∶1 ~ 50∶1。幼红细胞和巨核细胞早期常增多,晚期减少。②骨髓片中,细胞分类与周围血相似,粒系细胞增生显著,可见到各期粒细胞以中性中幼粒、晚幼粒和杆状核粒细胞增生为主,嗜酸性粒细胞、嗜碱性粒细胞常明显增多,原始粒细胞+早幼粒细胞<10%。粒细胞形态改变同外周血。原始细胞若比例增高,则提示疾病向加速期和急变期转化。
4) 细胞化学染色:90%患者成熟的中性粒细胞碱性磷酸酶活性明显降低。
5) 染色体检查:Ph染色体见于90%以上慢粒患者。Ph染色体被认为是慢粒多能干细胞的肿瘤性标志,少数慢粒患者Ph染色体为阴性,根据有无Ph染色体可将慢粒分为Ph阳性和Ph阴性两大类,前者预后优于后者。
(2) 慢性淋巴细胞白血病:是由于单克隆小淋巴细胞扩增、蓄积浸润骨髓、血液、淋巴结和其他器官,最终导致正常造血功能衰竭的恶性疾病。
1) 血象:持续性淋巴细胞增多,正细胞正色素贫血。白细胞计数>10×109/L,分类:淋巴细胞>50%,绝对值>5.0×109/L;以成熟淋巴细胞为主,可见幼稚淋巴细胞及异型淋巴细胞。血小板正常或减少。
2) 骨髓象:增生活跃至极度活跃,以成熟淋巴细胞增生明显,占40%以上,原、幼稚淋巴细胞<10%。红系、粒系相对减少,巨核细胞正常或减少。
3) 免疫分型:多数为B细胞性,T细胞者少。血免疫球蛋白减少;或为单株免疫球蛋白增高,多为Ig M型。κ轻链或λ轻链检测阳性。
4) 染色体:约50%患者有染色体异常。
3. 特殊类型白血病
(1) 多毛细胞白血病:是一种少见的慢性淋巴细胞增殖性疾病。多见于中老年人,男性多见,与慢淋不同的是淋巴结多不肿大,而脾进行性肿大,其中半数为巨脾。血象常呈全血细胞减少,部分病例白细胞正常或增高,血片中可见数量不等的多毛细胞,其特征是形态类似大淋巴细胞,但胞质周边有伪足突起或呈锯齿状或散乱不齐,部分病例可见毛发状伸出,核圆或肾形,染色质或致密或疏松,偶见核仁。骨髓穿刺由于骨髓网状纤维增生,常为“干抽”图片呈三系减少,可见数量不等的多毛细胞。
(2) 幼淋巴细胞白血病:是一种淋巴细胞恶性增生的慢性白血病。常发生在老年人,起病缓慢,可无明显的自觉症状,部分病例可有消瘦、纳差、盗汗、乏力及上腹部不适,淋巴结一般不大,脾肿大较突出,常为巨脾。大多数病例为B细胞型,少数病例为细胞型。白细胞总数明显升高,常>100×109/L,血和骨髓中可见大量幼淋巴细胞,多>60%。酸性磷酸酶染色阳性而被左旋酒石酸完全抑制,非特异性酯酶阴性等特征,可与多毛细胞白血病区别。
(3) 成人T细胞白血病:是一种少见的T细胞受累的淋巴细胞白血病。本病由人类嗜T细胞病毒所致。好发于成年人,以中、老年人为主,临床表现多样,除脏器浸润外,常有皮肤浸润、溶骨性损害及高钙血症。典型病例呈急性或亚急性过程,少数慢性经过。血和骨髓中的白血病细胞大小不等,核形显著不规则,有深而复杂的凹陷、折叠或扭曲,可呈分叶状、花瓣状、脑回状等,染色质较粗糙,核仁明显。
(4) 慢性中性粒细胞白血病:是以成熟中性粒细胞恶性增生为主的少见白血病,临床表现和血液学特征与慢粒很相似。血中白细胞>20×109/L,成熟中性粒细胞常>80%,且颗粒粗,有少数中、晚幼粒细胞,嗜碱性粒细胞很少见或不见,中性粒细胞碱性磷酸酶活性增高。骨髓中成熟中性粒细胞>70%,原粒细胞和早幼粒细胞<10%, Ph染色体阴性。
(5) 嗜酸性粒细胞白血病:临床表现为各脏器的嗜酸性粒细胞浸润,病程的长短和快慢与嗜酸性粒细胞成熟程度有关,临床分急、慢性两型。血象中常有贫血和血小板减少,白细胞数增高,常>50×109/L,嗜酸性粒细胞占20%~ 90%,多数在60%以上,以嗜酸性中幼粒及晚幼粒细胞增多为主,可有形态异常,如细胞大小不均,双核、颗粒粗大,杂有很多嗜碱性颗粒,胞质中可有空泡。骨髓中除原粒细胞增高外,嗜酸性粒细胞明显增多并有左移。
(6) 嗜碱性粒细胞白血病:是一种罕见类型白血病,临床上分两型:急性型和慢性型。白细胞数增高,嗜碱性细胞增多,一般>20%,
可见各阶段嗜碱性细胞,血红蛋白和血小板减少。骨髓中可见大量嗜碱性细胞,原粒细胞>5%,常为小原粒细胞,有大量嗜碱性中幼粒细胞。
(7) 全髓白血病:是一种以骨髓红细胞、白细胞及巨核细胞三系同时异常增生为特征的急性白血病。临床表现与其他类型急性白血病相似,血象似M6型,骨髓中红细胞、粒细胞和巨核细胞三系均异常增生,且伴形态学改变,幼红细胞呈巨幼样变,粒系细胞明显左移,可见核质发育不平衡,巨核系细胞显著增多,达正常10倍以上,幼稚型巨核细胞占10%以上,可见病态巨核细胞。
诊断应注意的问题
目前急性白血病的分类仍较复杂,免疫分型能提高分型的准确性,但不是疾病的诊断。理想分类法应该以形态学为基础,结合免疫学和细胞遗传学、分子生物学提供信息。
应用细胞遗传学的检查,尤其是高分辨分带技术的开展,将急性白血病的分型又往前推进一步。据报道,有80% AML及ALL有染色体核型异常。随着分子生物学研究的不断拓宽,正显示染色体核型变化与基因异常密切相关。其中以M3型的染色体t(15;17)及其PML—RARα基因、M2b型的染色体t(8;21)及其AML1—ETO基因和M4EO型染色体inv(16)及其CBFβ—MYH11基因最有特异性。
