系统性红斑狼疮
第六节 系统性红斑狼疮
病史摘要
患者,26岁,女性,面部红斑,关节痛半年,水肿,双下肢紫癜、咳嗽2个月入院。患者半年前分娩后出现面部红斑,有光过敏,同时出现全身关节疼痛,并有肿胀,能自行缓解。近2个月来,无明显诱因出现双下肢水肿,尿量减少,夜尿2 ~ 3次,双下肢出现紫癜及瘀斑,间有牙龈出血。于当地检查发现蛋白尿及血小板减少,为进一步诊治来我院。既往史、个人史、月经婚育史、家族史无特殊。
体格检查:血压150/96 mm Hg,头发稀少,干枯,颜面部及唇周红斑,轻度贫血貌,口腔内可见3个溃疡,心肺听诊正常,肝脾不大,双手可见红斑,双腕关节稍肿胀,双下肢中度凹陷性水肿,可见紫癜及瘀斑。
辅助检查:血常规示白细胞3.1×109/L,血红蛋白96 g/L,血小板28×109/L;尿常规示蛋白质(++++),葡萄糖(—),尿胆原(—),红细胞(+) ~ (++)/HP,白细胞3 ~ 5个/HP;血液生化检查示BUN 9.2 mmol/L, Cr 96.3 μmmol/L,UA 336.7 μmmol/L,ALT 38 U/L,TP 52.6 g/L,Alb 20.4 g/L,GLO 22.2 g/L,TG 3.14 mmol/L,Chol 9.2 mmol/L;血沉86 mm/h,CRP 25.7 mg/dl;Ig G 14.2 g/L;免疫系列:RF(—),ANA 1∶320 (周边型);A—ds DNA(+)。
诊断解析
根据以上检查结果,该患者诊断考虑:系统性红斑狼疮(SLE),狼疮性肾炎(病情活动期)。
依据:①为生育期女性,病程半年。②面部蝶形红斑。③非侵蚀性关节炎,关节肿痛。④口腔溃疡。⑤全血细胞减少。⑥大量蛋白尿、血尿。⑦补体C3低,ANA阳性。⑧免疫学检查A—ds DNA阳性。根据SLE的诊断标准,该病例符合7条,并排除其他结缔组织疾病、感染性疾病、血液系统肿瘤,可以诊断为SLE。
下一步需要做的检查:① 24小时尿蛋白定量。②补体C3、C4。③查胸片以便进一步评估病情演变程度。
知识拓展
SLE是系统性自身免疫性疾病的典型,具有大量致病性自身抗体和免疫复合物,累及多系统、多脏器,是一种病因不明的慢性炎症性自身免疫病,病程以病情缓解和急性交替发作为特点。本病好发于生育年龄女性,女∶男=9∶1,在儿童和老年约为3∶1,在世界上,我国患病率偏高,为0.1%,高于西方国家报道的0.05%。
1. 病因
(1) 遗传:SLE患者的近亲发病率为5%~ 12%;同卵孪生的发病率为24%~ 57%,而异卵孪生则为3%~ 9%;SLE是个多基因病,多个基因在某种条件(环境)下相互作用改变了正常免疫耐受而致病,基因与临床亚型及自身抗体有一定的相关性。
(2) 性激素:多见于育龄妇女,妊娠可诱发SLE。
(3) 环境
1) 感染:有人认为结核杆菌和链球菌感染与本病的发病有关。迄今为止,尚未证实任何病原体与SLE的发病有直接关系。病原体可能仅是一种多克隆B细胞刺激因子,促发了SLE的发生。
2) 日光:约40%的SLE患者对日光过敏。紫外线照射可使皮肤上皮细胞出现凋亡,新抗原暴露而成为自身抗原。
3) 化学因素:染发剂、口红等有机化合物,均被疑为可诱发SLE。
4) 药物:四环素和磺胺类可增加SLE的光敏感性。
5) 生物因素:某些生物制剂如重组干扰素等在部分患者可发生自身免疫性疾病。
6) 社会和心理压力。
2. 发病机制及免疫异常 发病机制尚不明确。具有本病遗传素质的人在上述一种或多种因素作用下,机体丧失了正常的免疫耐受性,B细胞活化,通过交叉反应与模拟外来抗原的自身抗原相结合,并将抗原递呈给T细胞,使之活化,在T细胞活化刺激下,B细胞产生大量不同类型的自身抗体,造成大量组织损伤。
诊断思路
在系统性红斑狼疮的诊断过程中,必须综合分析临床表现、实验室检查指标(血常规、肝肾功能和各类自身抗体、补体)、病理学、影像学检查结果做出准确判断。
1. 临床表现 由于存在多种自身抗体,SLE可损害任何系统、脏器和组织,其临床表现复杂多样,个体差异较大。许多患者隐匿起病,开始仅累及1 ~ 2个系统,表现轻度的关节炎、皮疹或隐匿性肾炎;部分患者长期稳定在亚临床状态或轻型狼疮,部分患者可由轻型突然变为重症狼疮,更多的则由轻型逐渐出现多系统损害;也有一些患者一开始就累及多个系统,甚至一起病就表现出狼疮危象,危及生命。SLE的自然病程多表现为病情的加重与缓解交替。
(1) 全身症状:发热、乏力、体重下降。SLE患者常常出现发热,为中、低度热。发热往往提示疾病处于活动期,高热则常常是疾病急进期的表现。发热可以是SLE的表现,也可能是感染,临床上需注意鉴别。凡有发热的SLE,必须常规做细菌学检查,尤其是在免疫抑制治疗中出现的发热,更应警惕感染。疲倦、乏力可早于其他症状,常是狼疮活动的先兆。
(2) 皮肤与黏膜:SLE可出现多种多样的皮肤损害。40%面部有蝶形红斑,偶可为盘状红斑,60%有广泛或局限性斑丘疹,多见于日晒部位,还可见红斑、红点、丘疹、紫癜、水疱、指掌部或甲周红斑、指端缺血等。其中以颊部蝶形红斑最具特征性。SLE皮疹多无明显瘙痒。明显瘙痒者提示过敏,免疫抑制治疗后的瘙痒性皮疹应注意真菌感染。部分有光敏感、皮下结节、网状青斑、脱发、雷诺现象等。口腔溃疡或黏膜糜烂也是SLE常见的表现,口腔和口唇黏膜糜烂伴有明显水肿者,往往是SLE进行性加重的预兆。在免疫抑制和(或)抗生素治疗后的口腔糜烂,应注意口腔真菌感染。另外,治疗中的SLE患者,若不明原因出现局部皮肤疼痛(常是灼痛),应警惕是带状疱疹的前兆。
(3) 关节和肌肉表现:关节痛常见,出现在指、腕、膝关节,伴红肿者少见,多不对称,也可有晨僵现象,但非侵蚀性,多不引起骨质破坏。偶有因关节周围肌腱受损而出现关节畸形。治疗中的SLE患者出现髋关节隐痛不适,需注意无菌性股骨头坏死,多与激素副作用有关。肌痛和肌无力也常见,谷草转氨酶和乳酸脱氢酶也常增高,少数合并肌炎者肌酸磷酸激酶可明显增高。
(4) 肾脏损害:SLE的临床肾损害各家报道不一,多为50%~ 75%,但肾活检显示几乎所有SLE均有病理学改变。临床表现为蛋白尿、血尿、肾性高血压、肾功能不全等。早期患者以蛋白尿和尿中出现多量红细胞为常见。大部分患者在病程较早阶段,其肾损害经合理治疗后症状可以消失或缓解,也有一部分呈进行性发展为肾功能衰竭。狼疮性肾炎对SLE预后影响甚大,肾功能衰竭是SLE的主要死亡原因之一。
(5) 神经系统损害:有25%患者累及中枢神经系统,尤以累及脑为多见,故称为神经精神狼疮(NP狼疮)。神经系统损害多表现为癫痫和精神症状,但实际上可损害神经系统的任何部分,引起各种神经精神损害的表现,如头痛、呕吐、偏瘫、癫痫、意识障碍;或为幻觉、妄想、猜疑、性格改变、记忆力减退或轻度认知障碍等各种精神障碍症状。少数患者出现脊髓损伤,表现为截瘫、大小便失禁等。
(6) 血液系统表现:SLE常出现贫血(60%)、白细胞减少(40%)或血小板减少(20%)。短期内出现重度贫血常是自身免疫性溶血所致(10%)。约20%患者有无痛性轻或中度淋巴结肿大,以颈部和腋下为多见。淋巴结病理往往表现为淋巴组织反应性增生,少数为坏死性淋巴结炎。约15%患者有脾大。血小板减少与血小板抗体、抗磷脂抗体以及骨髓巨细胞成熟障碍有关,细胞毒免疫抑制剂可引起血小板减少,但一般伴有白细胞减少。SLE本身可出现白细胞减少,治疗SLE的细胞毒免疫抑制剂也常引起白细胞减少,两者需要认真鉴别:SLE的白细胞减少,一般发生在治疗前或疾病复发时,多数对激素治疗敏感;细胞毒免疫抑制剂所致的白细胞减少,其发生和恢复有一定的规律。(https://www.daowen.com)
(7) 浆膜炎:SLE常出现胸膜炎、心包炎和腹膜炎,包括双侧中小量胸腔积液、中小量心包积液。SLE的浆膜腔积液为渗出液;蛋白质和LDH明显高于血浆含量,葡萄糖略低于血糖;细胞计数显示白细胞增高,急性期以多形核细胞为主,1 ~ 2周后逐渐变为淋巴细胞为主;免疫学检查显示,Ig G或Ig M增高,补体下降,抗核抗体阳性,若滴度高于血清更有特异性;胸膜病理显示非特异性的淋巴细胞和浆细胞浸润、纤维化。临床上以浆膜炎为主要症状的SLE常被误诊误治。青年(尤其是女性)的渗出性浆膜腔积液,除结核外则应注意SLE的可能性。
(8) 肺部表现:约35%患者有胸腔积液,多为中小量、双侧性。除因浆膜炎所致外,部分是因低白蛋白血症引起的漏出液。除胸膜炎外,少数患者可出现狼疮肺炎,表现为发热、干咳、气促,X线可见片状浸润影,多在下肺(注意排除感染);偶有肺间质病变,表现为活动后气促、干咳、低氧血症,X线表现为肺纹理增粗,肺功能示弥散功能下降。肺动脉高压多出现在有肺血管炎或有雷诺现象患者。
(9) 心血管表现:约30%患者有心血管表现,其中以心包炎最常见,可为纤维素性心包炎或为心包积液。患者有心前区疼痛或无症状,超声心动图对诊断有很大帮助。约10%患者有心肌损害,可有气促、心前区不适、心脏增大、心律失常、心绞痛或心肌梗死等,心电图、UCG等有助于诊断。约10%可发生周围血管病变,如血栓性血管炎等。多数情况下,SLE的心肌损害不太严重,但是在重症的SLE,常常伴有心功能不全,而且心功能不全往往是预后不良的重要指征。少数患者可发生周围血管病变,如血栓性静脉炎等。
(10) 消化系统表现:SLE可出现恶心、呕吐、腹痛、腹水、腹泻或便秘,其中以腹泻较常见,可伴有蛋白质丢失性肠炎,是继狼疮性肾炎之后导致SLE低蛋白血症的另一个主要原因。活动期SLE可出现严重腹痛、腹膜炎、肠系膜血管炎等类似急腹症表现,甚至被误诊为胃穿孔、肠梗阻而手术探查。SLE以急腹症为主要表现者相对不常见,但以之为首发表现者往往被误诊误治。SLE常见肝酶增高(40%),仅少数出现严重肝损害和黄疸。
(11) 眼睛:结膜炎、葡萄膜炎、眼底改变、视神经病变等。眼底改变包括出血、视神经乳头水肿、视网膜渗出等,与视网膜血管炎有关。视神经病变可以一夜间突然致盲。
(12) 继发性干燥综合征:见于30%患者,表现口干、眼干、阴道干。主要是由于外分泌腺受累所致,常伴有血清抗SSB、抗SSA抗体阳性。
(13) 抗磷脂抗体综合征(APS):可以出现在SLE的活动期。其临床表现为动脉和(或)静脉的血栓形成、习惯性自发性流产、血小板减少,患者血清不止一次出现抗磷脂抗体。SLE患者血清中可以出现抗磷脂抗体而不一定有APS。APS出现在SLE者为继发性APS。
2. 实验室和辅助检查
(1) 一般检查:周围血象表现为红细胞、白细胞和血小板减少;约10%的患者有溶血性贫血,抗人球蛋白试验阳性;病情活动时血沉增快,血清冷球蛋白和丙种球蛋白增高;狼疮性肾炎时,尿中可有蛋白质、红细胞、管型。
(2) 自身抗体:见表5—4。
表 5—4 自身抗体
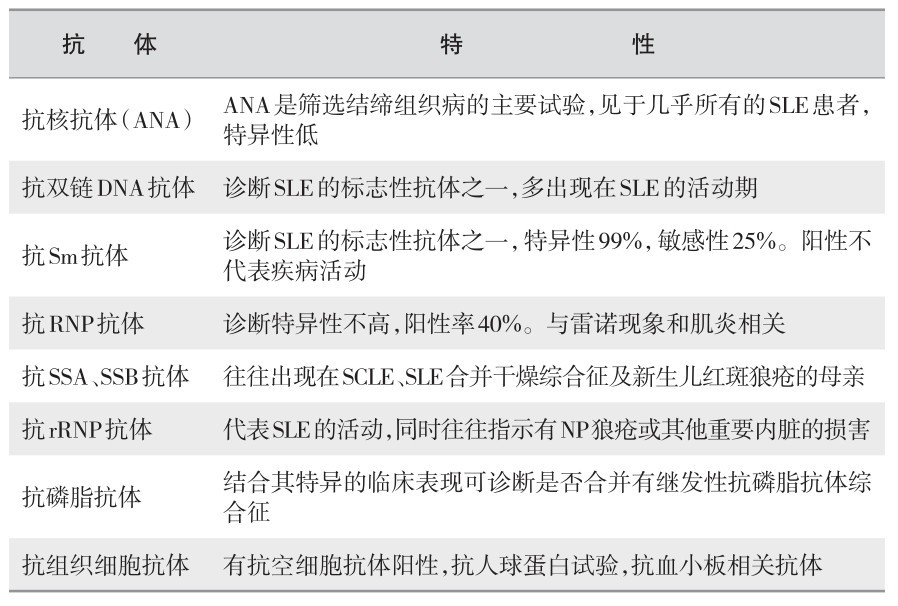
(3) 补体:在本病活动期,血清补体总溶血能力(CH50)、C3、C4含量减低。补体低下,是表示SLE活动的指标之一。可以作为治疗效果的监测指标。
(4) 影像学检查:X线及影像学检查有助于早期发现器官损害;如头颅MRI、CT对患者脑部的梗死性或出血性病灶的发现和治疗提供帮助;高分辨CT有助于早期肺间质性病变的发现。超声心动图对心包积液、心肌、心瓣膜病变、肺动脉高压等有较高敏感性而有利于早期诊断。
(5) 肾活检:肾穿刺活组织检查对狼疮性肾炎的治疗和预后估计有一定价值。肾组织活动性病变:肾小球坏死、细胞性新月体、透明血栓、肾间质炎症浸润、坏死性血管炎等。慢性病变为:肾小球硬化、纤维性新月体、肾间质纤维化、肾小管萎缩等。
3. 诊断 美国风湿病学会1982年修订的SLE分类标准如下:
(1) 颊部红斑:固定红斑,扁平或高起,在两颧突出部位。
(2) 盘状红斑:片状高起于皮肤的红斑,黏附有角质脱屑和毛囊栓;陈旧病变可发生萎缩性瘢痕。
(3) 光过敏:对日光有明显的反应,引起皮疹,从病史中得知或医生观察到。
(4) 口腔溃疡:经医生观察到的口腔或鼻咽部溃疡,一般为无痛性。
(5) 关节炎:非侵蚀性关节炎,累及2个或更多的外周关节,有压痛、肿胀或积液。
(6) 浆膜炎:胸膜炎或心包炎。
(7) 肾脏病变:尿蛋白>0.5 g/24 h,尿蛋白定量(+++)。
(8) 神经病变:癫痫发作或精神病,除外药物或已知的代谢紊乱。
(9) 血液学疾病:溶血性贫血,或白细胞减少,或淋巴细胞减少,或血小板减少。
(10) 免疫学异常:狼疮细胞阳性,或抗ds—DNA抗体阳性,或抗SM抗体阳性,或至少持续6个月的梅毒血清试验假阳性。
(11) 抗核抗体:在任何时候和未用药物诱发“药物性狼疮”的情况下,抗核抗体滴度异常。
在上述11项中,如果有≥4项阳性(包括在病程中任何时候发生的),则可诊断为SLE,其特异性为98%,敏感性为97%。
诊断应注意的问题
临床上SLE的误诊率甚高,20世纪70年代美国狼疮基金会调查的结果显示,SLE患者从最初出现狼疮样症状至被确诊为狼疮的平均时间是3年。随着检验技术的提高和人们对SLE的认识提高,SLE的诊断率逐渐提高。但仍有许多开始为轻型的SLE,由于误诊误治,使病情拖延至重症狼疮才被确诊。SLE常常被误诊为风湿热、类风湿关节炎、慢性肾炎、皮肤过敏、结核性胸膜炎、特发性血小板减少性紫癜、癫痫病、精神病等,更有一些以发热为主要表现者被误为顽固性感染而轮番使用高级抗生素。
抗核抗体应被列为关节炎、肾炎、长期发热、顽固性皮肤过敏、胸膜炎、各种血细胞减少、脱发、口腔溃疡等症的常规筛选试验。在诊断慢性肾炎之前先排除狼疮性肾炎。
对于有两个以上系统的症状者,如关节痛和口腔溃疡,关节痛和蛋白尿,关节痛和脱发,皮疹和蛋白尿,胸膜炎和蛋白尿,胸膜炎和关节痛等,应警惕狼疮。
