胶原蛋白的结构和性质
1.胶原蛋白的氨基酸组成及结构特征
胶原蛋白多由三条多肽链组成,呈三股螺旋结构,与其他蛋白质一样具有一级、二级、三级和四级结构。每条多肽链含有18种以上的氨基酸,由1 000余个氨基酸残基构成,单个α链含有多个甘—X—Y(Gly—X—Y)序列。Ⅰ型胶原的α链大约由1 052个氨基酸残基构成,其中甘—脯—Y(Gly—Pro—Y)三肽约占Gly—X—Y三肽总和的1/3。Gly—Pro—Y三肽的存在使α链形成Ⅰ型胶原特有的左手螺旋结构(图4-5),在螺旋结构的两端有两条端肽,分别叫C-端肽和N-端肽。三条左旋α链以平行、右手螺旋形式,相互缠绕形成“草绳状”复合右手大螺旋体,即原胶原分子(tropo collagen,图4-6、图4-7),原胶原分子为细长的三股螺旋结构,长度约300nm,直径约 1.5nm。原胶原分子按“四分之一错列”方式平行排列成束,通过共价交联形成稳定的韧性很强的微原纤维(microfibril)。微原纤维分子间通过侧链进一步交联,形成胶原纤维和胶原纤维束。胶原分子间的聚集依靠氢键、离子键、疏水作用而发生,除这些作用外,分子内及分子链间的共价交联赋予胶原高度的物理化学稳定性,其排列结构如图4-8所示。
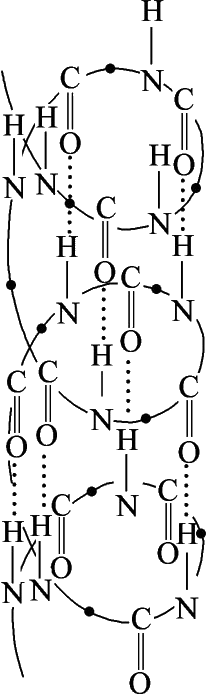
图4-5 单条肽链的α螺旋结构

图4-6 胶原的右手超 螺旋结构

图4-7 胶原多聚体三螺旋轴 的C端投影
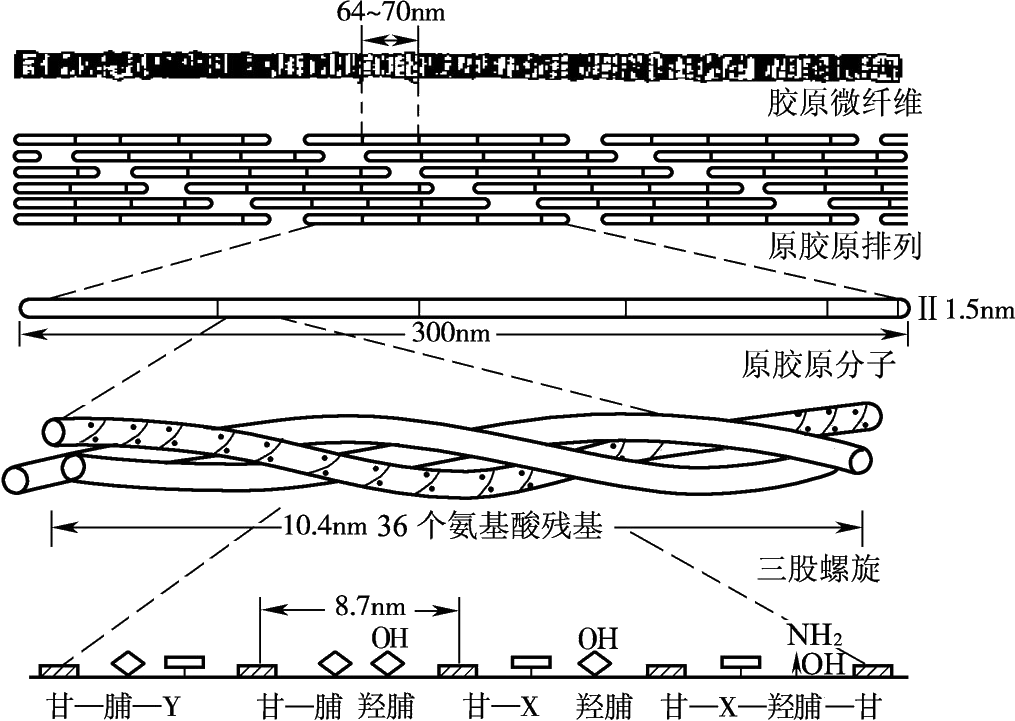
图4-8 胶原排列结构示意图
2.胶原的主要性质
(1)胶原的物理化学性质。胶原蛋白是广泛存在于细胞外基质中的蛋白质家族。因此,胶原蛋白具有蛋白质的通性,例如两性电离及等电点,紫外特征吸收及颜色反应,胶体性质及沉淀和凝固等特点。此外,酸、碱、盐和蛋白酶等都可以与胶原产生化学作用,胶原在酸或碱的长时间作用下,其交联键会遭到破坏,故而发生降解;中性盐与胶原的作用依盐的种类不同而异,有的中性盐可使胶原脱水,有的则会引起胶原充水而发生膨胀;多种蛋白酶对胶原具有降解作用,使其成为水解胶原或多聚肽。
(2)胶原的生物化学性质。在国内外的报道中,有关胶原生物化学性质的研究最多。下述胶原的一些生物化学性质是其适宜作生物材料、医学材料、保健品和化妆品原料的基础性质。
①细胞适应性及细胞增殖作用。胶原蛋白作为细胞生长的依附和支架,能诱导上皮细胞等的增殖、分化和迁移,细胞在胶原中能存活得更久。这是由于胶原的α链及胶原多肽对细胞具有良好的适应性和黏附性,对成纤维细胞有一定的生物诱导作用,能促进细胞增殖,促进分泌伤口愈合物质,有利于细胞的长入和基质沉积、新生血管生成和伤口愈合。已有临床报道,在胶原蛋白凝胶中培养肝细胞诱导聚集体的形成,使每个细胞合成白蛋白的量比非聚集体增加2倍。所以胶原被广泛用作美容整形品、医药品、化妆品和护肤护发用品的原料。
②止血性能。天然的胶原聚集体是良好的止血材料。这是因为胶原的独特结构,特别是四级结构,使其具有良好的凝血能力。其止血机理为:血小板首先黏附在胶原表面,诱导血小板释放,随后血小板开始聚集并产生血栓,使血浆结块达到止血。用胶原蛋白制造止血材料(海绵、膜、水凝胶)就是利用胶原的这种特性,目前已有不少临床用品。
③免疫性能。胶原蛋白具有免疫性,但免疫性很低,只有大剂量注射才能引起免疫反应。而且不溶性胶原蛋白的免疫性比可溶性胶原蛋白的更低。胶原蛋白的免疫性可通过去除端肽或使胶原蛋白形成网状结构来抑制。目前,已有多项制备非免疫胶原蛋白的专利。因此,含异体胶原蛋白的医疗器械可长期植入人体而只产生很低的免疫反应。
④可生物降解性。天然胶原虽具有紧密牢固的螺旋结构,但在生物酶作用下可以部分或全部水解。绝大多数蛋白酶只能破坏胶原侧链,胶原酶则能使肽键断裂(水解)。肽键一旦断裂,其螺旋结构随即破坏,断裂的胶原多肽链可被多种蛋白酶进一步水解成更小的胶原多肽片断,甚至是氨基酸。水解后的胶原多肽或氨基酸易被生物体作为营养成分吸收,这就是胶原蛋白或其改性材料广泛用于生物医学材料的基础。胶原蛋白做生物医学材料时,可通过胶原分子侧链间交联的减弱或增强来调控胶原材料的生物降解性,保持胶原的主要性能,满足实际应用要求。
