二、实验原理
2026年01月16日
二、实验原理
药物制剂的基本要求是安全、有效、稳定。如果药物分解变质或发生物理形态变化,不仅会使疗效降低,甚至会产生严重的不良反应。药物的稳定性主要包括化学稳定性、物理稳定性和生物学稳定性。其中,化学稳定性主要表现为药物在放置过程中发生降解反应。药物的化学结构不同,其降解反应也不相同。水解和氧化是药物降解的主要途径。
青霉素G钾盐在碱性水溶液中迅速破坏,残余未破坏的青霉素G钾盐可用碘量法测定,即先经碱处理,生成青霉噻唑酸,后者可被碘氧化。过量的碘可用硫代硫酸钠溶液滴定。
反应方程式如下:

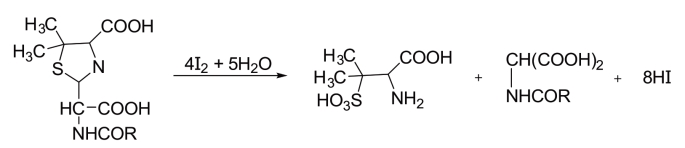
随着青霉素G钾盐溶液放置时间的延长,残余未破坏的青霉素G钾盐越来越少,故碘液消耗量也相应减小。碘液的消耗量(mL)是残余青霉素G钾盐浓度的函数。用碘液消耗量的对数对时间作图,如为一直线,即表明青霉素G钾盐的降解为一级反应。因为这个反应与pH有关,故实际上是伪一级反应。一级反应的反应物浓度计算公式如下:(https://www.daowen.com)
![]()
式中:C0为t=0时反应物的浓度,C为t时间反应物的浓度,k为反应速率常数(s-1,min-1,h-1或d-1)。通常可以从上述公式的斜率求出各种温度的反应速率常数。
反应速率常数与温度的关系符合Arrhenius公式:
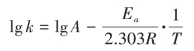
式中:A为阿伦尼乌斯常数,单位与k相同;Ea为活化能(kJ/mol);T为绝对温度(K);R为气体常数[kJ/mol·K]。通常以反应速率常数的对数对反应温度(绝对温度)的倒数作图,从图中即可求得室温时的反应速率常数,由此可计算得到室温时的有效期t0.9(t0.9=0.106/k)。
